基于剪切波频散超声振动技术的大鼠肝纤维化粘弹性测量
郭燕荣, 陈 昕, 林浩铭, 郑 翊, 张新宇, 汪天富, 陈思平, 沈圆圆
1.医学超声关键技术国家地方联合工程实验室,广东省生物医学信息检测与超声成像重点实验室,深圳大学医学院生物医学工程系(深圳,518060) 2.美国 St. Cloud State University 电子与计算机工程(明尼苏达,56301)
基于剪切波频散超声振动技术的大鼠肝纤维化粘弹性测量
郭燕荣1, 陈 昕1, 林浩铭1, 郑 翊2, 张新宇1, 汪天富1, 陈思平1, 沈圆圆1
1.医学超声关键技术国家地方联合工程实验室,广东省生物医学信息检测与超声成像重点实验室,深圳大学医学院生物医学工程系(深圳,518060) 2.美国 St. Cloud State University 电子与计算机工程(明尼苏达,56301)
肝纤维化会引起肝脏组织力学特性的变化,剪切波频散超声振动技术可以无创定量地测量肝脏组织的粘弹性。本研究采用大鼠肝纤维化动物模型,利用剪切波频散超声振动技术,基于粘弹性Zener模型同时得到大鼠肝纤维化组织的粘性和弹性系数。研究结果显示剪切波的速度在不同频率是频散的,肝脏组织的粘性对剪切波具有影响。基于Zener模型得到肝纤维化F0~F4期的弹性系数和粘性系数的平均值范围分别为0.76~2.93kPa和1.09~2.01Pa·s,弹性系数随着肝纤维化程度的加深存在明显递增的趋势。弹性系数的受试者工作特征曲线面积(AUROC)值为0.92(>=F2), 0.98(>=F3),和0.99(F4),粘性系数的AUROC下值面积值为0.85(>=F2), 0.71(>=F3)和0.73(F4)。弹性系数对肝纤维化进行分期相对于粘性系数更加灵敏。
肝纤维化;频散;剪切波频散超声振动技术;粘弹性
0 引言
肝纤维化是一种常见的慢性进行性肝病,是细胞外基质蛋白在肝脏的弥漫性过度沉积的病理改变。如果肝纤维化得不到有效的治疗,最终会导致肝硬化、肝功能衰减,严重的会需要肝移植[1]。肝组织活检是当前诊断和评估肝纤维化分级的金标准,然而,它是一种创伤性检查,穿刺后疼痛以及其他并发症使其应用存在很大的局限性。此外,肝纤维化在肝内分布不均匀,而肝纤维化活检采样仅为肝脏的局部组织,有可能造成诊断误差。因此,肝活检不能作为治疗效果追踪和评估的频繁性检查手段,探索无创、简单、可靠的肝纤维化的诊断方法成为当务之急。
临床实践发现,生物组织的硬度或者弹性的变化往往暗示着病变的发生[2],如常见的乳腺癌、前列腺癌等恶性疾病其硬化程度明显大于病变前的正常组织[3],因此如果能够定量获得组织的弹性系数,将会对疾病的早期诊断产生重要的作用。目前,已有的肝脏组织的弹性测量研究方法主要有:磁共振弹性成像(Magnetic Resonance Elastography, MRE)[4]、准静态弹性成像[5]、瞬时弹性成像(Transient Elastography, TE)[6]、声辐射力脉冲弹性成像(Acoustic Radiation Force Impulse, ARFI)[7]、快速剪切波成像(Supersonic Shear Imaging, SSI)[8]和剪切波频散超声振动(Shear Wave Dispersion Ultrasound Vibrometry,SDUV)[9]等。目前大部分测量方法得出的是组织的弹性系数而忽略了其粘性系数。然而,采用MRE方法的研究发现剪切肝脏组织的粘性和肝纤维化程度存在一定的关系,实验结果表明粘性系数可以对肝纤维化组织的诊断提供有用的信息[10-11]。超声激励组织内部会产生剪切波,剪切波在组织中传播的频散特性与肝组织的粘性和弹性密切相关,如Klatt等人采用MRE技术推断对应频率(25~62.5Hz)的粘弹性的频散性质[12]。最近,一些超声弹性成像的研究同样应用多频的方法来测量肝脏的力学特性,如Deffieux等人采用快速剪切波成像技术来获得健康志愿者肝脏的频散曲线(75~450Hz),结果说明在一定的频率范围内肝组织的粘弹性是高度频散的[13];Chen采用SDUV技术进行了猪正常肝脏体外实验,在频散测量结果方面与Deffieux的研究结果相似[14]。然而,就目前所知,对于不同分期的肝纤维化组织,很少有研究通过同时测量其粘性和弹性的改变来进行肝纤维化组织分期的评估。
本研究采用SDUV技术进行不同分期的肝纤维化组织的粘弹性系数测量。传统上SDUV技术使用超声脉冲辐射力在组织中产生剪切波,通过脉冲回波技术探测出剪切波传播的速度,根据Vogit模型,从而得到定量的组织的弹性系数和粘性系数[9]。如图1(a)所示,Voigt模型分别由一个弹簧单元E和一个粘壶单元η 并联组成。Voigt 模型虽然能够准确地描述组织的应变蠕变和恢复过程,但是对于应力松弛的过程却不能准确描述[15],因此对一些生物组织或材料的粘弹性系数估计并不准确[16-17]。与Voigt模型不同,Zener 模型由弹簧单元与粘壶单元串联组成整体后与弹簧单元并联组成,如图1(b)所示。Zener 模型不仅可以描述应变蠕变和恢复过程,也可以描述应力松弛过程[15,18]。因此Zener模型可以对均匀的、不可压缩介质的粘弹性特性估计更加准确。
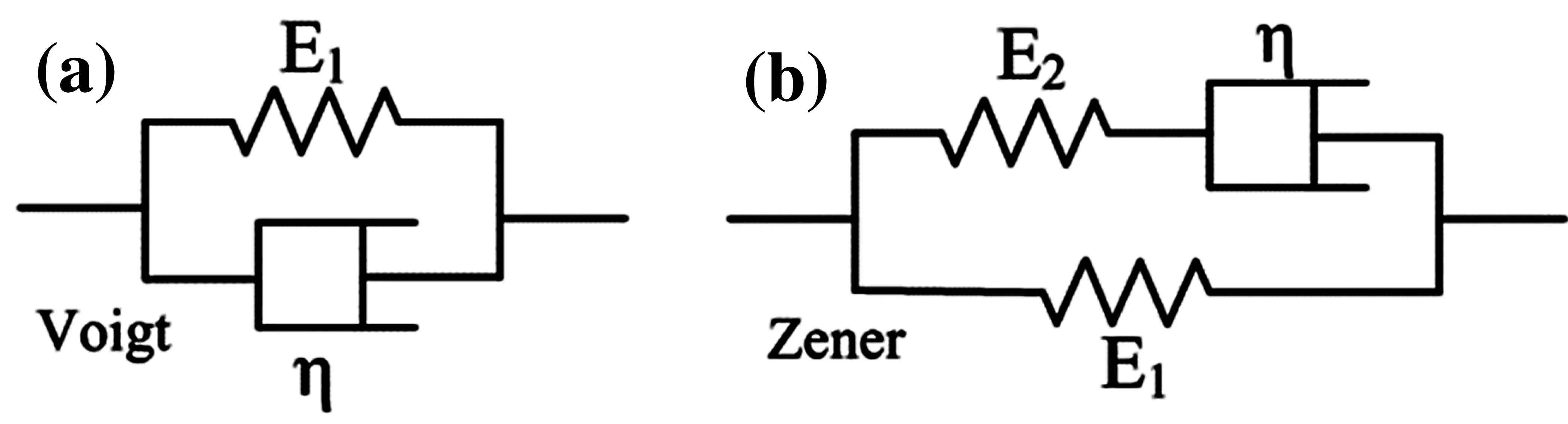
图1 两种模型元件图
本研究采用大鼠肝纤维化动物模型,利用剪切波频散超声振动技术来测量大鼠不同分期肝纤维化组织的力学特性,然后基于Zener模型的理论推导,得到大鼠肝纤维化组织的粘性和弹性系数,探讨粘弹性系数对肝纤维化进行分级的效果。
1 方法和实验
1.1SDUV原理
SDUV技术使用超声脉冲辐射力在组织中产生剪切波,通过脉冲回波技术探测出剪切波传播的速度。从回波信号中估计出各频率剪切波的振动相位,从而计算组织的粘弹性系数[9]。
对于一个均匀介质,其Zener模型中的剪切波的速度[19]可表示如下:

(1)
其中,ρ,E1,E2,η分别是介质的密度ρ,弹性系数E1,弹性系数E2和粘性系数η。剪切波的速度可以由在传播过程中一定距离上的相位差估计得到:
cs=ωsΔr/Δφs
(2)
其中,Δφs是在传播距离差Δr上的相位变化值。在多频的境况下用公式(2)得到不同频率下的剪切波声速,然后代入公式(1)拟合得到弹性系数和粘性系数(由于E1值更加符合实际生物组织的弹性描述,因此后续的弹性系数指的是E1[20])。
1.2实验方法
平台硬件系统包括激励和检测两个部分[21],如图2所示。激励部分由任意函数发生器1触发任意函数发生器2输出激励波形,经功率放大器(53dB增益)放大后作用于激励探头,激励探头采用工作频率为1.04±0.1MHz的单阵元功率探头。检测部分则由SonixRP(加拿大Ultrasonix公司)完成,可通过编程对SonixRP的发射和接收进行控制,设定时序,并对回波信息进行保存,然后在计算机上处理。任意函数发生器1通过外部触发的方式控制激励部分和检测部分从而保持两个部分的同步。激励探头和检测探头分别固定在三轴位移平台上并由位移台完成定位,大鼠肝脏组织嵌入明胶制成仿体,放在水槽中。
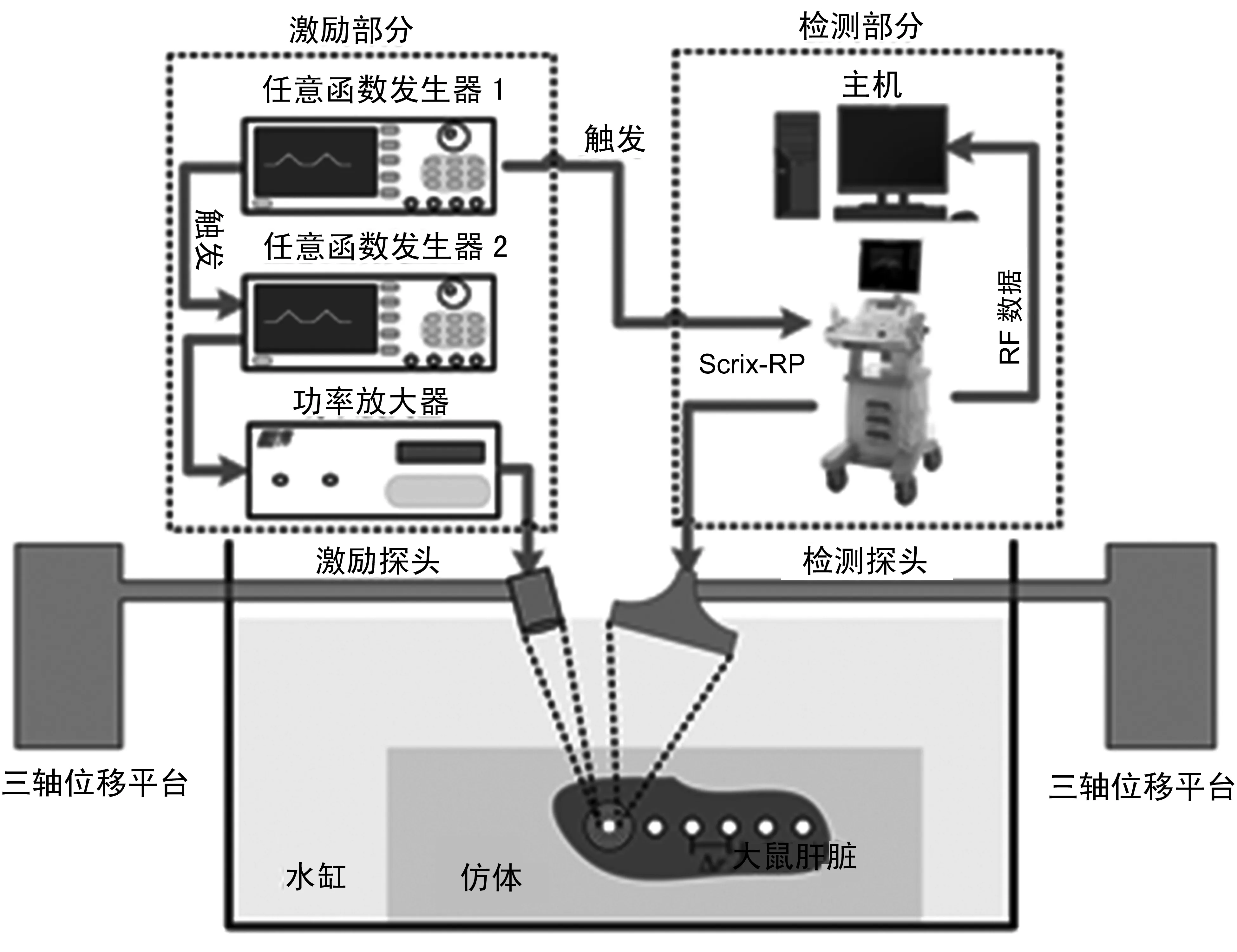
图2 实验系统框图Fig.2 Diagram of the experiment system
在超声测量之前,通过采用SonixRP的B模式扫描嵌入在仿体内的肝脏从而来提供对测量位置的图像保证。确定肝脏内部感兴趣的位置之后,调整激励探头和检测探头聚焦在此位置。数据采集过程的时序如图3所示,激励波形包括10个脉冲(E1~E10),每个脉冲的持续时间为200 μs,脉冲重复频率(PRF)为100 Hz,记为PRFe。激励脉冲激励组织在内部产生剪切波,剪切波的频率包括100 Hz及谐频200 Hz、300 Hz和400 Hz等等。检测序列通过SonixRP系统产生,PRF(PRFd)设定为2 kHz,整个检测脉冲的数量为200个(D1-D200),即每个激励脉冲的周期内有20个检测脉冲。激励序列和检测序列在时间上错开,防止干扰。系统控制检测探头对在剪切波传播同一方向上的十个不同的位置点进行回波信号的检测,相邻两个检测位置的距离是0.475 mm,与超声相邻阵元之间的距离相同。对于每个仿体中的肝脏组织,选择3~4个不同的位置进行测量。
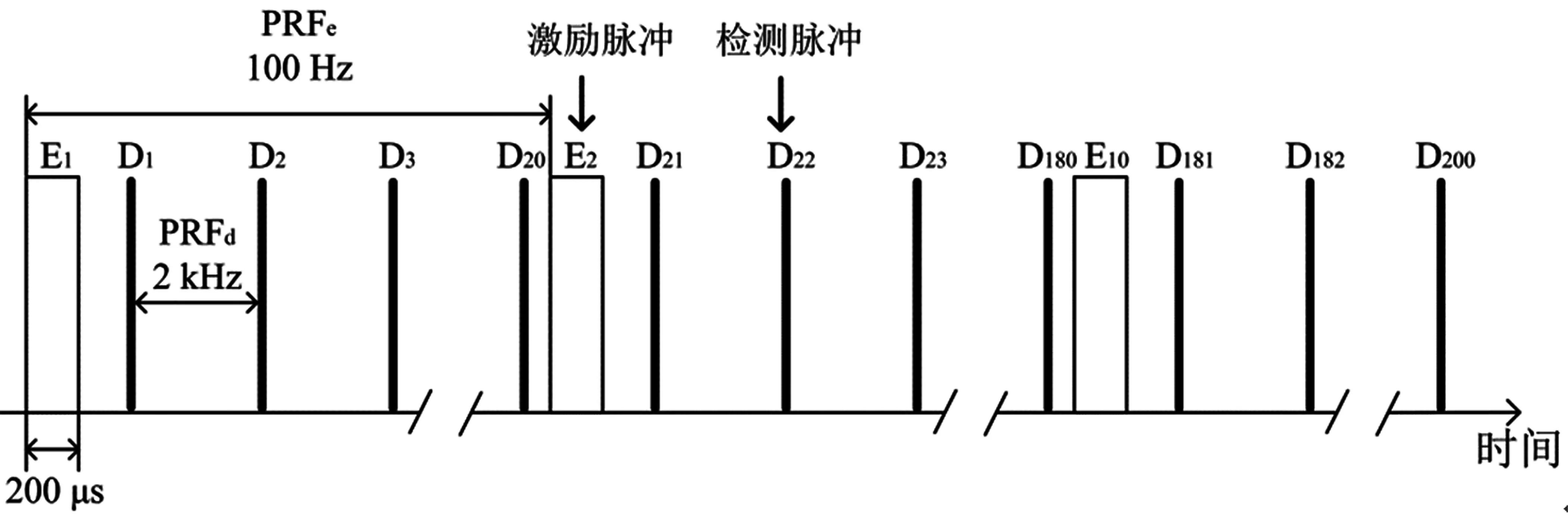
图3 激励序列与检测序列时序Fig.3 Timing of excitation and detection beam
1.3动物模型
本实验采用的肝纤维化大鼠模型由广东省医学动物实验中心培养而成。实验中心采用对SD大鼠进行背部皮下注射四氯化碳(CCl4)的方式来诱导肝纤维化,大鼠体重为200±10 g。按照0.3 mL/100 g体重分点注射50%CCl4的橄榄油溶液。首次注射量加倍,一周注射两次。通过不同的造模时间,可将大鼠诱导成肝纤维化的不同分期,即注射15天、30天、60天和90天。造模大鼠总共37只,同时将6只大鼠当作参考组。测量前取出大鼠肝脏左半叶嵌入明胶制成仿体,用来进行测量,将其它叶的大鼠肝脏浸泡在10%福尔马林中用于组织学评估。
1.4组织学评估
离体的肝脏组织浸泡在10%的福尔马林当中至少24 h后,进行常规石蜡包埋切片(厚度7 mm)。然后进行Masson三色染色。采用Olympus BX41显微镜进行观察分析。肝纤维化病理检测标准为:F0期表示无肝纤维化;F1表示汇管区扩大纤维化;F2期表示汇管区周围纤维化或纤维间隔形成,小叶结构保留;F3期表示纤维化伴小叶结构紊乱,无肝硬化;F4表示早期的或肯定的肝硬化。
2 数据处理及统计分析
2.1数据处理
本研究通过SonixRP系统采集RF回波信号,在Matlab环境下进行离线数据处理。回波数据包含了组织的振动信息,对其进行正交解调,可得出组织随时间变化的振动位移信息。实验时,在剪切波的传播方向上,设置距离相等的检测点,从而检测出不同位置的振动信息。图4显示的是在能量和方式相同的激励下,三个不同位置点(如图2仿体中所显示的点,任意相邻两点之间距离为0.475 mm)的振动位移随时间的变化曲线。黑色,红色,蓝色曲线分别表示的是检测到的距离振源由近及远的位置点的振动位移。从图4(a)可以看出,随着剪切波的传播,离振源较远位置的振动点的位移曲线滞后于较近处振动点的位移,表明相位存在一定的延时,同时距离振源较远点的幅值相比较近点振动点的位移幅值呈递减趋势,表明剪切波在传播过程中随着距离增大能量逐渐衰减。对振动位移进行频谱分析,如图4(b)所示,可以看出振动的能量在基频100 Hz处是最强的,谐频200 Hz,300 Hz,400 Hz处对应的振动能量依次减弱。当频率达到500 Hz及以上时,振动的能量已经淹没在噪声中。
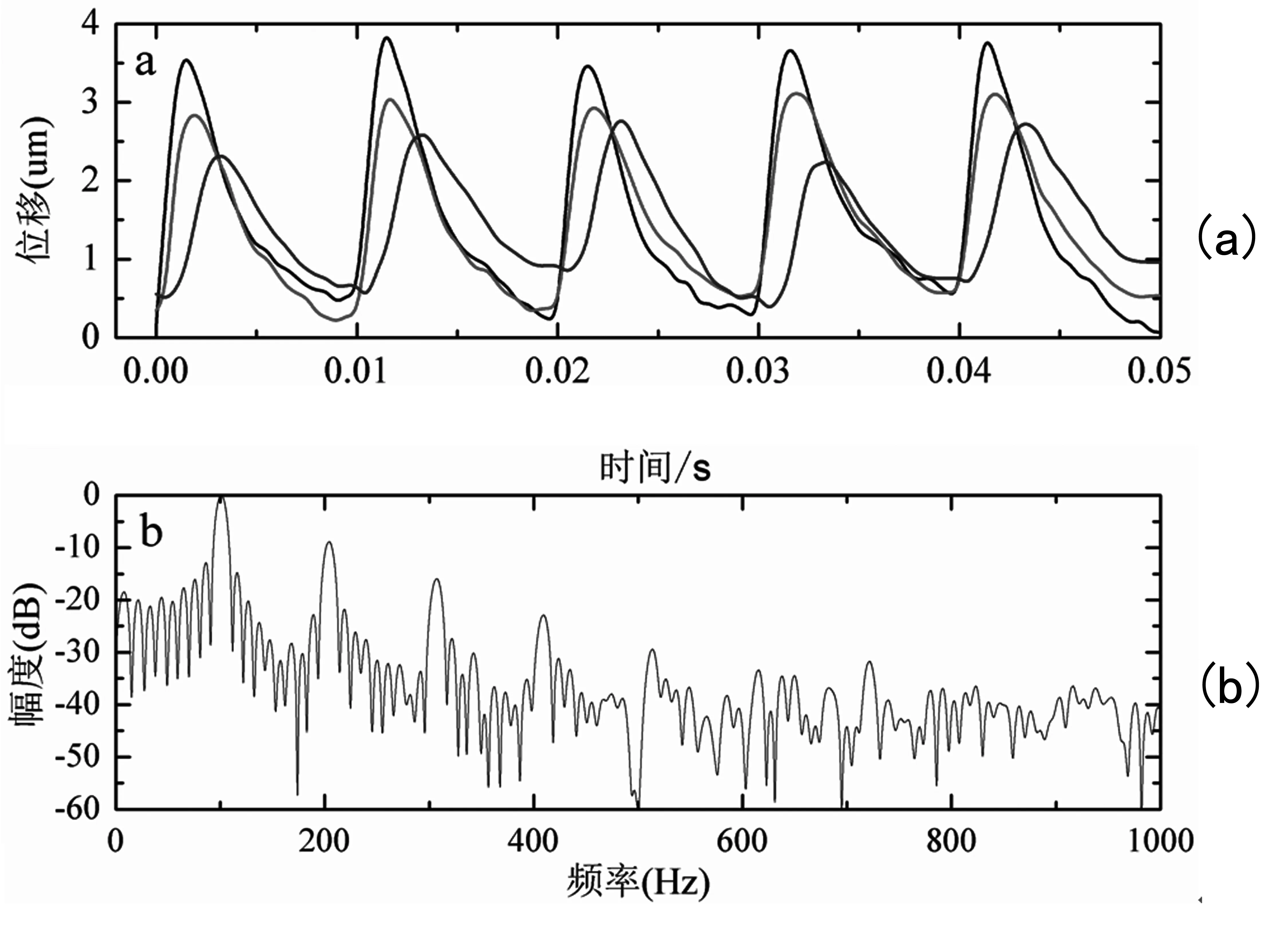
图4 不同检测点的振动位移图及其频谱Fig.4 Displacement of vibration and spectrumanalysis at different point
通过对沿着剪切波传播方向上的不同位置点的振动位移的分析,可以得到剪切波传播的相位信息。图5是距离振源0 mm、0.475 mm一直到2.375 mm处六个位置点的剪切波振动相位图。通过线性拟合可计算出相邻位置点之间的相位差,应用公式(2)则得到不同频率下的剪切波速度。100 Hz、200 Hz、300 Hz和400 Hz时,剪切波速度分别为1.64 m/s、1.84 m/s、2.07 m/s和2.12 m/s,可以看出随着频率的增加,剪切波的速度呈递增的趋势。图6所示为不同肝纤维化分期组织的剪切波速度频散曲线图。从图6可以看出,随着肝纤维化程度的增加,剪切波速度呈现增加的趋势。

图5 距离振源不同位置点的剪切波相位 Fig.5 Phase fitting at different frequencies

图6 分期频散曲线图Fig.6 Typical non-linear dispersion fit curves for each fibrosis stage
应用公式(1),由不同频率对应的剪切波速度,可计算出组织的弹性系数值和粘性系数值。图7为大鼠不同分期肝纤维化组织的弹性系数和粘性系数的箱线图。所有数据采用95%的置信区间计算总体平均值,统计结果如表1所示。通过对不同纤维化分期的肝脏的弹性系数和粘性系数的统计分析,可以看出随着肝纤维化程度的加深弹性系数是存在递增的趋势;粘性系数在肝纤维化早期有所增加,但在F2和F3期之间的递增趋势并不明显。
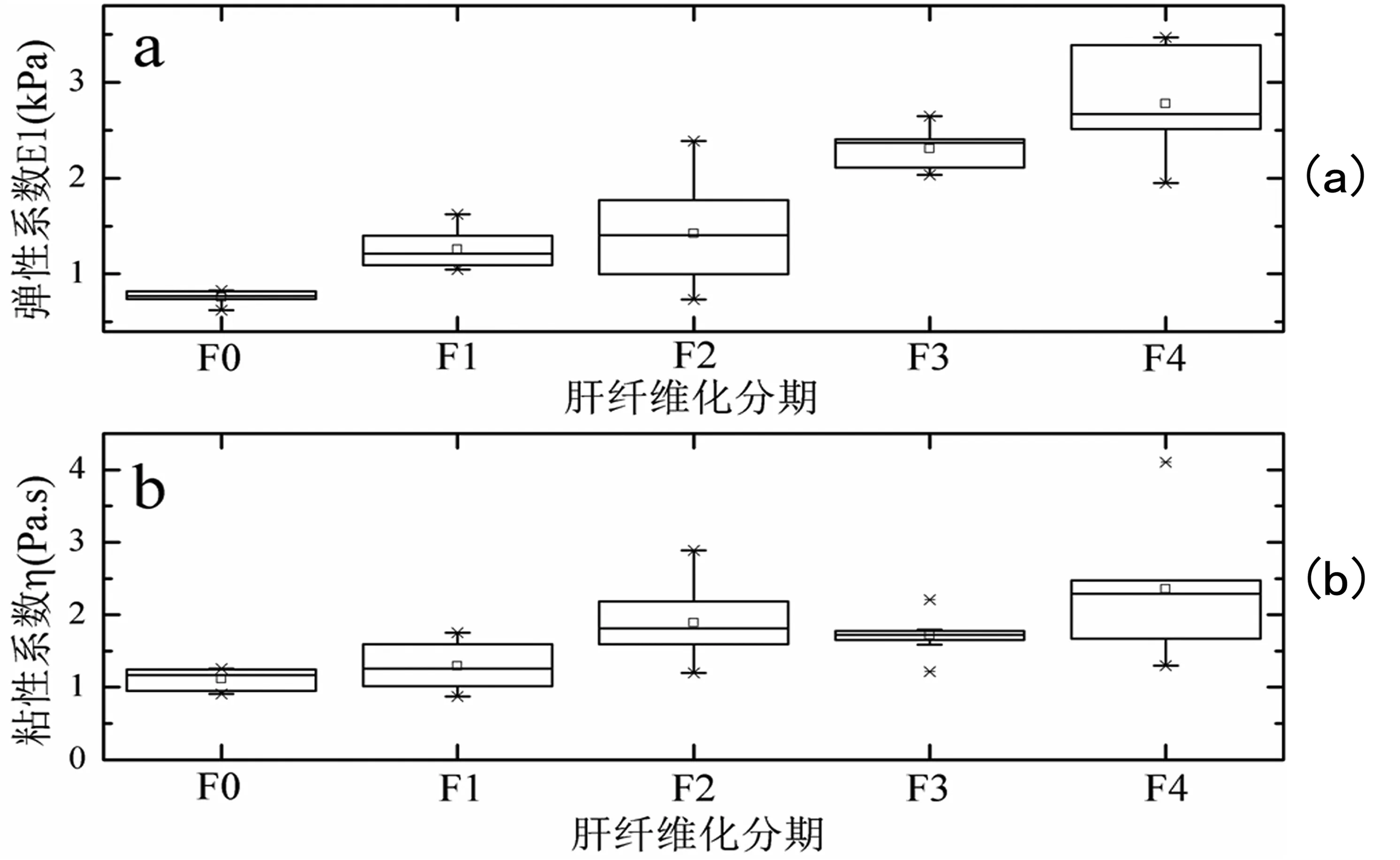
图7 大鼠不同分期肝纤维化的剪切粘弹性系数箱线图Fig.7 Box plots of (a) elasticity and (b) viscosity for each fibrosis stage

表1 大鼠肝纤维化F0~F4期的粘弹性系数Tab.1 Mean ± SD and 95% CI of viscoelasticity parameters for each fibrosis stage
本研究采用受试者工作特性曲线(ROC曲线)来研究用粘弹性系数在评估肝纤维化分期的有效性。图8为在肝纤维化分期评分≥F1, ≥F2, ≥F3, 和 F4的粘弹性ROC特性曲线图,红色代表弹性系数,蓝色代表粘性系数。表2是不同程度肝纤维化阶段之间的粘弹性对应的AUROC值及95%置信区间。在肝纤维化分期评分≥F1, ≥F2, ≥F3, 和 F4的弹性系数AUROC值分别为0.96、0.92、0.98、0.99,粘性系数AUROC值分别为0.89、0.85、0.71、0.73。因此,弹性系数在不同肝纤维化分期之间的区分能力比粘性系数要强。
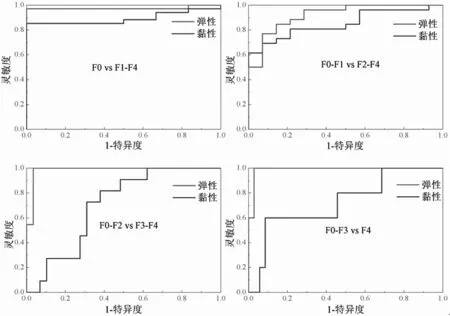
图8 大鼠肝脏ROC特性曲线图Fig.8 Receiver operating characteristic curves for elasticity (red) and viscosity (blue) at METAVIR fibrosis score

表2 不同肝纤维化分期的粘弹性系数AUROC值Tab.2 AUROC values for elasticity and viscosity according to fibrosis stage
3 讨论
肝组织活检是当前诊断和评估肝纤维化分级常规方法,但这种方法有创、主观性强、重复性差,并不能作为治疗效果追踪和评估的频繁性检查手段。弹性成像技术可以无创测量与组织病变密切相关的弹性系数,因此弹性成像成为检测肝纤维化的一种可选择的方法。本文采用SDUV技术测量大鼠不同纤维化分期的肝脏粘弹性系数。 SDUV技术的优势在于:它可以通过普通的超声换能器实现,较容易与临床超声系统相融合;可以同时定量地得到组织的粘性系数和弹性系数。
本文的研究结果表明,大鼠肝脏的弹性系数随着肝纤维化程度的加重而呈现明显增加的趋势。Wang等人采用声辐射力超声弹性成像技术对四氯化碳诱导的大鼠肝纤维化进行测量,得到F0期弹性模量为1.5 kPa,F3期为1.8 kPa[22]。本研究得到的大鼠肝纤维化的F0期和F3期弹性系数分别为0.76 kPa和2.36 kPa。两者得到的结果在数量级上一致,但是前者结果的弹性系数增加幅度没有本研究得到的结果的幅度大。可能的原因是前者采用的是声辐射力超声弹性成像技术,而本研究采用的是SDUV技术和Zener模型,同时考虑了粘性和弹性。Yin的研究采用MRE技术测得小鼠肝纤维化分期F0-F4弹性模量为1.38 kPa,1.68 kPa,2.15 kPa,2.69 kPa,5.02 kPa[23],弹性系数随着肝纤维程度的加深逐渐增大,这与本研究的结果是一致的。
中度纤维化AUROC(≥F2)是肝纤维化分期临床诊断中具有重要意义的参数[24]。本研究得到的弹性AUROC在中度纤维化(≥F2)是0.92,肝纤维化严重阶段(≥F3)是0.98,肝硬化期(F4)是0.99。现已报道临床上采用瞬时弹性成像技术得到的中度肝纤维化AUROC值为0.88[6],0.79[25],和0.83[26],采用ARFI技术的0.82[27]和0.94[28],采用SSI技术的0.95[29]和采用SDUV技术的是0.98[24]。上述结论与本研究结果差异的原因可能有以下几点:测量方法上的差异,大鼠肝纤维化模型诱导原因较于单一与实际肝纤维化有一定的差别。
生物组织的力学特性同时具有弹性和粘性。在MRE法[30-31]的研究中和超声弹性成像研究中[32-33]观察到了剪切波的频散特性,证明了肝脏组织的粘性对剪切波的影响。本研究的结果也显示剪切波速度在一定的频率范围明显是频散的(如图6所示),因此采用粘弹性模型进行后续的数据处理,比单纯的线性弹性模型更能准确地描述生物组织的力学特性。本文的研究结果显示,在频率≤400 Hz范围之内,弹性系数对于区分肝纤维化不同分期比较有效,而粘性系数区分组织肝纤维化分期的能力并不如弹性系数那么明显。这与Chen采用声辐射力方法评估肝脏疾病病人的研究得到的结果是相似的[24]。同时Bavu等人的研究[33]是采用SSI技术在113例C型肝炎病毒的病人进行检测,也得到相似的结论。虽然粘性在评估分期时作用不明显,但是用粘弹性模型可以更加准确地描述生物组织的力学特性。
本研究采用Zener模型得到肝纤维化弹性和粘性AUROC值(≥F2)分别为0.92和0.85。采用相同方法但采用Voigt模型得到AUROC值分别为0.98和0.86[24]。理论上采用多参数的Zener模型会比单纯采用黏弹性Vogit模型的准确性好,但对上述结果的差异性可能有下述原因造成:实验样品数量较少可能并不能完全体现模型之间的优势性;大鼠模型诱导成肝纤维化的因素比较单一,与实际人体肝纤维化有一定的差异。
本研究是将离体肝纤维化组织镶嵌人仿体中进行测量,是本研究的不足之处。因此后续的研究工作将进一步优化,对活体肝脏组织的粘弹性进行测量。
4 结论
本研究采用剪切波频散超声振动技术对大鼠的肝纤维化粘弹性系数进行测量。基于Zener模型,得到大鼠肝纤维化组织的粘性和弹性系数。结果显示剪切波速度在一定的频率范围是频散的,肝脏组织的粘性对剪切波具有影响,采用粘弹性模型更能准确地描述生物组织的力学特性。采用Zener模型得到的F0-F4期的大鼠肝纤维化的弹性系数分别为0.76±0.04 kPa、1.18±0.07 kPa、1.32±0.17 kPa、2.36±0.10 kPa和2.93±0.20 kPa,粘性系数分别为1.09±0.07 Pa·s、1.50±0.11 Pa·s、1.88±0.21 Pa·s、1.70±0.03 Pa·s和2.01±0.22 Pa·s。肝纤维化分期评分的弹性系数AUROC值分别为0.96(≥F1)、0.92(≥F2)、0.98(≥F3)、0.99 (F4),粘性系数AUROC值分别为0.89(≥F1)、0.85(≥F2)、0.71(≥F3)、0.73 (F4),弹性系数相比粘性系数对肝纤维化的分期更加灵敏。
[1] Bataller R, Brenner DA. Liver fibrosis[J]. Journal of Clinical Investigation. 2005, 115(2): 209-218.
[2] Fung YC. Biomechanics:mechanical properties of living tissues[M]. New York:Spring-Verlag,1993.
[3] Garra BS, Cespedes EI, Ophir J, et al. Elastography of breast lesions: initial clinical results[J]. Radiology. 1997, 202(1): 79-86.
[4] Muthupillai R, Lomas D, Rossman P, et al. Magnetic resonance elastography by direct visualization of propagating acoustic strain waves[J]. Science,1995, 269(5232): 1854-1857.
[5] Ophir J, Cespedes I, Ponnekanti H, et al. Elastography: a quantitative method for imaging the elasticity of biological tissues[J]. Ultrasonic imaging. 1991, 13(2): 111-134.
[6] Sandrin L, Fourquet B, Hasquenoph J-M et al. Transient elastography: a new noninvasive method for assessment of hepatic fibrosis[J]. Ultrasound in medicine & biology, 2003, 29(12): 1705-1713.
[7] Nightingale K, Soo MS, Nightingale R, et al. Acoustic radiation force impulse imaging: in vivo demonstration of clinical feasibility[J]. Ultrasound in medicine & biology, 2002, 28(2): 227-235.
[8] Bercoff J, Tanter M, Fink M. Supersonic shear imaging: a new technique for soft tissue elasticity mapping[J]. Ultrasonics, Ferroelectrics and Frequency Control, IEEE Transactions on, 2004, 51(4): 396-409.
[9] Zheng Y, Chen S, Tan W, et al. Detection of tissue harmonic motion induced by ultrasonic radiation force using pulse-echo ultrasound and Kalman filter[J]. Ultrasonics, Ferroelectrics and Frequency Control, IEEE Transactions on, 2007, 54(2): 290-300.
[10] Huwart L, Sempoux C, Salameh N, et al. Liver fibrosis: noninvasive assessment with MR elastography versus aspartate aminotransferase-to-platelet ratio index1[J]. Radiology, 2007, 245(2): 458-466.
[11] Salameh N, Peeters F, Sinkus R, et al. Hepatic viscoelastic parameters measured with MR elastography: correlations with quantitative analysis of liver fibrosis in the rat[J]. Journal of Magnetic Resonance Imaging, 2007, 26(4): 956-962.
[12] Klatt D, Hamhaber U, Asbach P, et al. Noninvasive assessment of the rheological behavior of human organs using multifrequency MR elastography: a study of brain and liver viscoelasticity[J]. Physics in medicine and biology, 2007, 52(24): 7281.
[13] Deffieux T, Montaldo G, Tanter M, et al. Shear wave spectroscopy for in vivo quantification of human soft tissues visco-elasticity[J]. IEEE transactions on medical imaging, 2009, 28(3): 313-322.
[14] Chen S, Urban M, Pislaru C, et al. Shearwave dispersion ultrasound vibrometry (SDUV) for measuring tissue elasticity and viscosity[J]. Ultrasonics, Ferroelectrics and Frequency Control, IEEE Transactions on, 2009, 56(1): 55-62.
[15] Valdez-Jasso D, Haider MA, Banks HT, et al. Viscoelastic mapping of the arterial ovine system using a kelvin mode[J]. IEEE Trans Biomed Eng, 2007, 58(1): 1-48.
[16] Olufsen MS, Nadim A. On deriving lumped models for blood flow and pressure in the systemic arteries[J]. Math Biosci Eng, 2004, 1(1): 61-80.
[17] Craiem D, Graf S, Pessana F, et al. Cardiovascular engineering: modelization of ventricular-arterial interaction in systemic and pulmonary circulation[J]. Latin American applied research, 2005, 35(2): 111-114.
[18] Carcione JJM. Wave fields in real media: Wave propagation in anisotropic, anelastic, porous and electromagnetic media[M]. Oxford: Elsevier Science Ltd, 2001: 145-146.
[19] Oestreicher HL. Field and impedance of an oscillating sphere in a viscoelastic medium with an application to biophysics[J]. The Journal of the Acoustical Society of America, 2005, 23(6): 707-714.
[20] Chen K, Yao A, Zheng EE, et al. Shear wave dispersion ultrasound vibrometry based on a different mechanical model for soft tissue characterization[J]. Journal of Ultrasound in Medicine, 2012, 31(12): 2001-2011.
[21] Guo YR, Chen X, Lin H, et al. In-vitro quantification of rat liver viscoelasticity with shear wave dispersion ultrasound vibrometry[A]. In: Engineering in Medicine and Biology Society (EMBC), 2013 35th Annual International Conference of the IEEE[C]. 2013,1915-1918.
[22] Wang MH, Palmeri ML, Guy CD, et al. In-vivo quantification of liver stiffness in a rat model of hepatic fibrosis with Acoustic Radiation Force[J]. Ultrasound in medicine & biology, 2009, 35(10): 1709.
[23] Yin M, Woollard J, Wang X, et al. Quantitative assessment of hepatic fibrosis in an animal model with magnetic resonance elastography[J]. Magnetic Resonance in Medicine, 2007, 58(2): 346-353.
[24] Chen S, Sanchez W, Callstrom MR, et al. Assessment of liver viscoelasticity by using shear waves induced by ultrasound radiation force[J]. Radiology, 2013, 266(3): 964-970.
[25] Ziol M, Handra‐Luca A, Kettaneh A, et al. Noninvasive assessment of liver fibrosis by measurement of stiffness in patients with chronic hepatitis C[J]. Hepatology, 2005, 41(1): 48-54.
[26] Castéra L, Vergniol J, Foucher J, et al. Prospective comparison of transient elastography, Fibrotest, APRI, and liver biopsy for the assessment of fibrosis in chronic hepatitis C[J]. Gastroenterology, 2005, 128(2): 343-350.
[27] Friedrich-Rust M, Wunder K, Kriener S, et al. Liver fibrosis in viral hepatitis: noninvasive assessment with acoustic radiation force impulse imaging versus ttransient elastography1[J]. Radiology, 2009, 252(2): 595-604.
[28] Takahashi H, Ono N, Eguchi Y, et al. Evaluation of acoustic radiation force impulse elastography for fibrosis staging of chronic liver disease: a pilot study[J]. Liver International, 2010, 30(4): 538-545.
[29] Bavu É, Gennisson JL, Couade M, et al. Noninvasive In Vivo Liver Fibrosis Evaluation Using Supersonic Shear Imaging: A Clinical Study on 113 Hepatitis C Virus Patients[J]. Ultrasound in medicine & biology, 2011, 37(9): 1361-1373.
[30] Asbach P, Klatt D, Hamhaber U, et al. Assessment of liver viscoelasticity using multifrequency MR elastography[J]. Magnetic resonance in Medicine, 2008, 60(2): 373-379.
[31] Asbach P, Klatt D, Schlosser B, et al. Viscoelasticity-based staging of hepatic fibrosis with multifrequency MR elastography1[J]. Radiology, 2010, 257(1): 80-86.
[32] Muller M, Gennisson JL, Deffieux T, et al. Quantitative viscoelasticity mapping of human liver using supersonic shear imaging: preliminary in vivo feasability study[J]. Ultrasound in medicine & biology, 2009, 35(2): 219-229.
[33] Bavu É, Gennisson JL, Couade M, et al. Noninvasive in vivo liver fibrosis evaluation using supersonic shear imaging: A clinical study on 113 hepatitis C virus patients[J]. Ultrasound in medicine & biology, 2011, 37(9): 1361-1373.
QuantitativeMeasurementofViscoelasticityofHepaticFibrosisinaRatModelUsingShearWaveDispersionUltrasoundVibrometry
Guo Yanrong1,Chen Xin1,Lin Haoming1,Zheng Yi2, Zhang Xinyu1,Wang Tianfu1,Chen Siping1,Shen Yuanyuan1
1.National-Regional Key Technology Engineering Laboratory for Medical Ultrasound, Guangdong Key Laboratory for Biomedical Measurements and Ultrasound Imaging, Department of Biomedical Engineering. School of Medicine, Shenzhen University(Shenzhen, 518060)2. Department of Electrical and Computer Engineering. St. Cloud State University St. Cloud (MN, 56301, USA)
Shear wave dispersion ultrasound vibrometry (SDUV) enables quantitative measurement and noninvasive assessment of liver mechanical properties, such as viscoelasticity which is related to hepatic fibrosis. The present study simultaneously investigated viscous and elastic coefficient of liver fibrosis at different stages in a rat model using SDUV based on Zener model. The results showed that shear wave velocity was dispersive with frequency, and the viscocity of liver tissue has influence on shear wave. The mean values of the liver elasticity and the viscosity ranged from 0.76 to 2.93 kPa and from 1.09 to 2.01 Paos for F0-F4 fibrosis stages, respectively. The elasticity increases with the grade of liver fibrosis. The area under receiver operating characteristic (AUROC)values were 0.92 (≥F2), 0.98 (≥F3), and 0.99 (F4) for elasticity and 0.85 (≥F2), 0.71 (≥F3), and 0.73 (F4) for viscosity. The results suggested that elasticity was more sensitive for the assessment of liver fibrosis staging compared to the viscosity.
liver fibrosis, dispersive , shear wave dispersion ultrasound vibrometry, viscoelasticity.
10.3969/j.issn.1674-1242.2014.02.006
国家自然科学基金(No. 61031003, 81271651, 1271651),深圳市战略性新兴产业发展专项资金协同创新项目(No. GJHS20120621153609166)
郭燕荣,研究生,研究方向:生物医学工程。
沈圆圆,讲师,硕士生导师,电话:0755-86671921, E-mail:shenyy@szu.edu.cn。
445.1 【
】A
1674-1242(2014)02-0071-07
2014-05-14)

