3-(4-硝基苯基)氨基-1H-吲哚-4(5H)-酮的简便合成及结构表征
佟光进, 屠蔓苏, 姜 波
(1.江苏省徐州医药高等职业学校,江苏 徐州 221116; 2.江苏师范大学 化学化工学院,江苏 徐州 221116)
近一个世纪以来,胺类化合物的N-芳构化引起了人们的广泛关注.迄今为止,比较受欢迎的方法有铜催化的Ullmann/Goldberg型N-芳构化[1]和钯催化的Buchwald-Hartwig型耦合法[2].但由于过渡金属参与了N-芳构化的过程,造成环境污染,这就迫切需要设计出绿色和可持续的N-芳构化的方法.因此,开发一个不使用金属催化剂的高效和广泛适用的分子间的N-芳构化值得探索.
稠合吡咯环广泛存在于自然界中,是许多生物活性分子和药物物质的基本骨架.在许多天然产物全合成中,稠合吡咯化合物被广泛用作构建模块,显示出强大的抗菌、抗病毒、抗炎、抗癌和抗氧化活性[3-4]等.在过去的几十年中,有许多方法合成了稠合吡咯环,大多数涉及炔醇[5]、炔基酮[6]的重排环化,环酮成环反应[7],金属催化下的炔烃串联环化[8]以及müchnone衍生物的1,3-偶极环加反应[9].如何发展可替代的、较经济的方法构建此类杂环,以减少废物和副产品的生成,这对于有机化学工作者具有极大的挑战性.
本文报道一个新的N-芳构化的多米诺反应,以对甲氧基乙二醛一水合物(1)、3-苯氨基-5,5-二甲基-2-环己烯-1-酮(2)和4-硝基苯胺(3)为原料,对甲苯磺酸为催化剂,在乙醇溶剂中,微波辐射下较高产率地合成标题化合物3-(4-硝基苯基)氨基-1H-吲哚-4(5H)-酮(4).值得关注的是,此多米诺反应一步构建3位芳氨基取代的稠合吡咯骨架,通过分子间作用直接、轻松地实现了N-芳构化.反应方程式如下:
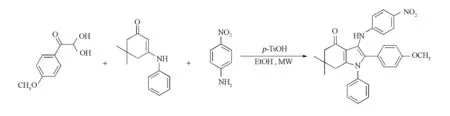
1234
1 实验部分
1.1 仪器和试剂
所用仪器除常规仪器外,还有北京科仪电光仪器厂生产的XT-5型显微熔点仪(温度计未校正),FTIR-Tensor-27型红外光谱仪(KBr压片),Bruker DPX-400型超导核磁共振仪,Bruker OTOF-QII型高分辨率质谱仪,Siemens P4型四圆衍射仪(德国,西门子公司).所用试剂均为分析纯.
1.2 实验方法
1.2.1 4的合成
先将1(1.0 mmol)加入10.0 ml反应器中,然后依次加入2(1.0 mmol)、3(1.0 mmol)以及对甲苯磺酸(1.0 mmol)、1.5 ml乙醇.封闭反应器,预搅拌10 s.在80 ℃的微波辐射下反应15 min,TLC跟踪直到无反应物1,反应完成.将混合物取出,冷却至室温,再用20 ml冷水稀释出现固体,静置后抽滤,粗产品用95%乙醇重结晶得到黄色目标化合物4,产率为90%,熔点209.0~209.3 ℃.
产物4的结构经红外、核磁和质谱证实,单晶X射线衍射分析进一步确认了其结构.1HNMR(400 MHz,CDCl3)δ:7.87(d,J=8.8 Hz,2H,ArH),7.40(s,3H,ArH),7.12~7.13(m,3H,ArH,2H and NH,1H),6.89(d,J=8.0 Hz,2H,ArH),6.55~6.63(m,4H,ArH),3.68(s,3H,CH3),2.53(s,2H,CH2),2.39(s,2H,CH2),1.11(s,6H,CH3).13CNMR(100 MHz,CDCl3)δ:194.7,158.7,150.6,141.9,139.1,137.1,130.4,129.4,128.5,128.0,126.2,125.4,122.6,120.8,113.9,113.7,113.3,55.1,52.3,36.9,35.6,28.6.IRν:3 313,2 959,1 661,1 597,1 557,1 502,1 451,1 369,1 325,1 251,1 180,1 113,1 025,836,752 cm-1.HRMSm/z:C29H27N3O4,计算值,481.200 2;实测值,481.200 9.
1.2.2 晶体结构分析

2 结果与讨论
在对甲苯磺酸的催化下,目标化合物由三组分一步反应得到,同时实现了N-芳构化.该反应具有反应条件温和、反应时间短(15 min),且产率及产品纯度较高,后处理方便等优点,为合成吡咯类化合物提供了一种简单易操作、高效的方法.根据产物的结构,推测反应的可能机理:首先由1与烯胺酮2经历亲核取代生成A,亲电加H+产生B.随后,B与3进行亲核加成形成C,接着发生分子内H转移形成D,最终脱水得目标产物4.合成路线见图1.
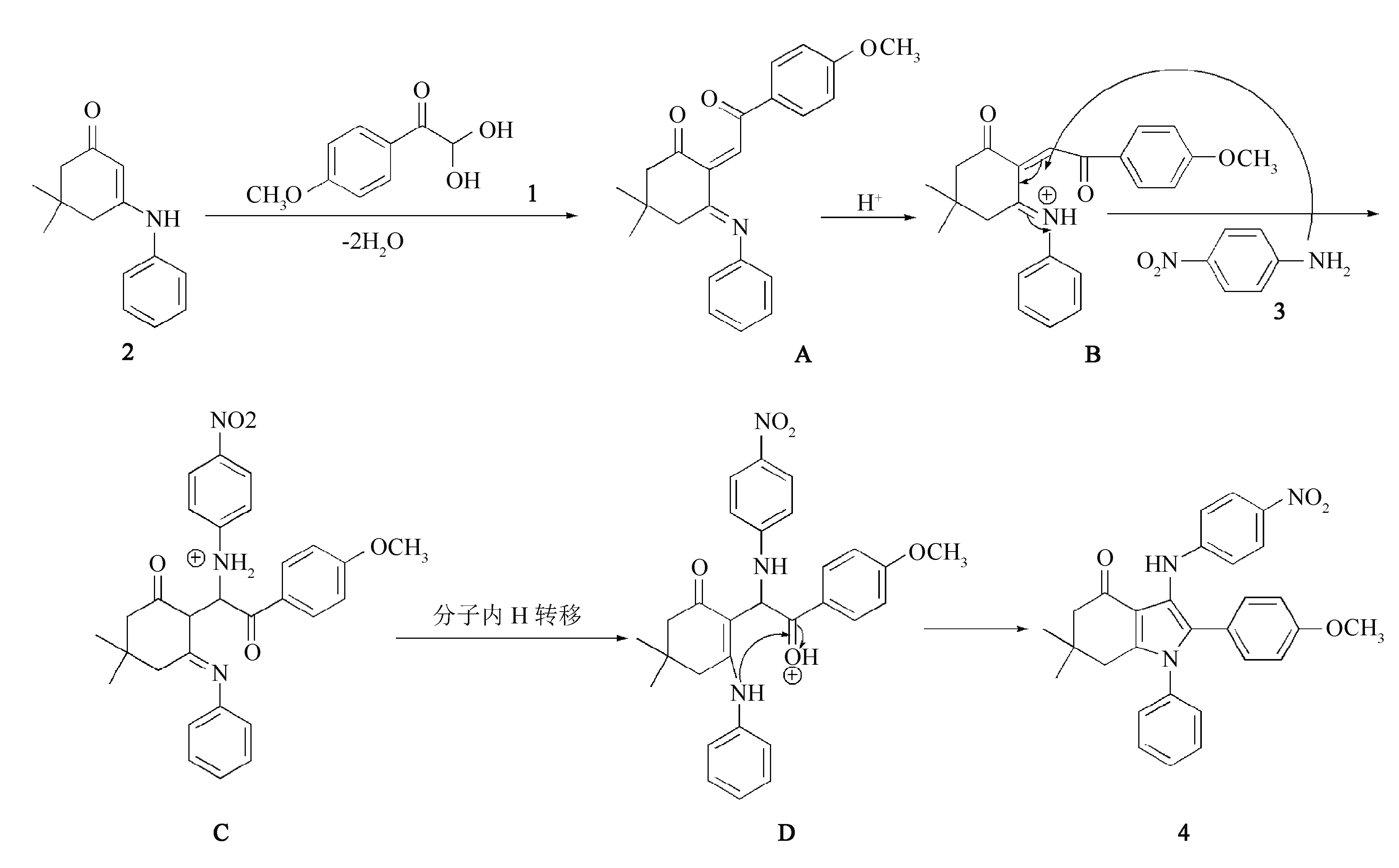
图1 目标化合物合成机理图
在核磁共振谱中氢原子数目与其结构相吻合,其中受芳构化的吲哚环和苯环的共同影响,N2上氢的吸收峰在δ为7.12~7.13范围内;δ为3.68的单峰,3个氢,为—OCH3上的氢的吸收峰;δ为2.53的单峰,2个氢,为离羰基较近的C5上的氢的吸收峰;δ为2.39的单峰,2个氢,为C7上的氢的吸收峰;δ为1.11的单峰,6个氢,为环己烯酮C6上的两个等同的—CH3上的氢的吸收峰,其余数据为芳氢吸收峰,所有芳氢原子个数与其结构相吻合.在红外光谱中,较为明显的3 310 cm-1处为氨基氢的吸收峰;1 661 cm-1处出现羰基的吸收峰;1 557,1 502 cm-1处为苯环硝基吸收峰;1 369,1 325 cm-1处为偕二甲基氢吸收峰.同时,碳谱和高分辨率质谱值也与其结构相吻合.
X射线单晶衍射分析结果见表1~3.表1为标题化合物的原子坐标及热参数,表2为主要键角值,表3为主要键长值,图2为分子结构透视图.

表2 标题化合物的主要键角值

表3 标题化合物的主要键长

表4 最小二乘平面方程和原子与平面的偏差

图2 分子结构透视图
X衍射分析表明在分子中存在5个平面:Ⅰ(N1,C1,C2,C3,C8),Ⅱ(C7,C8,C3,C4,C5,C6),Ⅲ(C9,C10,C11,C12,C13,C14),Ⅳ(C15,C16,C17,C18,C19,C20),Ⅴ(C21,C22,C23,C24,C25,C26),其平面方程和原子距离列于表4,可以看出,新形成的吡咯环为芳构化的共平面结构.分子中与吡咯杂环稠合的六元环(平面)(Ⅱ)采用半椅式构象,因为C5和C6偏离平面距离分别为-0.209 1 pm和0.458 0 pm.
参考文献:
[1] Goldberg I.Ueber phenylirungen bei gegenwart von kupfer als katalysator[J].Ber dtsch chem Ges,1906,39(2):1691.
[2] Muci A R,Buchwald S L.Practical palladium catalysts for C—N and C—O bond formation[J].Top Curr Chem,2002,219:131.
[3] Jacobi P A,Coults L D,Guo J S,et al.Synthesis of biologically important tetrapyrroles:the “B,C+D+A” approach to linear tetrapyrroles[J].J Org Chem,2000,65(1):205.
[4] Balme G.Pyrrole syntheses by multicomponent coupling reactions[J].Angew Chem Int Ed,2004,43(46):6238.
[5] Zhao Xiong,Zhang En,Tu Yongqiang,et al.Au(Ⅰ)-catalyzed rearrangement reaction of propargylic aziridine:synthesis of trisubstituted and cycloalkene-fused pyrroles[J].Org Lett,2009,11(17):4002.
[6] Schwier T,Sromek A W,Yap D M L,et al.Mechanistically diverse copper-,silver-,and gold-catalyzed acyloxy and phosphatyloxy migrations:efficient synthesis of heterocycles via cascade migration/cycloisomerization approach[J].J Amer Chem Soc,2007,129(32):9868.
[7] Hirano K,Inaba Y,Takahashi N,et al.Direct synthesis of fused indoles by gold-catalyzed cascade cyclization of diynes[J].J Org Chem,2011,76(5):1212.
[8] Nagafuji P,Cushman M.A general synthesis of pyrroles and fused pyrrole systems from ketones and amino acids[J].J Org Chem,1996,61(15):4999.
[9] Hershenson F M.Synthesis of ring-fused pyrroles.Ⅰ.1,3-dipolar cycloaddition reactions of munchnone derivatives obtained from tetrahydro-.beta .-carboline-3- and -1-carboxylic acids[J].J Org Chem,1972,37(20):3111.

