IL- 6对小鼠肾上腺皮质细胞系Y1合成皮质醇的影响
文小平,夏海鸣
(1.东南大学 医学院,江苏 南京 210009; 2.东南大学 附属第二医院,江苏 南京 210003)
目前认为,白介素6(interleukin- 6,IL- 6)与肾上腺皮质功能密切相关,它可以通过下丘脑- 垂体- 肾上腺(Hypothalamic- Pituitary- Adrenal,HPA)轴调节肾上腺皮质功能,也可直接作用于肾上腺来影响肾上腺皮质功能。此外,肾上腺自身可分泌IL- 6,通过自分泌或旁分泌方式参与肾上腺皮质功能的调节。但IL- 6对肾上腺皮质功能的具体影响及调节机制仍不明确。本研究旨在探讨IL- 6单独及联合ACTH处理小鼠肾上腺皮质细胞后皮质醇合成水平的变化,以及皮质醇合成过程中类固醇急性调节蛋白(StAR)相关基因的调控作用,从而为今后深入了解内毒素休克过程中IL- 6对肾上腺皮质功能的影响提供实验依据。
1 材料与方法
1.1 材料
小鼠肾上腺皮质细胞系Y1(中科院上海细胞生物研究所),IL- 6(Prospec公司),ACTH(Sigma公司),F12培养基(南京凯基生物科技发展有限公司),胎牛血清(GIBCO公司),台盼蓝染液(南京生兴生物科技有限公司),皮质醇放免检测试剂盒(原子高科股份有限公司),Trizol(美国Invitrogen),cDNA第一链合成试剂盒(美国Thermo Fisher),TaqDNA Polymerase(美国Thermo Fisher),Real time PCR Master Mix(SYBR Green)(日本TOYOBO),0.1% DEPC水(南京凯基生物科技发展有限公司),引物由上海英俊公司合成。
1.2 细胞培养
小鼠肾上腺皮质细胞系Y1细胞用含10%的胎牛血清、1.176 g NaHCO3及100 U·L-1青链霉素的F12培养液,在体积分数为5%CO2、37 ℃湿饱和的条件下培养。细胞生长至80%融合时,以0.25%的混合胰酶消化后按1瓶传至2~3瓶进行传代,取其对数生长期细胞进行实验。
1.3 台盼蓝拒染法检测细胞活性
取对数生长期的Y1细胞,调整细胞浓度为1.0×105ml-1,接种于6孔板,每孔1 ml,F12培养液培养24 h后按照以下分组来添加不同物质:(1) 空白对照组:2 ml F12培养液;(2) IL- 6组:2 ml F12培养液含100 ng·ml-1IL- 6;(3) ACTH组:2 ml F12培养液含10-9mol·l-1ACTH;(4) IL- 6+ACTH组:2 ml F12培养液含100 ng·ml-1IL- 6和10-9mol·l-1ACTH;再按照4个时间点分别培养3、6、12、24 h终止实验。取细胞上清液于无菌EP中,混匀后以2 000 r·min-1离心5 min,吸取上清液,-20 ℃保存。在6孔板中按1∶10加入0.4%的台盼蓝,染色2~3 min,在光学显微镜下做活细胞计数,实验重复3次。结果统计:光镜下任取5个视野进行活细胞计数,细胞活性=活细胞数目/总细胞数目×100%。
1.4 放免法检测皮质醇
从冰箱中取出经1.3方法处理的上清液,室温溶解后通过放免法测定各组细胞上清中皮质醇含量。根据皮质醇放免检测试剂盒的操作说明,用放免仪测各管沉淀的放射性计数(cmp),实验重复3次。自动γ计数器预先编制程序,直接给出实验的有关参数,标准曲线及样品浓度。测得的数据中,皮质醇以g·ml-1为单位。
1.5 实时荧光定量PCR法检测StAR mRNA的表达
取对数生长期的Y1细胞,调整细胞浓度为1.0×105ml-1,接种于6孔板,每孔1 ml。以F12培养液培养24 h 后按照以下分组来添加不同物质:(1) 空白对照组:2 ml F12培养液;(2) IL- 6组:2 ml F12培养液含100 ng·ml-1IL- 6;(3) ACTH组:2 ml F12培养液含10-9mol·l-1ACTH;(4) IL- 6+ACTH组:2 ml F12培养液含100 ng·ml-1IL- 6和10-9mol·l-1ACTH;24 h终止实验。用Trizol裂解细胞提取各组总RNA,纯化后用DEPC水溶解RNA,并分别在260 nm和280 nm处测其吸光度,计算出OD260/280值。引物是根据GenBank收录的小鼠StAR和GAPDHmRNA序列,由Primer 5软件设计,由上海英俊公司合成,序列见表1。按cDNA第一链合成试剂盒说明书进行操作,得到cDNA。用ABI Step one plus Real time- PCR仪进行扩增反应,体系总体积为20 μl:SYBR Green为10 μl,cDNA为 1 μl,引物为2 μl,0.1% DEPC水为7 μl。扩增条件:95 ℃预变性5 min,95 ℃变性15 s,60 ℃退火20 s,40个循环,72 ℃延伸40 s。每个样品3个复孔,于72 ℃、40 s时计算荧光值,实验重复3次。用2-ΔΔCT法进行数据分析。
表1用于实时荧光定量PCR的引物序列
Tab1SequencesoftheprimersusedforrealtimeRT-PCR
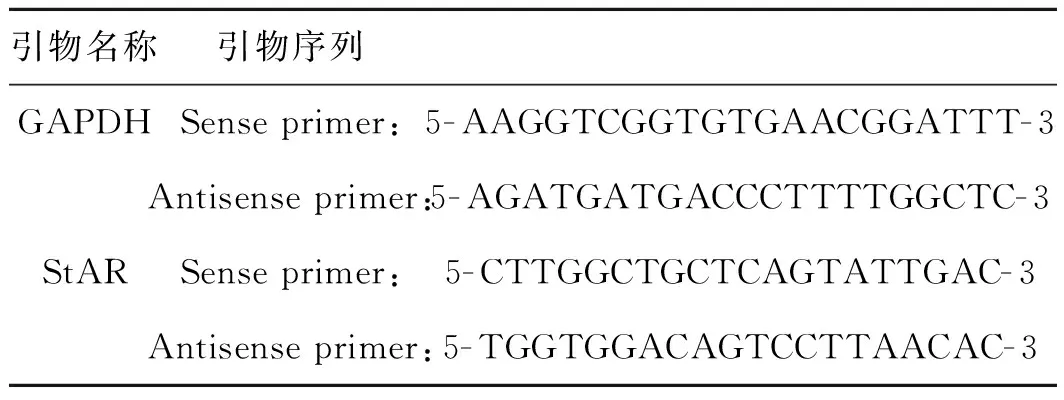
引物名称引物序列GAPDHSense primer:5-AAGGTCGGTGTGAACGGATTT-3Antisense primer:5-AGATGATGACCCTTTTGGCTC-3StARSense primer:5-CTTGGCTGCTCAGTATTGAC-3Antisense primer:5-TGGTGGACAGTCCTTAACAC-3
1.6 统计学处理
2 结 果
2.1 台盼蓝拒染法检测细胞活性
见表2。

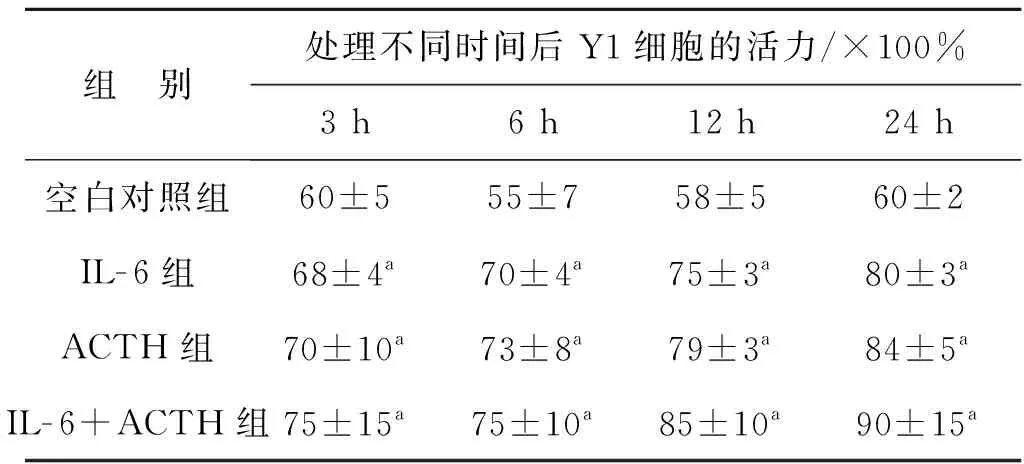
组 别处理不同时间后Y1细胞的活力/×100%3 h6 h12 h24 h空白对照组60±555±758±560±2IL-6组68±4a70±4a75±3a80±3aACTH组70±10a73±8a79±3a84±5aIL-6+ACTH组75±15a75±10a85±10a90±15a
与空白对照组比较,aP>0.05
实验结果显示:IL- 6单独或联合ACTH处理Y1细胞不同时间后,各组的细胞活力与空白对照组比较,差异无统计学意义(P>0.05)。随着时间增加,各组细胞活力虽有明显增强,但差异无统计学意义(P>0.05)。
2.2 IL- 6单独或联合ACTH处理Y1细胞后皮质醇的合成量
见图1。

与空白对照组比较,aP<0.05
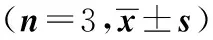
Fig1ThesynthesisofcorticosteroidinY1cellstreatedbyⅠL- 6aloneorcombinedwithACTH
实验结果显示:随着IL- 6处理Y1细胞的时间增加,皮质醇合成量也增加,与空白对照组比较,差异有统计学意义(6 h后,P<0.05);ACTH处理Y1细胞不同时间段,随时间增加,皮质醇合成显著增加,与空白对照组相比,差异有统计学意义(3 h后,P<0.05);IL- 6和ACTH联合作用Y1细胞,随时间增加,皮质醇合成量进一步上升,与空白对照组相比,差异有统计学意义(3 h后,P<0.05)。
2.3 IL- 6单独或联合ACTH处理Y1细胞后StAR mRNA的表达
见表3。
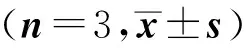

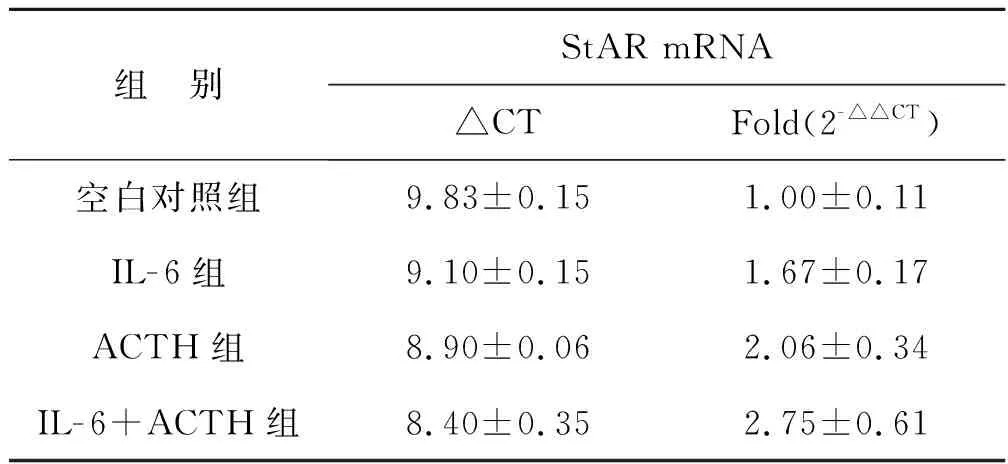
组 别StAR mRNA△CTFold(2-△△CT)空白对照组9.83±0.151.00±0.11IL-6组9.10±0.151.67±0.17ACTH组8.90±0.062.06±0.34IL-6+ACTH组8.40±0.352.75±0.61
实验结果显示:IL- 6、ACTH分别作用于Y1细胞24 h后,StAR mRNA的表达增强,与空白对照组对比有统计学意义(P<0.05);IL- 6和ACTH联合处理Y1细胞24 h后,StAR mRNA的表达进一步增强,与空白对照组对比有统计学意义(P<0.05)。
3 讨 论
2000年,Annane等首次提出相对肾上腺皮质功能不全(relative adrenal cortical dysfunction,RAI)的概念:即处于严重应激状态时,患者体内的皮质醇水平代偿性升高,但升高程度或者持续时间仍不能满足机体需要,即为RAI[1]。Dalegrave等研究发现,内毒素休克患者并发RAI的概率达22%~55%[2]。内毒素休克时RAI发生机制尚不完全清楚,但内毒素休克时大量释放的炎性因子与肾上腺皮质功能密切相关。IL- 6是参与内毒素休克的重要炎症因子之一,对肾上腺皮质功能的影响值得进一步探讨。
近年来研究发现,细胞因子与肾上腺皮质激素的合成密切相关:肿瘤坏死因子- α可抑制牛肾上腺皮质细胞合成皮质醇[3],白介素4可促进牛肾上腺皮质细胞合成皮质醇[4]。体外实验结果表明,采用不同浓度(10~200 ng·ml-1)的IL- 6处理从肾口腺皮质细胞不同时间(4~24 h)后皮质醇合成量开始增加[5]。
本研究前实验分别用1、10、100 pg·ml-1和1、10、100、200、400 ng·ml-1的IL- 6同时处理Y1细胞,12 h后发现,当IL- 6浓度达1 ng·ml-1后细胞合成皮质醇量增加,100 ng·ml-1皮质醇合成量增加达峰值,超过100 ng·ml-1皮质醇合成量开始下降;用100 ng·ml-1IL- 6分别处理Y1细胞3、6、12、24、48 h,发现作用6 h后Y1细胞合成皮质醇量增加,24 h达到峰值,超过24 h后皮质醇合成量开始下降;用100 ng·ml-1IL- 6联合10-9mol·l-1ACTH处理细胞3 h后皮质醇合成量明显增加。这些浓度、时间差异性的产生可能与细胞种属、细胞活性及培养环境相关,也可能与实验试剂的质量相关。
有研究结果显示,IL- 6(4.8×10-9mol·L-1)处理肾上腺皮质细胞48 h后细胞数量及细胞活力均无变化[6]。本研究用100 ng·ml-1IL- 6单独以及联合10-9mol·l-1ACTH共同处理Y1细胞不同时间后发现,细胞活性与对照组相比差异无统计学意义。因此,后续实验中使用100 ng·ml-1的IL- 6及10-9mol·L-1的ACTH,排除IL- 6和(或)ACTH对Y1细胞活性的影响。
综上所述,IL- 6可促进Y1细胞合成皮质醇,但其具体机制仍不明确。2004年,Rainey等[7]研究发现了肾上腺皮质细胞的皮质醇合成通路,即在肾上腺皮质以胆固醇为基本“原料”,通过StAR介导,进入线粒体内膜后经过一系列特异性酶催化作用,包括多种形式的细胞色素P450系列酶和3β羟基固醇脱氢酶(3 beta hydroxy cholesterol dehydrogenase,3β- HSD),最终合成皮质醇。Y1细胞系是一种研究肾上腺类固醇合成与代谢途径中多种基因表达和调控的较好细胞模型,其功能与原代肾上腺皮质细胞相似,受ACTH刺激后,细胞合成类固醇能力可显著增加。本研究采用10-9mol·L-1的ACTH刺激Y1细胞后,皮质醇合成量明显增加,间接证明了Y1细胞活性良好。
细胞因子的生物学功能是通过与靶细胞膜表面的受体相结合并将信号传递到细胞内部,进而发挥功能。Kontogeogos等应用免疫组化和免疫定位方法在人肾上腺皮质的束状带、网状带以及球状带区域检测到高水平IL- 6和IL- 6受体的表达[8]。IL- 6可能通过与Y1细胞表面IL- 6受体结合成IL- 6/IL- 6R/gp130六聚体蛋白复合物,激活细胞内的JAK/STAT途径和Ras/MAPK信号转导途径,影响细胞合成皮质醇[9]。但有研究[6]结果显示,IL- 6是通过花生四烯酸代谢途径调节肾上腺皮质细胞的类固醇激素分泌功能。
本研究结果提示,IL- 6联合ACTH可明显促进Y1细胞合成皮质醇,分析其原因可能是:(1) ACTH可促进离体的牛肾上腺皮质细胞分泌IL- 6[10]。本研究中ACTH联合IL- 6处理Y1细胞时可能促进Y1细胞分泌IL- 6或表达IL- 6R。(2) ACTH通过与肾上腺细胞表面受体结合后,在Ca2+调节下激活腺苷酸环化酶(adenylate cyclase,AC)产生第二信使环磷酸腺苷(Cyclic Adenosine Monophosphate,cAMP),进一步激活蛋白激酶(Protein Kinase,PKA)信号转导途径,影响肾上腺细胞分泌类固醇激素[11]。曾有学者推测,ACTH与IL- 6之间可能存在关于cAMP的信号串扰,共同促进肾上腺皮质细胞合成皮质醇。有研究[6]发现,IL- 6通过花生四烯酸环氧酶途径促进ACTH刺激状态下的肾上腺皮质细胞合成皮质醇,而非ACTH依赖的cAMP途径。
细胞因子与其受体结合后启动复杂的细胞内分子间的相互作用,最终引起细胞内基因转录的变化。Koldzic- Zivanovic等通过对Y1细胞中StAR以及上游的胆固醇侧链裂解酶P450scc(cholesterol side- chain cleavage enzyme P450scc,CYP11A1)和3β- HSD的检测发现,IL- 10通过与ACTH共同作用来抑制上述蛋白的合成[12]。本研究亦发现,IL- 6单独或联合ACTH处理Y1细胞后,StAR mRNA的表达水平上升,提示IL- 6可单独或联合ACTH通过促进StAR mRNA表达增强Y1细胞合成皮质醇的能力。目前,有关IL- 6对StAR mRNA表达的影响机制尚不明确。影响StAR mRNA表达的因素主要有cAMP- PKA信号通路、蛋白激酶C、花生四烯酸(arachidonic acid,AA)、类固醇合成因子- 1、X染色体基因- 1、妊娠特异性β- 1糖蛋白、类固醇诱导蛋白等[13]。在类固醇合成细胞中,AA从细胞器释放是类固醇合成所必需的。许多研究结果显示,AA与IL- 6关系密切,如AA可进一步诱导缺氧状态下的小鼠胚胎干细胞分泌IL- 6[14];IL- 6促进体外血小板活化的机制包括AA诱导途径[15]等。有报道,IL- 6通过AA代谢途径调节肾上腺细胞分泌皮质醇激素。研究显示IL- 6通过抑制磷脂酶A2的活性,使AA代谢受阻,进一步使StAR蛋白表达受到抑制而影响类固醇激素的合成[16],并且StAR蛋白表达受阻出现在转录水平[17],有可能是通过降低转录活性或mRNA的稳定性实现的。因此,推测IL- 6对StAR mRNA表达的影响可能通过花生四烯酸脂氧酶代谢途径进行。探讨IL- 6与ACTH共同影响StAR表达机制的文献比较少,是否通过促进cAMP诱导作用或花生四烯酸代谢途径以及其他可能的调节途径,这需要进一步研究。
近些年来,肾上腺皮质功能的损害在内毒素休克发生发展中的作用已逐渐成为研究热点。肾上腺皮质功能状态对内毒素休克的治疗和预后评估非常重要,而IL- 6是内毒素休克发生过程中重要的细胞因子。本研究结果表明,IL- 6与肾上腺皮质细胞功能密切相关。因此,深入探讨IL- 6对肾上腺皮质功能的影响及其机制将为临床治疗提供实验基础和理论依据。
[1] ANNANE D,SEBILLE V,TROCHE G,et al.A 3- level prognostic classification in sepsis shock based on cortisol level and cortisol response to corticotropin[J].JAMA,2000,283(8):1038- 1045.
[2] DALEGRAVE D,SILVA R L,BECKER M,et al.Relative adrenal insufficiency as a predictor of disease severity and mortality in severe septic shock[J].Rev Bras Ter Intensiva,2012,24(4):362- 368.
[3] BARNEY M,CALL G B,MCLLMOIL C J,et al.Stimulation by interleukin- 6 and inhibition by tumor necrosis factor of cortisol release from bovine adrenal zona fasciculata cells through their receptors[J].Endocrine,2000,13(3):369- 377.
[4] WOODS A M.JUDD A M.Interleukin- 4 increases cortisol release and decreases adrenal androgen release from bovine adrenal cells[J].Domest Anim Endocrinol,2008,34(4):372- 382.
[5] WILLENBERG H S,PATH G,VOGELI T A,et al.Role of interleukin- 6 in stress response in normal and tumorous adrenal cells and during chronic inflammation[J].Ann N Y Acad Sci,2002,966:304- 314.
[6] MICHL P,BEIKLER T,ENGELHARDT D,et al.Interleukin- 3 and interleukin- 6 stimulate bovine adrenal cortisol secretion through different pathways[J].J Neuroendocrinol,2000,12(1):23- 28.
[7] RAINEY W E,SANER K,SCHIMMER B P.Adrenocortical cell lines[J].Mol Cell Endocrinology,2004,228(1- 2):23- 38.
[8] KONTOGEORGOS G,MESSINI I,KYRODIMOU E,et al.Immunohistochemical localization of interleukin- 6 in peripheral human endocrine glands[J].Endocrine,2002,17(2): 135- 140.
[9] GREENHILL C J,ROSE- JOHN S,LISSILAA R,et al.IL- 6 trans- signaling modulates TLR4- dependent inflammatory responses via STAT3[J].J Immunol,2011,186(2):1199- 1208.
[10] CALL G B,HUSEIN O F,MCLLMOIL C J,et al.Bovine adrenal cells secrete interleukin- 6 and tumor necrosis factorinvitro[J].Gen Comp Endocrinol,2000,118(2):249- 261.
[11] LIN X,TAKEMORI H,KATOH Y,et al.Salt- inducible kinase is involved in the ACTH/cAMP- dependent protein kinase signaling in Y1 mouse adrenocortical tumor cells[J].Mol Endocrinol,2001,15(8):1264- 1276.
[12] KOLDZIC- ZIVANOVIC N,TU H,JUELICH T L,et al.Regulation of adrenal glucocorticoid synthesis by interleukin- 10:A preponderance of IL- 10 receptor in the adrenal zona fasciculata[J].Brain Behav Immun,2006,20(5):460- 468.
[13] JEFCOATE C R,LEE J,CHERRADI N,et al.cAMP stimulation of StAR expression and cholesterol metabolism is modulated by co- expression of labile suppressors of transcription and mRNA turnover[J].Mol Cell Endocrinol,2011,336(1- 2):53- 62.
[14] LEE S H,LEE Y J,HAN H J.Effect of arachidonic acid on hypoxia- induced IL- 6 production in mouse ES cells:Involvement of MAPKs,NF- κB,and HIF- 1α[J].J Cell Physiol,2010,222(3):574- 585.
[15] GREMMEL T,PERKMANN T,SEIDINGER D,et al.Differential impact of inflammation on six laboratory assays measuring residual arachidonic acid- inducible platelet reactivity during dual antiplatelet therapy[J].J Atheroscler Thromb,2013,20(7):630- 645.
[16] SHEN W J,PATEL S,NATU V,et al.Interaction of hormone- sensitive lipase with steroidogenic acute regulatory protein:facilitation of cholesterol transfer in adrenal[J].J Biol Chem,2003,278(44):43870- 43876.
[17] LIU M Y,LEU S F,YANG H Y,et al.Inhibitory mechanisms of lead on steroidogenesis in MA- 10 mouse Leydig tumor cells[J].Arch Androl,2003,49(1):29- 38.

