氢饱和盐水对阿尔茨海默病模型大鼠氧化应激损伤的影响
李 健 刘春娜 刘新宇 李熙东 刘媛媛
(辽宁医学院附属第一医院神经内科,辽宁 锦州 121001)
活性氧自由基(ROS)可以直接或间接氧化或损伤DNA、蛋白质和脂质,可诱发基因的突变、蛋白质变性和脂质过氧化,被认为是人体衰老和各种重要疾病如肿瘤、心脑血管疾病、神经退行性疾病(老年痴呆)、糖尿病最主要的危险因子。在阿尔茨海默病(AD)病人的尸检中发现,脑组织的脂质发生严重过氧化,自由基生成增加,细胞核和线粒体的DNA均损伤,其中线粒体的DNA损伤最严重。2007年日本学者首先报道,氢溶解在液体中可以选择性中和氧化损伤的重要介质羟自由基和亚硝酸阴离子〔1〕,动物呼吸2%的氢可以显著改善脑缺血再灌注损伤,目前已报道了氢气对多种疾病的治疗作用,主要集中在器官缺血再灌注损伤〔2,3〕、器官移植损伤〔4,5〕、炎症及变态反应疾病〔6,7〕、代谢综合征〔8〕、减轻放疗、化疗的毒性作用〔9〕、部分神经系统变性疾病等〔10〕,但对AD学习记忆功能的影响尚未见报道。本实验拟考察氢饱和盐水对AD模型大鼠化应激损伤的影响。
1 材料与方法
1.1主要试剂 丙二醛(MDA),南京建成;4-羟基壬烯醛(HNE),Alpha,USA;纤维酸性蛋白(GFAP),Biotime,China;肿瘤坏死因子(TNF)、白介素(IL)-6、IL-1β,R&D,USA;8-羟基脱氧鸟苷酸(8-OH-dG),Groundwork,USA。
1.2主要仪器 分光光度计、酶标仪、切片机、普通光学显微镜、照相系统、超低温冰箱,微量冷冻离心机,高速冷冻离心机,精密分析天平、震荡水浴等。
1.3MDA测定 断头处死大鼠,冰盘上快速取脑,将右侧脑组织(去除嗅球和小脑,取大脑中前段)用冰生理盐水冲洗滤纸吸湿后,称取皮层脑组织湿重0.3 g,加入预冷的生理盐水,用匀浆器制成10%(皮质重量mg/生理盐水体积μl)的组织匀浆,4℃ 3 500 r/min,离心10 min,提取上清液,-20℃冻存待检。MDA含量测定采用硫代巴比妥酸(TBA)比色分析法,应用752型分光光度计测定。
1.4免疫组化测定4-羟基壬烯醛(HNE)、8-羟基脱氧鸟苷(8-OH-d G)的表达 将脑组织按固定、脱水、石蜡步骤处理后,进行连续切片,片厚 5 μm,每个脑组织切片 3 张,石蜡切片常规二甲苯脱蜡梯度酒精水化,磷酸盐缓冲液(PBS)洗3次×3 min。用封闭通透液浸润切片30 min,PBS洗3次×3 min。切片放入0.01 mol/L柠檬酸钠缓冲溶液(pH6.0)后,在微波炉里高火4 min至沸腾后,再加热约6 min×4次。PBS溶液洗3次×3 min;将切片取出,周围水分用滤纸吸干,用组化笔在组织周围画上圈,在圆圈内组织滴入5%羊血清后放入湿盒中,室温30 min。甩去切片上的羊血清,用滤纸擦干组织周围残留血清,直接加入已稀释的一抗(1∶250、500、1 000)后,放入湿盒中室温1 h,然后4℃过夜,从冰箱中取出需37℃复温45 min。将一抗倒掉并用PBS洗5 min×5次;用滤纸将圆圈周围的水吸去,加入已稀释的二抗后放入37 ℃恒温烤箱中30 min(回收),用PBS洗5次×5 min。用二氨基联苯胺(DAB)显色检测,苏木素复染,中性树胶封固。按免疫组织化学程序检测HNE、8-OH-d G的表达;表达阳性的细胞在光镜下细胞质或细胞核呈棕黄色或棕褐色颗粒。图像分析采用Image pro plus图像分析软件,在每个视野相同部位选定相同面积组织区域,计算阳性细胞,每个切片取3个区域计数。观察部位可选择海马、皮层及内嗅区、基底前脑等。
1.5统计学方法 应用SPSS10.0软件进行单因素方差分析、LSD、Student-Newman-Keuls分析。
2 结 果
2.1氢饱和盐水对脑组织MDA含量的影响 模型组大鼠脑组织MDA含量为(6.65±1.07)nmol/mgprotein,与假手术组〔(4.18±0.78)nmol/mg protein〕相比显著升高(P=0.000),而氢饱和盐水治疗组大鼠脑组织的MDA含量〔(5.53±0.74)nmol/mg protein〕较模型组大鼠显著降低(P=0.016)。
2.2氢饱和盐水对脑组织HNE表达的影响 给予氢饱和盐水治疗后14 d,海马齿状回细胞被染成棕黄色,呈现HNE阳性细胞。模型组大鼠海马齿状回显现较多的HNE阳性细胞(11.17±3.43),假手术组大鼠鲜见HNE阳性细胞(0.50±0.84),而氢饱和盐水治疗组大鼠海马齿状回HNE阳性细胞(7.33±1.75)较模型组大鼠显著减少(P=0.011)。见图1。
2.3氢饱和盐水对脑组织8-OH-d G 表达的影响 海马齿状回呈现棕黄色8-OH-d G染色阳性细胞。与假手术组(4.67±1.75)相比,模型组大鼠海马齿状回出现明显增多的8-OH-d G染色阳性细胞(19.17±4.30)(P=0.000),而经氢饱和盐水治疗后的模型大鼠海马齿状回8-OH-d G染色阳性细胞(10.50±2.71)明显减少(P=0.000)。见图2。氢饱和盐水治疗后10 d,顶叶皮层呈现棕黄色8-OH-d G染色阳性细胞。与假手术组(1.83±1.62)相比,模型组大鼠顶叶皮层出现明显增多的8-OH-d G染色阳性细胞(13.33±2.43)(P=0.000),而经氢饱和盐水治疗后的模型大鼠顶叶皮层8-OH-d G染色阳性细胞(5.50±1.76)明显减少(P=0.000)。见图3。
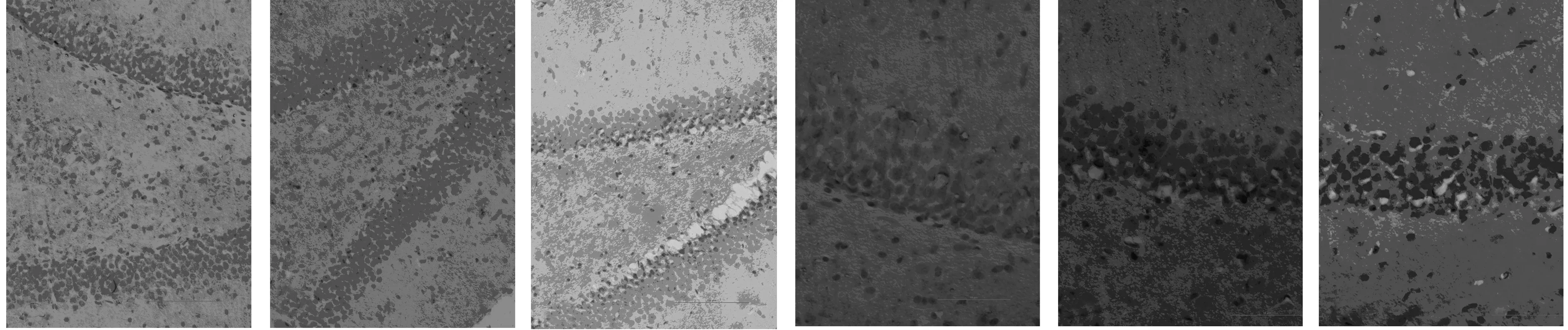
图1 各组大鼠脑组织HNE表达阳性细胞(DAB)
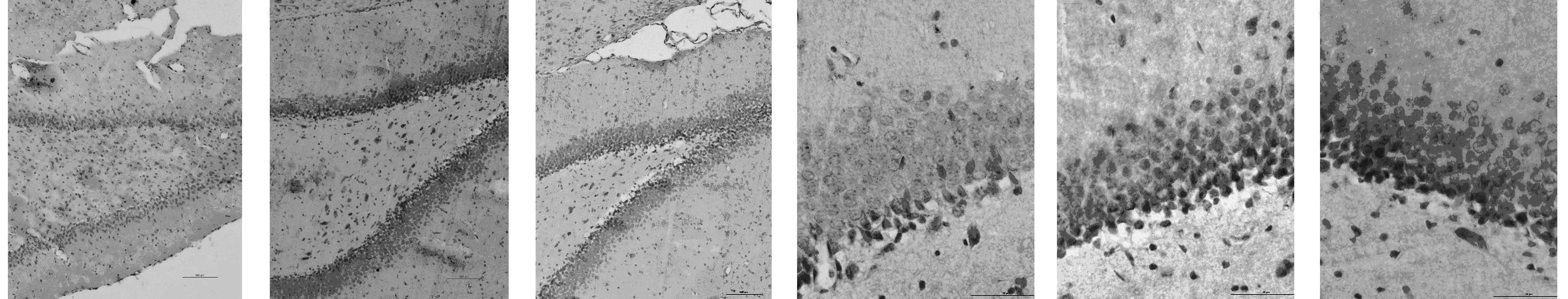
图2 各组大鼠海马龄状回8-OH-d G表达(DAB)
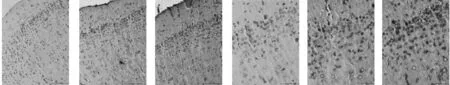
图3 各组大鼠顶叶皮层8-OH-d G表达(DAB)
3 讨 论
目前已明确的AD致病基因蛋白APP、ApoE或PS在调节神经元凋亡或结合转运金属方面均与氧化应激作用有关〔11〕。Aβ是OS与AD脑神经元死亡之间的耦联分子。氧自由基也可促进淀粉样蛋白前体(APP)裂解生成Aβ增加,二者具有相互促进的效应。
老年人在增龄的过程中,脑内自由基的清除能力降低,神经元细胞膜上的不饱和脂肪酸被氧化而产生大量自由基。这些自由基损伤细胞膜、细胞器等细胞内结构,诱导神经元凋亡,导致神经细胞功能严重破坏,从而促使AD的形成。氧自由基能促进Aβ的毒性和聚集,使其在脑内过度活跃,导致神经元退行性变而发生AD;而Aβ也使自由基生成增多。有人用转基因动物对自由基与Aβ的因果关系进行一系列的活体内研究,发现Aβ的沉积能诱导自由基的产生,自由基增多又极大地促进了Aβ的沉积,造成一种神经细胞受损和功能紊乱的恶性循环〔12〕。氧自由基损伤细胞膜结构,生成大量脂质过氧化物,最终产物是MDA,MDA的量可以反映机体内脂质过氧化的程度。本实验的结果显示氢饱和盐水治疗可以明显降低AD模型大鼠脑组织中MDA的水平,提示其清除自由基的能力较强,减少了氧自由基对细胞膜的损伤,从而改善细胞的变性、凋亡或者死亡。HNE是明确的OS标志物,是在AD 造模及相关研究中常用的毒性羰基,它对人工培养的初级神经元、神经瘤细胞、神经胶质细胞等许多细胞功能都有影响。Kim等〔13〕发现在AD 患者脑皮质的某些区域呼吸链复合物的活性降低,HNE 抑制神经突触生成并对Neuro 2A 细胞的微管蛋白网络起迅速的、实质性的破坏作用。在培养大鼠海马神经元的过程中,神经元置于含有2 μmol PL的HNE 的培养基中2 h 便会导致Tau 蛋白的磷酸化程度增高,使Tau 蛋白对去磷酸化具有抵抗作用,这可以被AT8 抗体所识别。AD病人的脑室脑脊液及血清中HNE显著增高也证明其可作为AD的生物标志物〔14〕。加入Aβ1~42培养的神经元HNE含量增高。 HNE 抑制血浆中的膜转运体,破坏微管排列,抑制线粒体功能。
8-OHdG是羟自由基在DNA碱基的C-4、C-5或C-8位置上与脱氧鸟嘌呤核苷酸残基结合并进一步氧化生成的,通过检测血清8-OHdG可以间接反映OS的程度。8-OH-dG是衡量细胞核内基因组DNA氧化损伤程度的重要标志。一些研究〔15,16〕分别观察到正常衰老过程中机体重要组织和AD患者大脑细胞线粒体和细胞核DNA中8-OH-dG含量明显升高。8-OH-dG的含量不仅反映DNA损伤程度,还标志机体代谢和修复能力下降。
本实验观察到氢饱和盐水可以降低Aβ1~42诱导的AD模型大鼠脑组织MDA水平,减弱海马OS损伤标志物HNE、8-OH-d G的免疫反应,提示氢饱和盐水对Aβ1~42诱导的AD模型大鼠脑组织OS损伤具有保护作用。
4 参考文献
1Ohsawa I, Ishikawa M, Takahashi K,etal. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals〔J〕. Nat Med,2007;13(6):688-94.
2Oharazawa H.Administration in retinal ischemia-reperfusion injury〔J〕. Investi Ophthalmol Vis Sci,2010;51(1):487-92.
3Sun Q, Cai JM, Liu SL,etal. Hydrogen-rich saline provides protection against hyperoxic lung injury〔J〕. J Surg Res, 2011;165(1):e43-e49.
4Cardinal JS, Zhan J, Wang Y,etal.Oral hydrogen water prevents chronic allograft nephropathy in rats〔J〕. Kidney Int, 2010;77(2):101-9.
5Qian L, Mei K, Shen J,etal. Administration of hydrogen-rich saline protects mice from lethal acute graft-versus-host disease (aGVHD) 〔J〕. Transplantation, 2013;95(5):658-62.
6Chen H, Sun YP, Li Y,etal. Hydrogen-rich saline ameliorates the severity of L-arginine-induced acute pancreatitis in rats〔J〕. Biochem Biophys Res Commun,2010;393(2):308-13.
7Spulber S, Edoff K, Hong L,etal. Molecular hydrogen reduces LPS-induced neuroinflammation and promotes recovery from sickness behaviour in mice 〔J〕.PLoS One, 2012;7(7):e42078.
8Kamimura N,Nishimaki K,Ohsawa I,etal. Molecular hydrogen improves obesity and diabetes by inducing hepatic FGF21 and stimulating energy metabolism in db /db mice 〔J〕.Obesity (Silver Spring) ,2011;19(7):1396-403.
9Qian L, Cao F, Cui J,etal. Radioprotective effect of hydrogen in cultured cells and mice〔J〕. Free Radical Res, 2010;44(3):275-82.
10Fujita K,Seike T,Yutsudo N,etal. Hydrogen in drinking water reduces dopaminergic neuronal loss in the 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine mouse model of Parkinson' s disease 〔J〕.PLoS One,2009;4(9) : e7247.
11Butterfield DA,Drake J, Pocernich C,etal. Evidence of oxidative damage in Alzheimer's disease brain:central role for amyloid beta-peptide〔J〕. Trends Mol Med, 2001;7(12):548-54.
12Wang JZ,Wang ZF. Role of melatonin in Alzheimer-like neurodegeneration〔J〕. Acta Pharmacol Sin, 2006;27(1):41-9.
13Kim MS,Lee LJ, Lee WY,etal. Neuroprotective effect of Ginkgo biloba L. extract in a rat model of Parkinson’s disease〔J〕. Phytother Res, 2004;18(8):663-6.
14Ohsawa I,Ishikawa M, Takahashi K,etal. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals〔J〕. Nat Med, 2007;13(6):688-94.
15Hayashida K,Sane M,Ohsawa I,etal. Inhalation of hydrogen gas reduces infarct size in the rat model of myocardial ischemia-reperfusion injury〔J〕. Biochem Biophys Res Commun, 2008;373(1):30-5.
16Ohsawa I, Nishimaki K,Yamagata K,etal. Consumption of hydrogen water prevents atherosclerosis in apolipoprotein E knockout mice〔J〕. Biochem Biophys Res Commun, 2008;377(4):1195-8.

