血管性痴呆大鼠海马神经元核因子-κB与环氧合酶-2水平的动态变化
王 佳 杨俊卿 余丽娟 杨 彬 赵 磊 蒋青松
(重庆医科大学药理教研室 重庆医科大学生物化学与分子药理学重点实验室,重庆 400016)
血管性痴呆(VD)是由缺血性和出血性脑血管疾病引起的获得性智能障碍综合征,现已成为老年期痴呆的重要组成部分。Clemens〔1〕用全脑缺血再灌注(GCIR)模型证明核因子κB(NF-κB)可能参与海马CA1区神经细胞的凋亡或死亡。非甾体抗炎药可延缓老年期痴呆的病情发展,环氧合酶-2(COX-2)蛋白在大鼠脑损伤中参与了神经元的凋亡〔2〕,提示COX-2在血管性痴呆中可能有一定促进作用。COX-2基因启动子序列中有2个κB位点,提示COX-2的作用与NF-κB紧密相关。翟锴华等〔3〕亦提出NF-κB、COX-2蛋白的高表达可能是VD大鼠学习记忆障碍的原因之一。有学者分别观察了GCIR大鼠海马中NF-κB〔4〕或COX-2蛋白表达的动态变化〔2〕,但不同研究者得到的结果并不一致,其原因可能由于采用的动物不同,或者缺血模型建立方式不同,或者观察时间点差异等。这就需要在同一个GCIR动物模型中同步观察NF-κB与 COX-2的表达变化特征。本研究拟动态观察GCIR后海马病理改变及NF-κB、 COX-2蛋白表达的时程。
1 材料与方法
1.1实验动物及分组 雄性 SD大鼠,SPF级,200~250 g,购自重庆医科大学实验动物中心〔动物证书号:SCXK(渝)2010-0001〕。SPF环境饲养3 d。术前12 h禁食,自由饮水。实验动物随机分为假手术组,GCIR 30 min、2、6、24、48、7、15 d组,每组12只。
1.2试剂 NF-κB p65多克隆抗体(Biworld ,BS5586)、免疫组化染色试剂盒(武汉博士德生物工程有限公司,SA1022)、兔抗COX-2多克隆抗体(SANTA, SC-1745)。
1.3方法
1.3.1脑血流测定 大鼠以水合氯醛(400 mg/kg腹腔注射)麻醉,剪开头部皮肤,暴露颅骨。将激光多普勒血流仪的探头固定于颅骨上,进行全脑缺血再灌注手术。激光多普勒血流仪记录大鼠手术过程中的脑血流变化,缺血操作时脑血流值(CBF)下降到正常血流值40%以下为入选标准。
1.3.2模型的建立 参照文献〔5〕的方法,将水合氯醛(400 mg/kg腹腔注射)麻醉后的大鼠仰卧固定,颈正中切口。分离双侧颈总动脉与一侧颈总静脉。由颈总静脉插管入心房,输入肝素化生理盐水。缓慢抽取每只大鼠总血容量体积分数0.3的血液(大鼠体重不同而血容量也不同),双侧颈总动脉夹闭20 min后松开动脉夹,然后缓慢回输血液,结扎颈总静脉,缝合伤口。假手术组除不进行抽血与夹闭双侧颈总动脉,其余手术操作同GCIR。手术过程中,大鼠体温保持在36.5℃~37.2℃。
1.3.3大鼠空间学习记忆能力测试 水迷宫测试分为两个阶段,第一阶段为训练阶段,第一次训练时将大鼠置于平台上1 min。后将大鼠分别从A、B、C、D四个象限背对平台入水,让其自由游泳找到隐蔽于水中的平台,观察记录其寻台潜伏期, 180 s内未找到平台者将其寻台潜伏期记为180 s。训练4 d,4次/d。第二阶段为测试阶段,第5天时,撤去平台,从A、B、C、D四个象限随机选定一个位置将大鼠放入水迷宫中,观察并记录大鼠寻台潜伏期作为大鼠记忆成绩。因为动物手术后伤口需要愈合,故仅对假手术组和GCIR 15 d两组大鼠在第8~12天进行水迷宫测试。
1.3.4组织病理学检查 大鼠以水合氯醛(400 mg/kg腹腔注射)麻醉,仰卧位固定。剪开胸腔,剥离心包,头皮针经心尖刺入左心室,灌注肝素化生理盐水,以肝脏作为血液与灌注液出口。注入4%多聚甲醛的磷酸缓冲液进行在体脑组织固定。分离脑组织,4%多聚甲醛固定3 d,脑组织冠状切片,厚约5 μm,HE染色观察海马神经元形态及数目变化。400倍镜下随机选取相应区域3个不重叠视野进行神经元细胞计数(n=4)。
1.3.5大鼠海马NF-κB p65免疫组织化学染色 免疫组织化学SABC法检测大鼠海马组织NF-κB p65 的表达。按试剂盒说明书操作,其中 NF-κB p65多克隆抗体(1∶500),4℃过夜,DAB显色。NF-κB p65阳性细胞呈棕黄色。应用Image-Pro Plus 6.0 图像分析软件在400倍视野下选取相应区域3个不重叠视野检测阳性染色部位的积分光密度(IOD)值。按平均IOD=IOD/面积计算,实验重复4次取其平均值表示NF-κB的相对表达量(n=4)。
1.3.6Western印迹测定大鼠皮层COX-2 蛋白表达 提取大鼠海马蛋白,加入上样缓冲液煮沸变性。SDS-PAGE电泳,转移至PVDF膜上,室温封闭1 h,TBST洗膜10 min×3次,加入COX-2抗体(1∶100) 或β-actin(1∶1 000),4℃过夜,TBST洗膜10 min×3次,辣根酶标记的二抗(1∶2 000)室温孵育1 h,TBST洗膜10 min×3次,ECL化学发光。以COX-2与β-actin的光密度比值作为COX-2蛋白的相对量(n=4)。

2 结 果
2.1模型大鼠手术中脑血流变化 夹闭双侧颈总动脉前,CBF为(276.15±13.37)PU ,缺血时降为(85.27±4.69)PU,降幅达到69.13%。夹闭完成后,血流迅速恢复接近至基线,均值为(239.53±9.88)PU,但未完全恢复至夹闭前水平。
2.2大鼠海马组织病理形态学变化 假手术组大鼠海马神经元结构清楚完整,细胞排列层次分明。而GCIR大鼠海马神经元出现明显的核固缩,细胞层次及数目明显减少(图1)。随再灌注时间延长,出现核固缩的细胞数逐渐增多,海马神经细胞死亡率增加,再灌注30 min、2、6、24、48 h分别为12.71±2.33、32.92±11.75、51.36±75.52、68.18±13.34、76.9±9.63;至第7天达到高峰(91.53±7.96)(P<0.01),第15天略有下降(83.62±4.20),但仍明显高于假手术组(4.67±1.65)(P<0.01)。

图1 GCIR大鼠海马组织病理学改变(×400)
2.3GCIR对大鼠空间学习记忆能力的影响 与假手术组相比,训练阶段与测试阶段中,GCIR组大鼠寻台潜伏期均明显延长(P<0.05)。随着训练天数和训练次数的增加,两组大鼠的寻台潜伏期均明显缩短,但模型组大鼠所用时间仍明显多于假手术组(P<0.05)。见表1。

表1 VD大鼠寻台潜伏期比较
2.4GCIR大鼠海马NF-κB p65蛋白表达变化 免疫组化显示,假手术组大鼠海马神经元细胞结构完整、层次分明, NF-κB p65阳性细胞相对较少,染色较浅,神经元胞质及核周呈淡黄色,胞核内未见明显染色。GCIR组大鼠海马神经元NF-κB p65阳性细胞数增加、表达增强,阳性表达由胞质转移至胞核,胞核深染呈棕黄色(图3)。光密度值统计显示,NF-κB p65阳性细胞平均光密度值再灌注30 min开始升高,24 h达峰值。随后逐渐下降,但15 d后仍高于假手术组。见表2。
2.5全脑缺血再灌注大鼠海马COX-2 蛋白表达的变化 与假手术组比较,GCIR组大鼠海马组织中的COX-2蛋白表达水平于再灌注2 h显著升高,7 d达峰值,15 d时下降,但仍明显高于假手术组(图3,表2)。
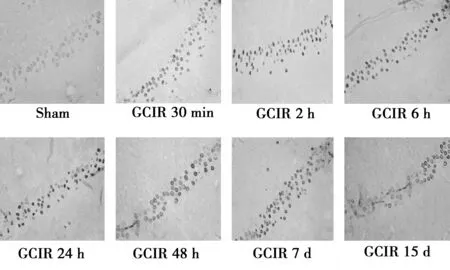
图2 GCIR 大鼠海马NF-κB蛋白表达变化(×400)
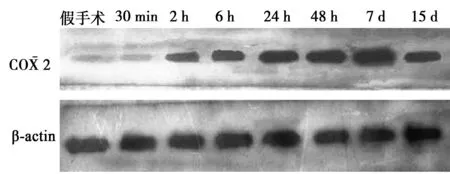
图3 血管性痴呆大鼠海马COX-2 蛋白表达变化

表2 VD大鼠海马NF-κB和COX-2蛋白相对表述量
3 讨 论
本研究从脑血流变化、学习记忆能力以及病理形态等方面均证明VD大鼠模型建立成功。
研究结果显示,再灌注30 min~15 d,大鼠海马NF-κB的活性明显增加,可能是GCIR损伤后,早期的氧化应激反应使NF-κB活化转位入核,诱导一系列炎症相关基因的表达,使促炎性的细胞因子如TNF-α和IL-6等增多。而这些炎性细胞因子又可导致NF-κB活化,形成正反馈,促使炎症反应进一步扩大,即NF-κB信号通路的正反馈调节〔6〕。再灌注第24小时后,NF-κB的活性下降,可能因为IκB与活化的NF-κB结合,使其与靶基因的结合位点脱离,重新转位于细胞质中,使NF-κB失活,即NF-κB信号通路的负反馈调节〔7〕。提示NF-κB过表达参与了GCIR全过程,而NF-κB抑制剂使用的时间窗最好在脑缺血再灌注24 h内。已有研究证明,NF-κB的抑制剂吡咯烷二硫基甲酸酯(PDTC)能使局灶性脑缺血的治疗时间窗延长〔8〕。
本研究中COX-2蛋白表达水平的变化与海马神经元损伤变化基本一致。已有研究发现,COX-2抑制剂能减少神经元凋亡〔9〕;在全脑缺血后24 h给予尼美舒利仍能挽救海马CA1区锥体细胞的死亡〔10〕;另一个高选择性COX-2的抑制剂DFU也能改善全脑缺血再灌注7 d沙土鼠的自发性活动〔11〕。本研究进一步证实,与NF-κB相似,COX-2表达参与了GCIR的病理生理过程,关系似乎比NF-κB更密切。
本研究还发现,VD大鼠海马中NF-κB与 COX-2的时程变化并不同步;NF-κB的变化早于COX-2,而海马神经元的凋亡、学习记忆功能的受损与COX-2的变化时程基本一致,提示NF-κ B活化可能上调了VD大鼠海马神经元中COX-2表达水平,进而参与脑损伤病理生理过程的调节。
有趣的是,VD大鼠海马神经元NF-κB的活性在再灌注24 h达到峰值后逐渐下降,但COX-2 蛋白表达水平仍逐渐升高并维持较高水平。GCIR早期COX-2表达增加可能是由于早期NF-κB已经活化,随之激活了COX-2的表达;24 h后,NF-κB表达下降,但其活化后刺激TNF-α〔12〕和IL-6〔13〕增多,而TNF-α和IL-6也能激活COX-2的表达〔14〕,TNF-α和IL-6与NF-κB协同作用使再灌注24 h后COX-2蛋白继续升高。
4 参考文献
1Clemens JA.Cerebral ischemia:gene activation,neuronal injury,and the protective role of antioxidants 〔J〕.Free Radic Biol Med,2000;28(10):1526-31.
2Nakayama M,Uchimura K,Zhu RL,etal.Cyclooxygenase-2 inhibition prevents delayed death of CA1 hippocampal neurons following global ischemia 〔J〕.Proc Natl Acad Sci U S A,1998;95(18):10954-9.
3翟锴华,卢 宏,滕军放,等.血管性痴呆大鼠海马区核因子κB、环氧合酶-2的表达变化 〔J〕.中国实用神经疾病杂志,2007;10(3):88-9.
4王 涛,文 亮.全脑缺血/再灌注大鼠海马核转录因子-κB的表达及其在神经元损伤中的作用 〔J〕.临床急诊杂志,2008;9(1):7-9.
5Kuang G,He Q,Zhang Y,etal.Modulation of preactivation of PPAR-β on memory and learning dysfunction and inflammatory response in the hippocampus in rats exposed to global cerebral ischemia/reperfusion〔J〕.PPAR Res,2012;2012:209794.
6Hiasa G,Hamada M,Ikeda S,etal.Ischemic preconditioning and lipopolysaccharide attenuate nuclear factor-kappaB activation and gene expression of inflammatory cytokines in the ischemia-reperfused rat heart 〔J〕.Jpn Circ J,2011;65(11):984-90.
7Tergaonkar V.NF-κB pathway:a good signaling paradigm and therapeutic target 〔J〕.Int J Biochem Cell Biol,2006;38(10):1647-53.
8Nurmi A,Vartiainen N,Pihlaja R,etal.Pyrrolidine dithiocarbamate inhibits translocation of nuclear factor kappa-B in neurons and protects against brain ischaemia with a wide therapeutic time window 〔J〕.J Neurochem,2004;91(3):755-65.
9李学忠,刘春风.中枢神经系统内COX-2的表达和作用 〔J〕.国外医学·老年医学分册,2006;27(5):232-5.
10Candelario-Jalil E,González-Falcón A,García-Cabrera M,etal.Wide therapeutic time window for nimesulide neuroprotection in a model of transient focal cerebral ischemia in the rat 〔J〕.Brain Res,2004;1007(1-2):98-108.

12Botchkina GI,Geimonen E,Bilof ML,etal.Loss of NF-kappaB activity during cerebral ischemia and TNF cytotoxicity 〔J〕.Mol Med,1999;5(6):372-81.
13Murakami M,Hirano T.The pathological and physiological roles of IL-6 amplifier activation 〔J〕.Int J Biol Sci,2012;8(9):1267-80.
14董 伟,王良兴.环氧化酶2与缺氧关系的研究进展 〔J〕.医学综述,2009;15(4):502-5.

