猪圆环病毒2型Cap蛋白单克隆抗体制备及线性抗原表位鉴定
张 璐,王延群,郝立沙,高明明,李爱东,陶 冶,李 莉,涂亚斌,蔡雪辉*,路义鑫*
(1.东北农业大学动物医学学院,黑龙江哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/动物疫病诊断中心,黑龙江哈尔滨 150001)
猪圆环病毒2型Cap蛋白单克隆抗体制备及线性抗原表位鉴定
张 璐1,王延群2,郝立沙2,高明明2,李爱东2,陶 冶2,李 莉2,涂亚斌2,蔡雪辉2*,路义鑫1*
(1.东北农业大学动物医学学院,黑龙江哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/动物疫病诊断中心,黑龙江哈尔滨 150001)
为制备猪圆环病毒2型(PCV2)Cap蛋白单克隆抗体(MAb)及鉴定其抗原表位,本研究采用PCV2去核定位信号Cap蛋白(dCap),通过杂交瘤技术制备1株杂交瘤细胞株(4E2),制备小鼠腹水效价达1∶64 000,亚类鉴定为IgG1/κ链。Western blot分析显示,该株MAb与毕赤酵母表达的dCap和原核表达的Cap蛋白均可以发生特异性免疫反应。采用肽扫描法对MAb的非核定位信号区进行抗原表位鉴定,结果表明该MAb可以识别的线性表位区域为131TKATALTYDPYVNYSS146。本实验结果为进一步研究Cap蛋白的结构和PCV2临床检测方法的建立奠定基础。
猪圆环病毒2型;dCap;单克隆抗体;表位
猪圆环病毒(Porcine circovirus,PCV)可以分为两种血清型,即PCV1和PCV2[1],其中只有PCV2具有致病性,可以导致猪群继发感染其他病原并可以产生免疫抑制病。当前普遍认为PCV2是引起仔猪断奶多系统综合征(PMWS)的主要原因[2]。
PCV2为单股环状DNA病毒,全长为1 766 nt~1 768 nt,其中包含两个开放阅读框(ORFs):ORF1编码该病毒的非结构蛋白Rep和Rep',参与病毒的复制;ORF2编码该病毒唯一的结构蛋白Cap蛋白。Cap蛋白的aa 1~aa 41为核定位信号区,其余为非核定位信号区域,许多研究表明Cap蛋白的抗原表位多集中在该区域:Shang等利用肽段扫描法鉴定出该区域5个B细胞的线性表位,其中aa 231~aa 233,aa 195~aa 202为 PCV2的特异性表位,aa 92~aa 103为PCV1特异性表位,而aa 156~aa 162和aa 175~aa 192为PCV1和PCV2共同识别的表位[3];Lefebvre等利用单克隆抗体(MAb)与不同病毒Cap蛋白免疫反应性差异,证明不同PCV2病毒株存在抗原差异[4]。除了线性表位之外,Huang等也通过感染性克隆技术鉴定出第59位氨基酸的位置是PCV2的一个构象表位[5];Lekcharoensuk等利用构建嵌合病毒,鉴定出在aa 47~aa 85,aa 165~aa 200和aa 230~aa 233这3个区域内有5个相互重叠的构象表位[6]。本研究对非核定位信号区的Cap蛋白(dCap)进行表达纯化,通过制备MAb,从而对该区域的抗原表位进行分析。
1 材料和方法
1.1 主要实验材料 dCap蛋白及原核表达Cap蛋白均由哈尔滨兽医研究所诊断中心提供;SP2/0骨髓瘤细胞由本实验室保存;抗Cap蛋白阳性血清为dCap蛋白免疫小鼠制备,阴性血清为未免疫小鼠血清;5周龄~7周龄BALB/c雌性小鼠购自哈尔滨兽医研究所实验动物中心;HRP标记的山羊抗鼠IgG抗体(HRP-IgG)、弗氏完全佐剂、PEG4000、HAT、HT均购自Sigma公司;MAb亚型检测试剂盒购自SouthernBiotect公司;二氨基联苯胺(DAB)显色试剂盒购自北京中杉金桥生物技术有限公司;DAB底物显色液购自天根生化科技(北京)有限公司。
1.2 MAb的制备 将弗氏完全佐剂与dCap蛋白混合进行乳化制备免疫原,剂量为100 μg/只,按常规免疫程序免疫小鼠。四免后取小鼠脾淋巴细胞与SP2/0细胞进行融合。以纯化的dCap蛋白[7]为抗原建立间接ELISA方法筛选阳性杂交瘤细胞株,采取有限稀释法进行多次亚克隆,具体操作方法参考文献[8]。
1.3 MAb效价测定及亚型鉴定 利用筛选出能够稳定分泌抗体的阳性杂交瘤细胞制备腹水,并采取辛酸-饱和硫酸铵方法纯化腹水,制备方法参考文献[8],通过间接ELISA方法检测腹水效价。使用SouthernBiotect公司的MAb亚型分类试剂盒进行MAb亚型鉴定。
1.4 Westernblot鉴定和间接免疫荧光(IFA)检测将毕赤酵母表达的dCap蛋白和原核表达的Cap蛋白分别进行SDS-PAGE后转膜处理,以MAb为一抗,山羊抗鼠HRP-IgG为二抗,SP2/0上清液作为阴性对照,DAB试剂盒显色,进行western blot分析。将PCV2感染PK15单层细胞,48 h后弃上清液,利用冰的无水乙醇固定,以MAb为一抗,山羊抗鼠FITC-IgG为二抗,同时设立小鼠阳性血清和阴性血清做对照,进行IFA鉴定。
1.5 肽扫描法对抗原表位定位 根据GenBank中登录的PCV2(FJ644559.1)基因序列,通过DNAStar软件分析dCap蛋白氨基酸序列,设计19个短肽,其中每个短肽含有16个氨基酸,前后重叠6个氨基酸(表1)。利用原核表达系统,选取pMAL-c4xTM载体表达一系列短肽。将表达出的短肽与MAb进行dot blot和间接ELISA分析。

表1 根据dCap蛋白氨基酸序列设计的短肽序列Table 1 Design of the peptide sequence overlapping PCV2 dCap coding region
2 结 果
2.1 MA b的制备和筛选 利用酵母表达纯化后的dCap蛋白免疫小鼠,将小鼠的脾淋巴细胞与SP2/0骨髓瘤细胞进行融合,通过间接ELISA方法检测细胞上清液,经过3次亚克隆纯化后筛选到一株能够稳定分泌抗dCap蛋白特异性抗体的杂交瘤细胞系,命名为4E2。
2.2 MA b亚型鉴定和效价检测 利用MAb亚型检测试剂盒鉴定结果表明,MAb 4E2属于IgG1,轻链为κ;间接ELISA检测杂交瘤细胞上清液抗体效价为 1∶1 200,腹水经纯化后效价为 1∶64 000。
2.3 We s t e r nb l o t鉴定 将MAb分别与毕赤酵母表达的dCap蛋白和原核表达的Cap蛋白反应,western blot分析结果显示所制备MAb不仅与dCap蛋白反应还可以与原核表达的Cap蛋白发生特异性反应(图 1)。
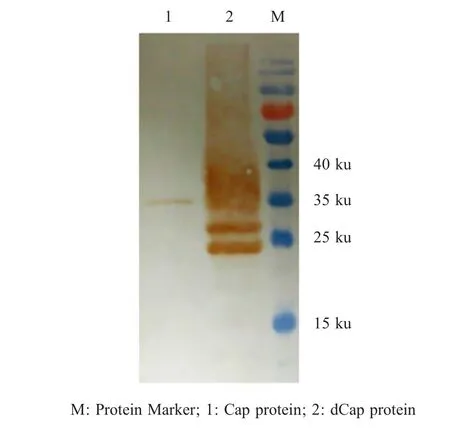
图1 MAb与酵母表达dCap蛋白和大肠杆菌表达Cap蛋白的western blot鉴定Fig.1 Reaction analysis of MAb with dCap and Cap by western blot
2.4 I F A鉴定 PCV2感染PK15细胞48 h后,利用MAb进行IFA检测,结果显示,该MAb和阳性血清组均检测到绿色的荧光信号,而阴性对照组无反应,表明该MAb能够与PCV2发生特异性反应(图 2)。
2.5 MA b识别抗原表位初步鉴定 将杂交瘤细胞培养上清液与所表达的短肽进行dot blot和间接ELISA检测,检测结果显示,该株MAb除与dCap蛋白外仅可以与JD-10肽段抗原呈阳性反应(图3,图4),表明MAb识别表位位于该区域131TKATALTYDPYVNYSS146。

图2 MAb的IFA鉴定结果Fig.2 Indentification of the MAb in PK15 infected PCV2 by IFA

图3 Dot blot鉴定MAb识别的抗原表位分析Fig.3 Indentification of the MAb epitope by dot blot

图4 肽段ELISA扫描鉴定MAb识别的抗原表位分析Fig.4 Indentification of the MAb epitope by iELISA
3 讨 论
Cap蛋白为PCV2病毒的主要结构蛋白,其蛋白N端前41个氨基酸是病毒核内定位信号,含有酵母的稀有密码子,影响了外源蛋白的高效表达[7],所以本研究去除Cap蛋白的核定位信号区域,对主要抗原结构区域进行表达,不但能够利用酵母表达系统高效表达出外源蛋白,而且对蛋白的抗原结构无严重影响,有利于疫苗的制备和血清学诊断方法的建立。
利用所表达的dCap制备MAb,对该MAb识别的抗原表位进行鉴定。结果表明,所制备的杂交瘤细胞能够稳定分泌抗dCap的MAb,制备的腹水效价达到1∶64 000。通过western blot分析,MAb不仅识别酵母表达的dCap,而且与原核表达的Cap蛋白也存在着免疫反应。将截短的dCap短肽与MBP标签进行融合表达,抗原表位鉴定结果显示,MAb只与JD-10肽段反应,dot blot和间接ELISA结果相一致,表明MAb识别的抗原表位只在此区域,对应的序列131TKATALTYDPYVNYSS146为MAb的线性表位。该表位属于首次鉴定的Cap蛋白的新线性抗原表位,与目前文献报道存在差异[6,9-10]。
本研究制备了一株高效价、特异性良好的MAb,并首次鉴定出Cap蛋白新的表位区域,为进一步研究Cap蛋白功能及PCV2的临床检测奠定了基础。
[1]Olvera,A,Cortey M,Segales J.Molecular evolution of porcine circovirus type 2 genomes:phylogeny and clonality[J].Virology,2007,357(2):175-185.
[2]Walker I W,Konoby C A,Jewhurst V A,et al.Development and application of a competitive enzyme-linked immunosorbent assay for the detection of serum antibodies to porcine circovirus type 2[J].J Vet Diagn Invest,2000,12(5):400-405.
[3]Shang Shao-bin,Jin Yu-lan,Jiang Xue-tao,et al.Fine mapping of antigenic epitopes on capsid proteins of porcine circovirus,and antigenic phenotype of porcine circovirus type 2[J].Mol Immunol,2009,46(3):327-334.
[4]Lefebvre D J,Costers S,Van D,et al.Antigenic differences among porcine circovirus type 2 strains,as demonstrated by the use of monoclonal antibodies[J].J Gen Virol,2008,89(1):177-187.
[5]Huang Li-ping,Lu Yue-hua,Wei Yan-wu,et al.Identification of one critical amino acid that determines a conformational neutralizing epitope in the capsid protein of porcine circovirus type 2[J].BMC Microbiol,2011,11(1):188.
[6]Lekcharoensuk P,Morozov I,Paul P S,et al.Epitope mapping of the major capsid protein of type 2 porcine circovirus(PCV2)by using chimeric PCV1 and PCV2[J].J Virol,2004,78(15):8135-8145.
[7]Tu Ya-bin,Wang Yan-qun,Wang Gang,et al.High-level expression and immunogenicity of a porcine circovirus type 2 capsid protein through codon optimization in Pichia pastoris[J].Appl Microbiol Biotechnol,2013,97(7):2867-2875.
[8]黄立平,刘长明,危武艳,等.抗猪圆环病毒2型Cap蛋白中和性单克隆抗体的制备及鉴定[J].中国预防兽医学报,2009,31(2):132-136.
[9]郭龙军,陆月华,黄立平,等.猪圆环病毒2型Cap蛋白核定位信号区抗原表位的鉴定[J].中国农业科学,2010,43(7):1480-1486.
[10]申会刚,周继勇,陈庆新,等.猪圆环病毒Ⅱ型Rep基因在PK15细胞中的表达及特性[J].中国兽医学报,2005,25(3):244-246.
Preparation of the monoclonal antibody against Cap protein of porcine circovirus type 2 and its antigenic epitope identification
ZHANG Lu1,WANG Yan-qun2,HAO Li-sha2,GAO Ming-ming2,LI Ai-dong2,TAO Ye2,LI Li2,TU Ya-bin2,CAI Xue-hui2*,LU Yi-xin1*
(1.College of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China;2.Animal Disease Diagnosis Center,State Key Laboratory of Veterinary Biotechnology,Harbin Veterinary Research Institute,Chinese Academy of Agricultural Sciences,Harbin 150001,China)
To prepare monoclonal antibodies(MAb)against Cap protein of porcine circovirus II(PCV2)and identify the antigen epitope,a MAb against PCV2 was prepared by lymphocyte hybridoma technique with the recombinant Cap protein without nuclear location signal(dCap)expressed byP.pastoria.The MAb was belonged to IgG1 subclass and κ light chain.The ELISA titer of MAb was 1∶64 000 in ascites.Western blot indicated that MAb was reacted with PCV2-dCap expressed inP.pastoriaand PCV2-Cap expressed inE.coli.IFA assay showed the MAb was reacted with PCV2 in PK15 cells.Furthermore,the MAb recognized dCap protein epitope of131TKATALTYDPYVNYSS146mapped by a serious of prokaryotic expressed peptides.The MAb prepared in this study is useful tool for developing immunological diagnostic techniques of PCV2 and further investigation of the Cap protein.
porcine circovirus type 2;dCap;monoclonal antibody;antigenic epitope
S852.65
A
1008-0589(2014)04-0310-04
10.3969/j.issn.1008-0589.2014.04.14
*Correspondingauthor
2013-10-11
“十二五”高技术研究发展计划(2011AA10A213);哈尔滨市科技攻关计划项目(2010AA6AN083);黑龙江省自然科学基金(C201047)
张 璐(1989-),女,黑龙江哈尔滨人,硕士研究生,主要从事预防兽医学研究.
*通信作者:E-mail:luyixin@neau.edu.cn;aci139@sina.com
(本文编辑:任安琦)

