纳米生物传感器在前列腺癌早期检测中的应用*
赵 彬 黎振华 宋世平 樊春海
纳米生物传感器在前列腺癌早期检测中的应用*
赵 彬 黎振华 宋世平 樊春海

樊春海 博士,研究员,现任物理生物学研究室和上海光源国家科学中心(筹)生物成像中心主任,南京大学生物化学学士(1996年)和博士(2000年)学位,之后在加州大学圣巴巴拉分校(UCSB)从事博士后研究。2004年1月起任中国科学院上海应用物理研究所研究员,2004年入选中国科学院百人计划。2007年获得国家杰出青年基金,2011年任科技部重大科学研究计划(纳米)首席科学家。主要研究方向为生物传感器、DNA纳米技术与DNA计算和生物光子学。现任美国化学会ACS Applied Materials&Interfaces副主编,Scientific Reports(化学生物学部分)和Advanced Healthcare Materials、Particle等杂志编委,Advanced Materials客座编辑。已在Nature Nanotechnology,Nature Protocols,PNAS等杂志发表论文200余篇,论文引用8 000余次。
纳米生物传感器是纳米技术与生物传感器的融合,其研究涉及纳米技术、生物技术、微电子技术和分析技术等多个重要领域。近年来,随着各种纳米材料的不断涌现和纳米技术的蓬勃发展,纳米生物传感器在疾病诊断领域展现出日益广泛的应用性。前列腺癌是当前威胁全世界男性健康的主要恶性肿瘤之一,对低浓度的前列腺癌标志物进行高效检测有利于前列腺癌的早期诊断、治疗监测及复发预测,具有重要的临床意义。本文针对生物传感器在前列腺癌标志物检测中的应用,介绍近年来纳米生物传感技术在前列癌早期诊断中的研究进展与应用前景。
纳米生物传感器 前列腺癌标志物 检测 早期诊断
前列腺癌是当前威胁全世界男性健康的主要恶性肿瘤之一。在欧美国家,其发病率已连续多年居男性恶性肿瘤发病率首位,死亡率居第二位[1]。我国的前列腺癌发病率和死亡率虽低于欧美国家,但近年来呈现出显著的增长趋势。前列腺癌标志物检测对于前列腺癌的早期诊断和治疗具有极为重要的意义。近年来由于前列腺癌标志物研究的迅猛发展,使得前列腺癌的早期诊断率明显提高。前列腺癌标志物在前列腺癌普查、诊断、判断预后和转归、评价治疗疗效和高危人群随访观察等方面都具有重大的实用价值。
1 常见的前列腺癌肿瘤标志物
前列腺特异性抗原(prostate-specific antigen,PSA)是目前诊断前列腺癌最敏感的指标,被广泛应用于前列腺癌的早期诊断、监测治疗及预测复发。流行病学数据显示,自从开展PSA筛查,美国前列腺癌死亡率下降了40%。PSA是由前列腺上皮细胞产生的一种大分子糖蛋白,分子量约为34 kD,具有极高的组织器官特异性。在血清中总PSA(t-PSA)主要有两种存在形式:游离PSA(f-PSA)和与多种蛋白酶抑制剂结合的结合PSA(c-PSA)。cPSA有多种亚型,主要有PSA与α 1抗糜蛋白酶(ACT)的结合物(PSA-ACT)、与α2蛋白水解酶抑制剂的结合物(PSA-API)和与α2巨球蛋白的结合物(PSA-α2M)等,检测PSA各种分子形式的浓度及其比值可以更有效地鉴别诊断前列腺癌和良性前列腺增生。最常用的是检测f-PSA并且比较f-PSA/t-PSA的比值,可以更加有效地提高诊断灰色区(t-PSA浓度为4~10 ng/mL)的诊断真实性,降低误诊率。由于血清中PSA的浓度较低,特别是f-PSA浓度极低,因此对于PSA进行高灵敏特异性检测具有重要的临床意义和实用价值。
前列腺特异性膜抗原(prostate-specific membrane antigen,PSMA)是一种新发现的前列腺癌相关的糖蛋白膜抗原。由于PSMA在前列腺癌细胞膜上特异性高表达,使其可能成为治疗激素不敏感型前列腺癌抗体导向治疗的新靶点,因此受到越来越多的关注。
微小核糖核酸(microRNA,miRNA)是一种具有调控功能的非编码核糖核酸小分子,长度大约为20~25个碱基。研究发现miRNA在人体多种生理及病理过程中,特别是在癌症的发生和发展中具有重要的作用,研究证实在前列腺癌细胞中都存在某些特定miRNA的表达升高或降低[2]。通过研究多种miRNA在前列腺组织中的表达情况,可以协助前列腺癌的病理诊断和临床病理分级。因此,对前列腺癌相关miRNA进行检测并将其作为前列腺癌的生物学标志对于前列腺癌的早期诊断、治疗效果判定和预后评估具有很高的临床价值。
2 前列腺癌标志物检测的纳米传感模式
前列腺癌的早期诊断和治疗长期以来一直是医学领域试图攻克的难题。纳米生物传感器的发展及其在医学领域的广泛应用为建立有效的癌症早期诊断和治疗技术提供了新的契机[3]。纳米生物传感器是纳米技术与生物传感器的融合,其研究涉及纳米技术、生物技术、微电子技术和分析化学等多个重要领域。通过将纳米技术与生物传感技术相结合构建纳米生物传感器,可以大幅改善早期诊断的效果。
近年来随着纳米材料的不断涌现和纳米技术的蓬勃发展,纳米生物传感器已开始用于前列腺癌标志物的检测研究。根据纳米材料在纳米生物传感器中所扮演的角色,可将前列腺癌标志物检测的纳米传感模式分为纳米生物探针设计和纳米界面信号转导两大类(图1)。纳米生物探针设计通过将核酸分子和蛋白质分子装配在各种纳米材料(如纳米金、碳纳米管、量子点和石墨烯等)表面,构成多组分的复合纳米生物探针。纳米界面信号转导利用纳米材料独特的光学、电学、力学等物理和化学性质将纳米材料界面上的分子识别事件转换为可测量的信号进行输出。

图1 前列腺癌标志物检测中的纳米生物传感模式:纳米生物探针设计和纳米界面信号转导Figure 1 Nano-biosensor design for detecting prostate cancer biomarkers:nanoprobes and transducers
2.1 纳米生物探针设计
2.1.1 纳米金 纳米金(gold nanoparticles,AuNPs)因其具有良好的生物相容性和稳定可靠的偶联化学等优点一直以来受到人们广泛的关注[4]。2003年Nam等[5]开发了一种基于纳米金的生物条形码检测技术(bio-bar code assay,BCA)用于PSA的超灵敏检测。该技术包含两种探针:一种是修饰了PSA单克隆抗体的磁微粒探针,另一种是共组装有条形码DNA和PSA多克隆抗体的纳米金探针。其检测原理为:首先目标蛋白分子被磁微粒探针上的单克隆抗体捕获,随后被纳米金探针上的多克隆抗体特异性识别,从而形成由磁微粒、目标蛋白和纳米金探针三者组成的三明治夹心复合物。之后,复合物经磁场分离,富集的纳米金探针经热变性释放出大量条形码DNA。最后利用银染增强纳米金探针技术对条形码DNA或其PCR扩增产物进行检测,从而达到间接检测目标蛋白PSA的目的。由于在每个目标蛋白分子的结合过程中纳米金探针上都组装有大量的条形码DNA,再加上进一步的PCR信号放大过程,对PSA的检测限可达到3 amoL。该方法的检测灵敏度比常规的临床检测方法高出6个数量级。Stoeva等[6]将生物条形码技术进一步发展为可以实现包括PSA在内的多元肿瘤标志物检测技术。2009年Thaxton等[7]利用生物条形码技术实现了对根治性前列腺切除术患者血清PSA水平的高灵敏检测,并建立了其与前列腺癌复发的相关联系,可有效地用于前列腺癌复发的预测和评估。
Yan等[8]通过将DNA滚环扩增技术(rolling circle amplification,RCA)与纳米金复合探针相结合,建立了一种基于纳米金复合探针的的纳米滚环扩增技术(nano rolling cirlce amplification,NanoRCA)用于肿瘤标志物的超高灵敏分析(图2)。修饰有捕获抗体的磁纳米颗粒探针和共组装有RCA扩增引物及检测抗体的纳米金复合探针,在目标蛋白的存在下通过抗原抗体特异性结合形成三明治夹心复合物。利用RCA反应使生物素位点嵌入到RCA的产物中,通过亲和素-生物素系统将信号分子-亲和素修饰的辣根过氧化物酶(HRP)结合到RCA产物上,最终利用酶催化反应产生的比色信号实现对目标蛋白的定量分析。由于RCA具有极高的扩增能力,使大量的信号分子负载到分析体系中,因此该方法具有超高的灵敏度,可以实现血清中30 aM的PSA分子的超高灵敏检测。
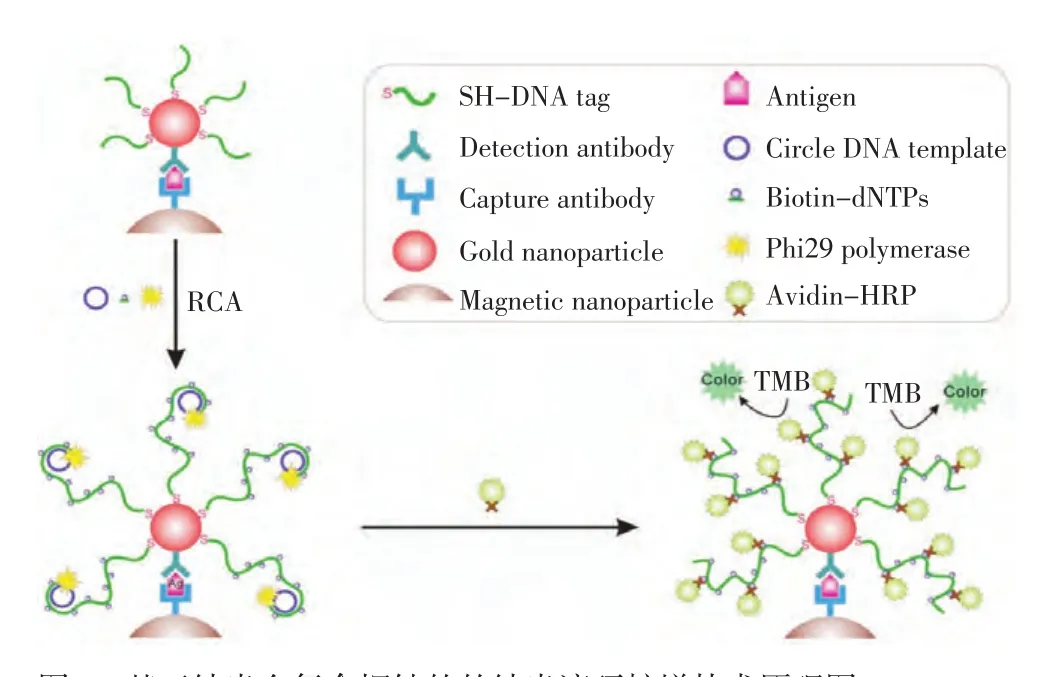
图2 基于纳米金复合探针的的纳米滚环扩增技术原理图Figure 2 Nano-RCA strategy based on gold nanoparticle probes for PSA detection
2.1.2 碳纳米材料 碳纳米管(carbon nanotubes,CNTs)是一种具有特殊结构的一维碳纳米材料,具有优良的电学性质和大的比表面积。Yu等[9]发展了一种基于多壁碳纳米管复合探针和单壁碳纳米管森林的电化学免疫传感器用于生物样品中PSA的高灵敏检测。通过将HRP信号分子和二抗共组装到多壁碳纳米管上制备多标记的多壁碳纳米管复合探针,大大提高了检测灵敏度。该方法对于未稀释牛血清样品中PSA的检测限为4 pg/mL,对于前列腺癌患者血清中PSA检测具有较高的精确度。此外,该方法还可以对传统免疫组织化学染色法无法区分的前列腺癌组织样品中PSA含量进行定量检测。Wan等[10]将羊抗兔二抗和HRP共组装的通用多标记碳纳米管探针与丝网印刷碳电极相结合,发展了一种新型的电化学免疫传感器实现了对PSA和白细胞介素-8(IL-8)的二元检测。Zhao等[11]利用RCA对多壁碳纳米管进行功能化,构建了基于多壁碳纳米管的滚环扩增信号放大系统(CRCAS),并将其进一步应用于肿瘤标志物的高灵敏高特异性检测。CRCAS化学发光免疫分析法对于PSA的检测限达到10 fg/mL。
石墨烯是一种由单层碳原子组成的二维的碳纳米材料,Yang等[12]建立了一种基于PSA抗体和HRP共组装石墨烯纳米片探针的免疫分析方法。利用石墨烯片层大的比表面积和良好的导电性,可实现对PSA的高灵敏检测,检测限为1 pg/mL。该方法线性响应范围宽(0.02~10 ng/mL),具有良好的重现性和稳定性。
2.1.3 量子点 作为新型的荧光标记物,量子点(quantum dots,QDs)具有宽激发窄发射、光稳定性高、抗光漂白能力强和易于多元化等优点,是一种理想的纳米生物探针。Kerman等[13]开发了一种基于链霉亲和素修饰的量子点探针的免疫传感策略,在丝网印刷碳电极表面进行免疫识别,利用荧光成像方法实现了对t-PSA的高灵敏检测,检测限为0.25 ng/mL。Yang等[14]利用均相溶液中量子点-聚合物复合物的外延自组装制备了新型的条形码纳米珠,具有尺寸均一、发光效率高和抗光漂白等优点。通过修饰链霉亲和素,制得量子点纳米珠探针,采用免疫夹心模式对PSA进行检测,在未经优化的条件下即可检测亚纳摩尔水平的PSA。Wegner等[15]开发了一种基于量子点的荧光共振能量转移免疫分析方法用于血清样品中PSA的高灵敏检测。该方法以抗体修饰的量子点探针作为受体,与抗体偶联的铽(Tb)作为供体,当溶液中存在目标蛋白时,量子点探针、目标蛋白和抗体偶联的Tb形成夹心复合物,量子点探针受体与Tb供体发生,50 μL血清样品中PSA的检测限为1.6 ng/mL。
2.2 纳米界面信号转导
2.2.1 场效应晶体管 场效应晶体管(field-effect transistor,FET)简称场效应管,是利用控制输入回路的电场效应来控制输出回路电流大小的一种半导体器件。近年来,以纳米线和纳米管等纳米材料为传感元件的FET生物传感器具有无需标记、实时检测、高灵敏度和易于集成化微型化等优点,受到人们越来越广泛地关注。2005年Zheng等[16]开发了一种可寻址的硅纳米线FET集成微阵列芯片(图3)。该芯片通过将表面受体修饰到硅纳米线上对目标物进行特异性识别,利用受体与目标物的特异性结合所导致纳米线电导系数的变化对目标物进行检测。该方法可直接对未稀释血清样品中的PSA进行高灵敏高特异性分析,最低可检出0.9 pg/mL的PSA。此外,通过修饰不同的抗体受体到纳米线阵列上,可同时实现对多种目标蛋白的高灵敏检测。最近,Huang等[17]开发了一种多晶硅纳米线场效应晶体管生物传感器。通过对血清样品进行脱盐预处理以及采用钝化试剂对硅纳米线表面进行表面修饰以降低非特异性吸附,大大提高了其检测灵敏度,检测限为5 fg/mL。同时,该传感器还具有成本低易于制备等优点。Kim等[18]报道了一种基于还原石墨烯氧化物FET生物传感器用于PSA-ACT的高灵敏检测。该方法动态范围宽(6个数量级),线性响应良好,便于前列腺癌筛查。

图3 硅纳米线FET集成微阵列芯片用于PSA检测Figure 3 Silicon-nanowire FET integrated array chip for PSA detection
2.2.2 微悬臂梁 微悬臂梁是一种纳米机械信号转导装置,可以将其表面分子间的相互作用转换为机械形变或共振频率改变,具有体积小、响应速度快、灵敏度高和易于集成化等优点。微悬臂梁已用于多种生物分析领域,包括DNA杂交、单碱基错配检测和肿瘤标志物检测等。Wu等[19]最先报道了应用于PSA检测的微悬臂梁传感技术。通过将PSA多抗共价修饰在微悬臂梁的一侧对PSA进行特异性识别和结合,使微悬臂梁发生弯曲,利用激光光学系统对弯曲产生的形变进行检测。该方法可以在很大范围内检出fPSA的水平(0.2~60 ng/mL),具有较高的灵敏度。由于微悬臂梁一侧抗原抗体分子特异性结合所导致的表面自由能的变化,该方法具有高度的特异性。此后Yue等[20]将该技术进一步发展为二维微悬臂梁微阵列芯片技术,实现了对fPSA的高灵敏实时无标记检测。
2.2.3 等离子体纳米传感器 等离子体纳米传感器是一种基于金属纳米粒子的局域表面等离子体共振(localized surface plasmon resonance,LSPR)效应构建的光学生物传感器。作为一种新型光学传感器,等离子体纳米传感器在疾病诊断领域展现出日益广泛的应用性。Rodríguez-Lorenzo等[21]报道了一种基于酶反应指导晶体生长的金属等离子体纳米传感器在前列腺癌早期诊断中的应用。利用葡萄糖氧化酶(glucose oxidase,GOx)催化生成的过氧化氢将金纳米星周围溶液中的银离子还原为银原子,通过控制GOx的浓度来控制银离子的结晶速率。当GOx的浓度较低时,银离子的结晶速率较慢使得生成的银原子在金纳米星表面沉积,从而导致LSPR吸收峰产生较大的蓝移;当GOx的浓度较高时,银离子的结晶速率较快,使银原子更易于在溶液中独立成核生长而较少的沉积到金纳米星表面,从而产生较小的LSPR吸收峰蓝移,即SPR吸收峰的位移与GOx的浓度成负相关。作者进一步证实了该纳米传感器的在肿瘤标志物检测中的实用性和超灵敏性。通过将PSA抗体与GOx偶联在一起作为标记物,利用免疫反应使修饰有PSA多克隆抗体的金纳米星、PSA和PSA抗体-GOx标记物结合在一起形成夹心复合物。通过对LSPR最大吸收峰位移进行检测可计算得到GOx的浓度,进而计算出PSA的浓度。该传感器对于全血清样品中PSA的最低检测限为10~18 g/mL(4×10~20 M),可实现极低浓度PSA的检测,对前列腺癌早期诊断和术后复发诊断具有重要的临床意义。
2.2.4 DNA纳米技术 DNA纳米技术是指以DNA的理化特性为原理的纳米技术,是近年来新兴的前沿交叉领域。该技术充分利用DNA分子独特的理化性质和DNA复制的优越性,可实现精确的从底向上的纳米构筑,主要用于分子组装产生功能性组装聚合物,已开始应用于包括癌标志物诊治在内的诸多领域。Wen等[22]报道了一种基于DNA四面体纳米结构的界面工程化方法用于前列腺癌标志物miRNA分析。通过将DNA四面体纳米结构固定在金基底上,以四面体结构顶点上延伸出来的一段DNA序列作为捕获探针对目标miRNA进行捕获,采用碱基堆积策略夹心构型,将信号分子结合到DNA四面体纳米结构界面上,利用电化学方法进行检测。与传统的一维(单链DNA)或二维DNA(如发夹结构)探针相比,三维DNA四面体纳米结构具有高结构稳定性,可有效提高DNA捕获探针在传感界面分布的均一性。同时,利用未组装捕获探针的四面体可以精确调控DNA捕获探针的密度,降低分子的表面拥挤效应,从而显著提高检测的灵敏度和特异性。该方法成功实现了前列腺癌组织提取物中前列腺癌相关miRNA(let-7d)的高灵敏检测。Wen等[23]开发了一种基于脱氧核酶的滚环扩增DNA分子机器用于多种miRNA的超灵敏检测。该方法的超高灵敏度得益于RCA技术、切刻酶信号放大技术和脱氧核酶信号放大技术三者的结合,可以对正常前列腺细胞和癌细胞中的痕量miRNA标志物进行有效地检测鉴别。
3 小结
近年来,纳米生物传感器已快速发展成为前列腺癌标志物检测的有效手段之一,对于前列腺癌早期诊断技术的发展有着极大的促进作用。构建新型的纳米生物传感器对临床样本(全血、癌细胞和组织等)进行直接高效的检测成为研究的热点和重点。虽然各种新方法为前列腺癌的早期诊断及术后的监测提供了重要的参考依据,但是仍需通过进一步的长期随机筛查研究来证实其在前列腺诊断中的实用性。此外,需加强对纳米生物传感技术的应用研究,使其早日成为能真正运用于医疗实践和解决实际问题的成熟技术。
1 Siegel R,Naishadham D,Jemal A.Cancer statistics,2012[J].CA Cancer J Clin,2012,62(1):10-29.
2 Porkka KP,Pfeiffer MJ,Waltering KK,et al.MicroRNA Expression Profiling in Prostate Cancer[J].Cancer Res,2007,67(13):6130-6135.
3 Song S,Xu H,Fan CH.Potential diagnostic applications of biosensors:current and future directions[J].Int J Nanomed,2006,1(4):433-440.
4 Lin M,Pei H,Yang F,et al.Applications of Gold Nanoparticles in the Detection and Identification of Infectious Diseases and Biothreats[J].Adv Mater,2013,25(25):3490-3496.
5 Nam JM,Thaxton CS,Mirkin CA.Nanoparticle-Based Bio-Bar Codes for the Ultrasensitive Detection of Proteins[J].Science,2003,301(5641):1884-1886.
6 Stoeva SI,Lee JS,Smith JE,et al.Multiplexed Detection of Protein Cancer Markers with Biobarcoded Nanoparticle Probes[J].J Am Chem Soc,2006,128(26):8378-8379.
7 Thaxton CS,Elghanian R,Thomas AD,et al.Nanoparticle-based bio-barcode assay redefines"undetectable"PSA and biochemical recurrence after radical prostatectomy[J].Pro Natl Acad Sci U S A,2009,106(44):18437-18442.
8 Yan J,Song SP,Li B,et al.An On-Nanoparticle Rolling-Circle Amplification Platform for Ultrasensitive Protein Detection in Biological Fluids[J].Small,2010,6(22):2520-2525.
9 Yu X,Munge B,Patel V,et al.Carbon Nanotube Amplification Strategies for Highly Sensitive Immunodetection of Cancer Biomarkers[J].J Am Chem Soc,2006,128(34):11199-11205.
10 Wan Y,Deng WP,Su Y,et al.Carbon nanotube-based ultrasensitive multiplexing electrochemical immunosensor for cancer biomarkers[J].Biosens Bioelectron,2011,30(1):93-99.
11 Zhao B,Yan J,Wang D,et al.Carbon Nanotubes Multifunctionalized by Rolling Circle Amplification and Their Application for Highly Sensitive Detection of Cancer Markers[J].Small,2013,9(15):2595-2601.
12 Yang M,Javadi A,Li H,et al.Ultrasensitive immunosensor for the detection of cancer biomarker based on graphene sheet[J].Biosens Bioelectron,2010,26(2):560-565.
13 Kerman K,Endo T,Tsukamoto M,et al.Quantum dot-based immunosensor for the detection of prostate-specific antigen using fluorescence microscopy[J].Talanta,2007,71(4):1494-1499.
14 Yang J,Dave SR,Gao X.Quantum Dot Nanobarcodes:Epitaxial Assembly of Nanoparticle-Polymer Complexes in Homogeneous Solution[J].J Am Chem Soc,2008,130(15):5286-5292.
15 Wegner KD,Jin Z,Lindén S,et al.Quantum-Dot-Based Förster Resonance Energy Transfer Immunoassay for Sensitive Clinical Diagnostics of Low-Volume Serum Samples[J].ACS Nano,2013,7(8):7411-7419.
16 Zheng G,Patolsky F,Cui Y,et al.Multiplexed electrical detection of cancer markers with nanowire sensor arrays[J].Nat Biotech,2005,23(10):1294-1301.
17 Huang YW,Wu CS,Chuang CK,et al.Real-Time and Label-Free Detection of the Prostate-Specific Antigen in Human Serum by a Polycrystalline Silicon Nanowire Field-Effect Transistor Biosensor[J].Anal Chem,2013,85(16):7912-7918.
18 Kim DJ,Sohn IY,Jung JH,et al.Reduced graphene oxide field-effect transistor for label-free femtomolar protein detection[J].Biosens Bioelectron,2013,41:621-626.
19 Wu G,Datar RH,Hansen KM,et al.Bioassay of prostate-specific antigen(PSA)using microcantilevers[J].Nat Biotech,2001,19(9):856-860.
20 Yue M,Stachowiak JC,Lin H,et al.Label-Free Protein Recognition Two-Dimensional Array Using Nanomechanical Sensors[J].Nano Lett,2008,8(2):520-524.
21 Rodríguez-Lorenzo L,de la Rica R,Álvarez-Puebla RA,et al.Plasmonic nanosensors with inverse sensitivity by means of enzyme-guided crystal growth[J].Nature Mater,2012,11(7):604-607.
22 Wen YL,Pei H,Shen Y,et al.DNA Nanostructure-based Interfacial engineering for PCR-free ultrasensitive electrochemical analysis of microRNA,2012[J].Sci Rep,2013,2:1-7.
23 Wen YQ,Xu Y,Mao XH,et al.DNAzyme-Based Rolling-Circle Amplification DNA Machine for Ultrasensitive Analysis of MicroRNA in Drosophila Larva[J].Anal Chem,2012,84(18):7664-7669.
(2013-10-16收稿)(2013-11-04修回)
Nano-biosensors for detecting prostate cancer biomarkers
Bin ZHAO,Zhenhua LI,Shiping SONG,Chunhai FAN
Chunhai FAN;E-mail:fchh@sinap.ac.cn
Laboratory of Physical Biology,Shanghai Institute ofApplied Physics,ChineseAcademy of Sciences,Shanghai 201800,China.
Nano-biosensors have elicited considerable scientific interest in various research areas,including nanotechnology,biotechnology,microelectronics,and analytical techniques.The development of nanomaterials and nanotechnology has produced nano-biosensors with increasing potential applications in disease diagnosis.Prostate cancer is a malignant tumor that seriously threatens the health human males worldwide.Detecting the low-abundance biomarkers of prostate cancer is critical for its early diagnosis,treatment monitoring,and evaluation of its postsurgical recurrence.This review focuses on the research progress in nano-biosensing technology and its application in the detection of prostate cancer biomarkers.
nanobiosensor,prostate cancer biomarker,detection,early diagnosis
10.3969/j.issn.1000-8179.20131760
中国科学院上海应用物理研究所物理生物学实验室(上海市201800)
*本文课题受科技部重大科学研究计划项目(编号:2012CB932600)资助
樊春海 fchh@sinap.ac.cn
This work was supported by Ministry of Science and Technology,Major Scientific Research Program of China(No.2012CB932600).
(本文编辑:周晓颖)

