功能纳米材料在肿瘤光学治疗中的应用*
程亮汪超刘庄
功能纳米材料在肿瘤光学治疗中的应用*
程亮汪超刘庄

刘庄 教授,现为苏州大学功能纳米与软物质研究院博士生导师。2004年北京大学化学与分子工程学院获理学学士学位,2008年美国斯坦福大学获得化学博士学位,研究方向为纳米生物材料与肿瘤纳米技术,较系统地探索了包括碳纳米材料、稀土发光纳米晶、有机纳米颗粒、光磁复合纳米材料等在内的多种功能纳米材料在生物影像、药物输送和癌症光学治疗等方面的应用,并对其生物学效应进行了研究。2005年以来发表学术论文100余篇,其中2009年在苏州大学独立建立课题组后发表通信作者论文60余篇,论文他引超过8 000次,SCI'H-index'为42。目前主持的主要项目包括国家自然科学基金委优秀青年基金(编号:51222203),科技部973项目课题(编号:2012CB932601)和江苏省杰出青年基金(编号:BK20130005)。
目前在癌症的治疗中,药物化疗和手术对正常的组织易产生一定程度的损伤,且治疗效果有较大局限。肿瘤光学治疗主要采用近红外光有选择性地杀死肿瘤细胞,不会对正常的组织造成明显的不良作用。随着纳米材料和纳米科技的发展,肿瘤光学治疗如光热治疗、光动力治疗和光促进联合治疗等得到了快速的发展。本综述总结了近年来功能纳米材料在肿瘤光学治疗应用中的最新进展。
肿瘤光学治疗 纳米材料 光热治疗 光动力治疗
癌症已经成为21世纪威胁人类健康的最大问题之一,目前常用的治疗方式主要集中于手术治疗、化学药物治疗和放射性治疗。然而手术治疗很难去除体内所有的癌细胞,化学治疗和放射治疗会给正常的组织带来不良反应,且容易诱发癌细胞的抗药性[1]。光学治疗通常采用近红外光作为光源,具有很强的组织穿透能力,不会对正常的组织造成损伤。目前基于光学的疗法主要分为两种类型,即光热治疗和光动力治疗。光热治疗主要是具有光吸收能力的物质在激光的照射下产生热量而杀死肿瘤细胞。光动力治疗主要是利用光敏分子在光照条件下产生单线态氧或活性氧自由基,从而杀死肿瘤细胞[2]。纳米材料和纳米科技的发展进一步为光敏分子在光动力治疗中提供了药物载体,并赋予其一些新的功能。本文主要综述功能纳米材料在肿瘤光学治疗中的应用和发展。
1 光热治疗
1.1 无机纳米材料用于光热治疗
常用于光热治疗的无机纳米材料(表1)。
1.1.1 金基纳米材料用于光热治疗 近年来,金纳米材料在生物检测、生物成像和生物治疗中得到了广泛的应用。大部分应用主要是基于金纳米结构的等离子体共振,通过调控金纳米材料的尺寸和形态可以改变金纳米材料的光学性质。常见的有金纳米棒、金纳米壳、金纳米笼、金纳米星等。2006年Huang等[3]最早将金纳米棒应用于细胞成像和治疗,取得了很好的治疗效果。同时在活体水平上,EI-sayed课题组[4]将聚乙二醇修饰的金纳米棒通过尾静脉注射到小鼠体内,在808 nm近红外激光的照射下,肿瘤的抑制生长率达到57%,而对照组肿瘤持续生长。许多课题组将金纳米棒应用于肿瘤光热治疗中,并取得了很好的治疗效果。2002年,夏幼南教授课题组[5]采用一种简单的化学置换的方法合成金纳米笼状结构(图1),该结构的金在近红外区具有很好的等离子体吸收。同时将anti-HER-2抗体修饰在金纳米笼表面,在脉冲激光的照射下,5 min内取得了很好的靶向光热治疗效果。同时将聚乙二醇修饰在金纳米笼表面,尾静脉注射到小鼠体内,3天后,在连续激光(808 nm,0.7 W/cm2,10 min)照射下,肿瘤区域的温度升高到50℃,从而达到治疗目的。金纳米星结构是由金纳米球表面连接一些金纳米针所构成,在近红外区具有很好的吸收,同样也用于肿瘤光热治疗[6]。Yuan等[7]最近采用人类免疫缺陷病毒1型(TAT)-短肽修饰的金纳米星用于靶向的光热治疗,在较低的激光功率下(808 nm,0.2 W/cm2),对乳腺癌细胞(BT549)进行很好的杀灭。金纳米壳层结构由于在近红外区具有很好的吸收,同样被广泛应用在光学成像和光热治疗中[8]。2003年Dolmans等[2]最早将anti-HER-2抗体修饰在纳米壳层上用于SKBR3细胞的暗场模式成像和光热治疗,之后进一步用于光学相干断层扫描成像和光声成像。最近他领导的小组已经将金纳米壳层应用于二期临床前期。同时,基于金纳米壳层的功能复合纳米材料也可用于成像模式指导下的光热治疗。Kim等[9]通过化学金晶种生长的方法合成Fe3O4@Au核壳层结构,用于磁共振成像和光热治疗。Zhou等[10]采用同样的策略合成了Fe3O4@hybrid@Au壳层和Au纳米壳层@Fe3O4@Si@Si壳层两种不同结构的功能复合纳米材料,并将其利用于成像模式指导下的光热治疗。稀土掺杂的上转换纳米材料由于具有近红外区激发、没有背景荧光干扰、光学性质稳定等性能而被广泛应用在纳米生物医学中。本课题组采用上转换纳米材料为基底,在其表面吸附上磁性纳米颗粒,然后在其表面原位生长出金的壳层,从而应用于细胞和活体上平上磁靶向作用下的成像模式指导的光热治疗(图 2)[11]。
1.1.2 碳基纳米材料用于光热治疗 碳基材料,如富勒烯、碳纳米管和石墨烯,近年来在生物医学中得到快速的发展,同样在肿瘤光热治疗中得到广泛的应用。2005年,斯坦福戴宏杰课题组[12]采用DNA修饰的碳纳米管用于细胞水平上的光热治疗。之后,许多课题组开始研究不同的靶向分子修饰的碳纳米管用于细胞和活体光热治疗。石墨烯是二维的纳米碳结构,在纳米生物医学中得到了广泛的应用[13]。由于其在近红外区具有很好的光学吸收,因此也可用于光热治疗。2010年本课题组第一次研究了聚乙二醇修饰的氧化石墨烯在活体水平上的光热治疗(图3)[14]。之后,其他的研究小组展开纳米石墨烯在体内和体外的光学治疗实验。为了提高治疗效果,氧化石墨烯可以进一步被还原成还原石墨烯,其在近红外的吸光度比氧化石墨烯提高近7~8倍[15]。同样经过聚乙二醇修饰之后,通过尾静脉注射到小鼠体内实现超低功率下的光热治疗(0.15 W/cm2)[16]。另外,碳基纳米材料可以和其他无机纳米材料复合并应用在光热治疗中。本课题组将Au修饰在碳纳米管的表面,实现表面增强拉曼与光热治疗结合[17];将磁性纳米颗粒Fe3O4修饰在石墨烯的表面,实现磁共振成像模式指导下的光热治疗[18]。台湾清华大学陈三元课题组将量子点QDs修饰在石墨烯的表面,实现荧光成像与光热治疗结合[19]。
1.1.3 其他无机纳米材料 除了金基、碳基纳米材料外,其他的无机纳米材料在近红外区具有很好的光学吸收也可以用于光热治疗。2009年厦门大学郑南峰课题组利用一氧化碳作为表面控制试剂合成了“钯蓝”[20],在近红外区具有很好的光学吸收,在激光照射下对QGY-7703人肝癌细胞具有很好的光热治疗效果(图4)。为了促进其进入细胞的能力,他们又发展了Pd@SiO2、Pd@Ag和Pd@Ag@SiO2等钯基纳米材料用于光热治疗[10],都取得了良好的治疗效果。

表1 常用的无机纳米材料用于光热治疗Table 1 Use of common inorganic nanomaterials for photothermal therapy

▶图1 A.Au纳米笼(45 nm长×3.5 nm厚度)的激发、吸收和散射光谱图。B.Ag纳米立方块的SEM图。C.Ag纳米立方块和不同浓度的HAuCl4刻蚀的紫外吸收图(归一化)。D.Ag纳米立方块和HAuCl4刻蚀后的Au纳米笼的SEM图Figure 1 A.Extinction(Cext),absorption(Cabs),and scattering(Csca)cross-sections(note that Cext=Cabs+Csca)were calculated using the DDA method for a gold nanocage of 45 nm in edge length and 3.5 nm in wall thickness.B.SEM images of Ag nanocubes prepared by sulfide-mediated polyol synthesis.C.Normalized vis-NIR extinction spectra recorded from aqueous suspensions of nanostructures after titrating Ag nanocubes with different amounts of a HAuCl4 aqueous solution.D.SEM image of Au nanocages prepared by refluxing an aqueous solution containing both silver nanocubes and HAuCl4.(Copyright from American Chemical Society,2007)

图2 功能复合纳米材料用于成像模式指导下的光热治疗Figure 2 Multifunctional composite nanoparticles used for imaging-guided cancer therapy
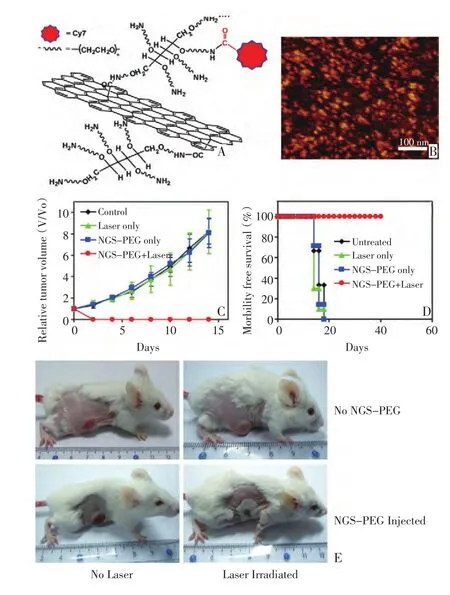
图3 A.PEG修饰石墨烯的结构示意图并在其表面标记荧光染料Cy7。B.PEG修饰石墨烯的AFM照片。C-E.PEG修饰的石墨烯在活体水平上的光热治疗。C.不同组的肿瘤生长曲线。D.不同组的小鼠的存活曲线。E.经过不同方式处理小鼠的照片Figure 3 A.Scheme of a nano-graphene sheet(NGS)with PEG functionalization and Cy7 labeling.B.AFM image.C-E.In vivophotothermal therapy study using intravenously injected NGS-PEG.C.Tumor growth curves of different groups after various treatments indicated.D.Survival curves of mice bearing 4T1 tumor after various treatments indicated.E.Representative photos of tumors on mice after various treatments indicated.(Copyright from American Chemical Society,2010)
硫化铜(CuS)是最近几年发展的新型的光热治疗试剂。Li等[21]首次报道了CuS纳米颗粒在近红外区具有很好的光学吸收并用于光热治疗。为了进一步提高其光热转换效率,东华大学胡俊杰教授课题组合成了不同尺寸大小花状的CuS纳米片,在低功率的近红外激光照射下,对肿瘤细胞具有很好的杀伤作用[22]。最近他们课题组还合成了Fe3O4@Cu2-xS核壳功能复合纳米材料,用于磁共振成像和光热治疗[23]。
另外,拓扑绝缘体与石墨烯类似,属于层状化合物,具有特殊的物理和化学性质,同样在生物医学中得到进一步的广泛应用[24]。最近Chou等[25]首次报道硫化钼(MoS2)纳米片作为一种新的光热治疗试剂。Chen等将表面经过修饰的硒化铋(Bi2Se3)纳米片进行活体水平上的CT成像和光热治疗。

图4 A.合成的Pd纳米片分散在乙醇中。B.合成的Pd纳米片的HRTEM照片。C.成的Pd纳米片的SAED照片。D.合成的Pd纳米片垂直于铜网的TEM照片Figure 4 A.TEM image of the palladium nanosheets.Inset:photograph of an ethanol dispersion of the as-prepared palladium nanosheets in a cuvette.B.HRTEM image of a palladium nanosheet flat lying on the TEM grid.C.SAED pattern of a single palladium nanosheet(shown in the inset).D.TEM image of the assembly of palladium nanosheets perpendicular to the TEM grid.(Copyright from NPG,2009)
1.2 有机纳米材料用于光热治疗
常用于光热治疗的有机纳米材料(表2)。
1.2.1 近红外染料用于光热治疗 吲哚青绿(ICG)是美国食品药品监督管理局(FDA)所批准用于临床的药物,广泛应用在纳米生物医学中,同样在光热治疗中也发挥巨大的优势[26]。Yu等[27]将anti-EGFR偶联在ICG表面并实现了对1 483癌细胞很好的光热治疗效果。Zheng等[28]设计了磷脂聚乙二醇(PL-PEG)修饰的ICG分子,并在其表面偶联上叶酸(FA)和整合素RGD双重靶向分子,实现了对U87肿瘤细胞很好的光热治疗。与ICG分子类似,七甲吲哚菁染料在近红外区也具有吸收高、量子产率低的特点,因此也可以用于光热治疗。最近,本课题组合成了吲哚菁染料IR-825分子[29],并在其表面修饰上两亲性高分子,形成纳米胶束IR825-PEG,使其具有很好的水溶性和生物相容性(图5)。通过尾静脉注射到小鼠体内,在肿瘤区域具有很高的富集能力,并在近红外激光808 nm照射下,肿瘤完全杀灭。
1.2.2 共轭高分子纳米材料用于光热治疗 共轭高分子纳米材料广泛用于物理器件中。由于其在近红外具有很好的光学吸收,最近也被用于纳米生物医学中。Yang等[30]首次报道聚苯胺聚合物在808 nm激光作用下可以杀死肿瘤细胞。本课题组采用简单的化学方法合成聚吡咯分子,在细胞和活体水平上研究其光热治疗效果[10]。通过瘤内注射的方式将聚吡咯注射到小鼠体内,在极低的功率下(808 nm,0.25 W/cm2),达到100%消除肿瘤的目的。本课题组又报道了另外一种共轭高分子纳米材料PEDOT:PSS经过表面修饰后通过尾静脉注射后在肿瘤区域富集并在激光照射下肿瘤完全消灭(图6)[31]。另外,Mac-Neill等[32]也报道了低带隙的给体-受体电子空穴的导电高分子ECP用于细胞水平上的光热治疗。
1.3 其他有机纳米材料
加拿大多伦多大学郑钢教授课题组采用磷脂包裹的卟啉有机纳米高分子最早用于光热治疗[33],同时由于其在体内能够降解,在纳米生物医学中的得到广泛的应用。最近他们课题组系统研究磷脂包裹的卟啉环结构在活体水平上的光热和光动力治疗[34]。另外,Fu等[35]合成了普鲁士蓝纳米粒子,在近红外区具有很好的光学吸收和光学热稳定性,在细胞水平上取得了很好的光热治疗效果。Liu等[36]采用简单的化学方法合成的多巴胺包裹的黑色素有机纳米粒子同样在近红外区具有很好的光学吸收。其主要的优点是在生物体内可以降解,并具有很好的光热转换效率,且在活体水平上取得了很好的光热治疗效果。
表2 常用的有机纳米材料用于光热治疗Table 2 Use of common organic nanomaterials for photothermal therapy

图5 PEG修饰的IR825有机小分子纳米颗粒用于活体水平上的光热治疗Figure 5 IR825-PEG nanoparticles used forin vivophotothermal therapy.(Copyright from Willy,2013)
2 光动力治疗
光动力治疗主要是选用一些光敏分子,在光照射下产生活性氧自由基来杀死肿瘤细胞。而传统的光敏分子由于其亲水性差、容易聚集,限制了其在生物医学方面的应用,因此也需要对其表面进行合适的化学修饰,使其具有更好的水溶性和生物相容性。纳米材料的发展,为光敏分子提供新的药物载体,许多无机纳米材料应用在光动力治疗中(表3)。
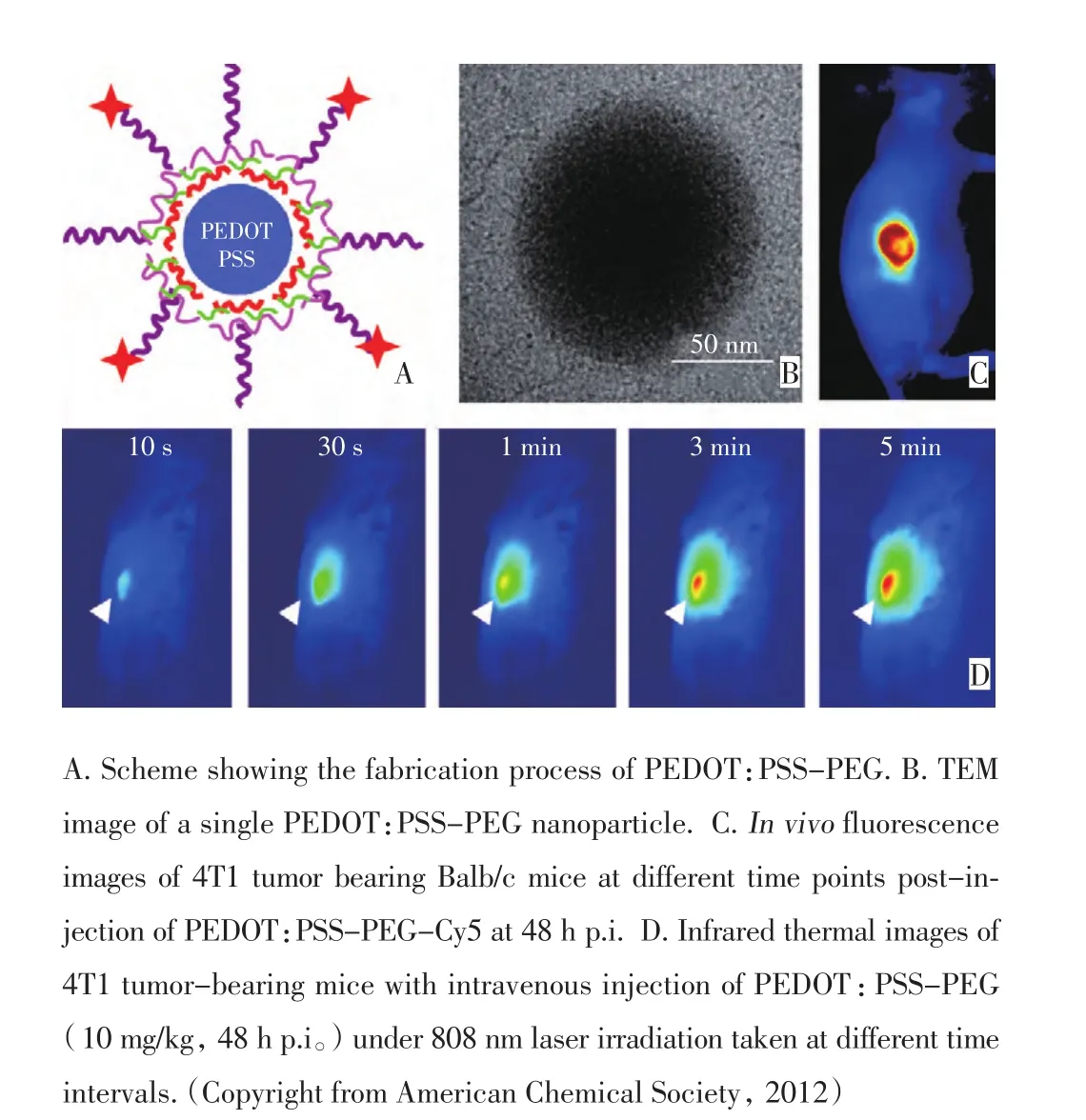
图6 PEG修饰的PEDOT:PSS导电高分子纳米材料用于活体水平上的光热治疗Figure 6 PEDOT:PSS-PEG conductive polymers used forin vivophotothermal therapy

表3 常用的功能纳米材料用于光动力治疗Table 3 Use of common functional nanomaterials for photothermal therapy
2.1 碳基纳米材料用于光动力治疗
碳基纳米材料由于具有巨大的比表面积,在药物装载方面具有很大的优势。富勒烯是由60个碳组成的足球结构,可吸收可见光并产生活性氧自由基,从而可以应用在光动力治疗中。Yang等[37]报道了富勒烯及其衍生物用于HeLa宫颈癌细胞的光动力治疗。碳纳米管是一维的碳材料结构,同样可以作为光动力治疗的药物载体[38]。石墨烯是二维的碳材料结构,具有特殊的物理和化学性质。Dong等[39]首先报道了基于石墨烯的光动力治疗。本课题组同样也报道了将光敏试剂二氢卟吩(Ce6)吸附在石墨烯的表面(图7),实现光热促进光动力治疗的效果[40]。
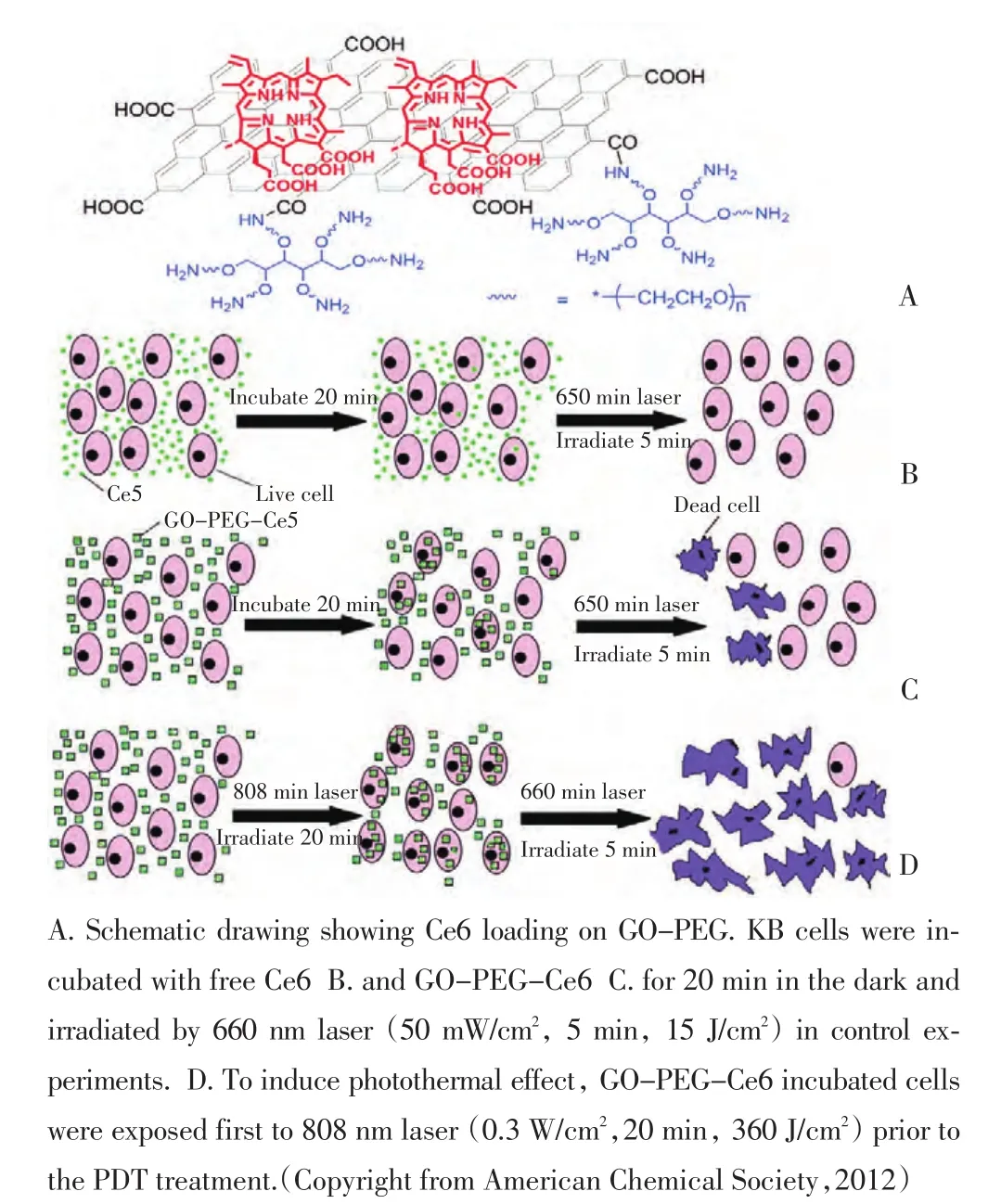
图7 基于石墨烯的光热促进光动力治疗的示意图Figure 7 Schemes of the experimental design in photothermally enhanced photodynamic therapy
2.2 其他无机纳米材料用于光动力治疗
二氧化硅材料具有很好的生物相容性,被广泛应用在纳米生物医学中[41]。在2003年,Yan等[42]就开展了二氧化硅包裹亚甲基蓝纳米粒子用于光动力治疗的实验。最近研究的重点主要是赋予硅其他的功能,实现成像与治疗一体化。一些贵金属材料如金、银、铂等纳米材料也可以用作光敏试剂的载体实现光动力治疗[43]。最近Cheng等[44]合成了酞菁(PC4)装载在聚乙二醇修饰的金纳米颗粒表面,实现高效的药物装载和光动力治疗。同时,金材料本身具有很好的等离子吸收,也可以较好地实现光热治疗。磁性纳米颗粒如四氧化三铁在磁共振成像方面具有很好的造影效果也被广泛应用在药物装载实验中。许多课题组都巧妙设计了不同结构的四氧化三铁复合纳米结构并用于光动力治疗实验中。上海交通大学崔大祥教授课题组同时实现了磁靶向作用下的光动力治疗和荧光-磁共振双模态作用下的成像[45]。另外一些量子点同样可以作为载体实现成像和光动力治疗相结合[46]。
2.3 上转换纳米材料用于光动力治疗
上述的光动力治疗所面临的最大问题是采用紫外或可见光做为辐照光源,其组织穿透能力差限制其在光动力治疗方面的应用。而上转换发光纳米材料主要采用近红外激光激发,其组织穿透能力大大提高。并且由于其发光性质稳定、无背景荧光的干扰的优点,大大提高了其在纳米生物医学方面的应用[10]。许多课题组开展了以上转换纳米材料(UCNPs)为基底的光动力治疗。本课题组采用光敏分子Ce6物理吸附在高分子修饰的上转换纳米材料的表面,首次在活体水平上实现了光动力治疗效果(图8)[47]。在最近的一篇工作中,Idris等[48]采用二氧化硅包裹上转换纳米颗粒,然后将两种光敏分子ZnPc和花菁素540共同吸附在介孔硅球表面,在活体水平上实现了很好的协同光动力治疗效果。正是由于上转换纳米材料独特的优势,在光动力治疗和生物成像等方面具有很好的发展前景。

图8 基于上转换纳米材料的肿瘤光动力治疗Figure 8 Photodynamic therapy based on UCNPs
3 结论与展望
本文系统总结了功能纳米材料在光学治疗中的应用,包括光热治疗光动力治疗,以及功能纳米材料在光控下的联合治疗。这些功能纳米材料及新型的治疗方式在纳米生物医学中将发挥重要的作用,部分的功能纳米材料已经在临床中开展研究。虽然纳米材料为肿瘤的光学治疗提供了新的途径并取得了长足的发展,但是还有一些问题和挑战需要我们去解决和面对,同时也有很多机遇值得我们把握:纳米材料的生物安全性。无机纳米材料在体内较难降解的问题对其将来临床应用而言是一个巨大的调整,因此需要发展生物可降解的安全的纳米材料应用于新型的光学治疗,此外纳米材料的体积和表面修饰需要进一步的调整以优化其在体内的行为。
发展新的仪器提高光学治疗的穿透性。光学治疗中最大的限制是光组织穿透能力的局限,哪怕近红外光的穿透能力仍然有限。因此,将来临床肿瘤治疗中光学治疗的进一步发展必须结合新型介入治疗医疗器械的发展,这样的器械需要能有效地将光导入深部肿瘤病灶,实现均匀照射,并在照射探头中整合成像功能以实时监控治疗的过程(如组织温度等)。
发展多功能复合纳米材料实现诊疗一体化。诊疗一体化在光学治疗中尤为重要。由于光疗试剂(如纳米材料)在肿瘤的富集量随时间会发生较大变化,如何判断治疗的最佳时机(光疗试剂在肿瘤部分富集达到峰值时)显得尤为重要。此外,治疗过程的实时监控和治疗后的疗效判断也需要成像的功能。因此通过化学方法将不同功能的材料有机结合在一起以发展成像模式指导下的肿瘤光学治疗很可能将是该领域发展的一个重要方向。
发展肿瘤联合治疗。尽管肿瘤光学治疗具有许多优势,但未来的临床应用中很可能光学治疗会作为一种辅助治疗出现(如手术后的治疗等)。如何将新型的光学治疗和传统的治疗方式(手术、化疗、放疗)相结合,实现1+1>2的协同效应,以提高肿瘤治愈的可行性并防止转移复发,将为未来肿瘤治疗新方法的发展带来巨大的机遇。
1 Peer D,Karp JM,Hong S,et al.Nanocarriers as an emerging platform for cancer therapy[J].Nat Nanotechnol,2007,2(12):751-760.
2 Dolmans D,Fukumura D,Jain RK.Photodynamic therapy for cancer[J].Nat Rev Cancer,2003,3(5):380-387.
3 Huang X,El-Sayed IH,Qian W,et al.Cancer Cell Imaging and Photothermal Therapy in the Near-Infrared Region by Using Gold Nanorods[J].J Am Chem Soc,2006,128(6):2115-2120.
4 Dickerson EB,Dreaden EC,Huang X,et al.Gold nanorod assisted near-infrared plasmonic photothermal therapy(PPTT)of squamous cell carcinoma in mice[J].Cancer Lett,2008,269(1):57-66.
5 Skralak SE,Chen J,Sun Y,et al.Gold Nanocages:Synthesis,Properties,and Applications[J].Accounts Chem Res,2008,41(12):1587-1595.
6 Chen J,Glaus C,Laforest R,et al.Gold nanocages as photothermal transducers for cancer treatment[J].Small,2010,6(7):811-817.
7 Yuan H,Khoury CG,Wilson CM,et al.In vivo particle tracking and photothermal ablation using plasmon-resonant gold nanostars[J].Nanomedicine,2012,8(8):1355-1363.
8 Fekrazad R,Hakimiha N,Farokhi,E,et al.Treatment of oral squamous cell carcinoma using anti-HER2 immunonanoshells[J].Int J Nanomedicine,2011,6:2749-2755.
9 Kim J,Park S,Lee JE,et al.Designed Fabrication of Multifunctional Magnetic Gold Nanoshells and Their Application to Magnetic Resonance Imaging and Photothermal Therapy[J].Angew Chem Int Ed,2006,118(46):7918-7922.
10 Zhou J,Liu Z,Li F.Upconversion nanophosphors for small-animal imaging[J].Chem Soc Rev,2012,41(3):1323-1349.
11 Cheng L,Yang K,Li YG,et al.Multifunctional nanoparticles for upconversion luminescence/MR multimodal imaging and magnetically targeted photothermal therapy[J].Biomaterials,2012,33(7):2215-2222.
12 Liu X,Tao H,Yang K,et al.Optimization of surface chemistry on single-walled carbon nanotubes for in vivo photothermal ablation of tumors[J].Biomaterials,2011,32(1):144-151.
13 Allen MJ,Tung VC,Kaner RB,Honeycomb carbon:a review of graphene[J].Chem Rev,2009,110(1):132-145.
14 Yang K,Zhang S,Zhang G,et al.Graphene in Mice:Ultrahigh In Vivo Tumor Uptake and Efficient Photothermal Therapy[J].Nano Lett,2010,10(9):3318-3323.
15 Robinson JT,Tabakman SM,Liang Y,et al.Ultrasmall Reduced Graphene Oxide with High Near-Infrared Absorbance for Photothermal Therapy[J].J Am Chem Soc,2011,133(17):6825-6831.
16 Yang K,Wan J,Zhang S,et al.The influence of surface chemistry and particle size of nanoscale graphene oxide on photothermal therapy of cancer using ultra-low laser power[J].Biomatreials,2012,33(7):2206-2214.
17 Wang X,Wang C,Cheng L,et al.Noble Metal Coated Single-Walled Carbon Nanotubes for Applications in Surface Enhanced Raman Scattering Imaging and Photothermal Therapy[J].J Am Chem Soc,2012,134(17):7414-7422.
18 Yang K,Hu L,Ma X,et al.Multimodal Imaging Guided Photothermal Therapy using Functionalized Graphene Nanosheets Anchored with Magnetic Nanoparticles[J].Adv Mater,2012,24 (14):1868-1872.
19 Hu SH,Chen YW,Hung WT,et al.Quantum-Dot-Tagged Reduced Graphene Oxide Nanocomposites for Bright Fluorescence Bioimaging and Photothermal Therapy Monitored In Situ[J].Adv Mater,2012,24(13):1748-1754.
20 Huang X,Tang S,Mu X,et al.Freestanding palladium nanosheets with plasmonic and catalytic properties[J].Nat Nanotechnol,2011,6(1):28-32.
21 Li Y,Lu W,Huang Q,et al.Copper sulfide nanoparticles for photothermal ablation of tumor cells[J].Nanomedicine,2010,5(8):1161-1171.
22 Tian Q,Tang M,Sun Y,et al.,Hydrophilic Flower-Like CuS Superstructures as an Efficient 980 nm Laser-Driven Photothermal Agent for Ablation of Cancer Cells[J].Adv Mater,2011,23(31):3542-3547.
23 Tian Q,Hu J,Zhu Y,et al.Sub-10 nm Fe3O4@Cu2-xS Core-shell Nanoparticles for Dual-modal Imaging and Photothermal Therapy[J].J Am Chem Soc,2013,135(23):8571-8577.
24 Huang X,Zeng Z,Zhang H.Metal dichalcogenide nanosheets:preparation,properties and applications[J].Chem Soc Rev,2013,42(5):1934-1946.
25 Chou SS,Kaehr B,Kim J,et al.Chemically Exfoliated MoS2 as Near-Infrared Photothermal Agents[J].Angew Chem Int Ed,2013,52(5):4160-4164.
26 Kim JW,Galanzha EI,Shashkov EV,et al.Golden carbon nanotubes as multimodal photoacoustic and photothermal high-contrast molecular agents[J].Nat Nanotechnol,2009,4(10):688-694.
27 Yu J,Javier D,Yaseen MA,et al.Self-Assembly Synthesis,Tumor Cell Targeting,and Photothermal Capabilities of Antibody-Coated Indocyanine Green Nanocapsules[J].J Am Chem Soc,2010,132(6):1929-1938.
28 Zheng X,Xing D,Zhou F,et al.Indocyanine green-containing nanostructure as near infrared dual-functional targeting probes for optical imaging and photothermal therapy[J].Molecular Pharmaceutics,2011,8(2):447-456.
29 Cheng L,He W,Gong H,et al.PEGylated Micelle Nanoparticles Encapsulating a Non-Fluorescent Near-Infrared Organic Dye as a Safe and Highly-Effective Photothermal Agent for In Vivo Cancer Therapy[J].Adv Funct Mater,2013,doi:10.1002/adfm.201301045.
30 Yang J,Choi J,Bang D,et al.Convertible Organic Nanoparticles for Near-Infrared Photothermal Ablation of Cancer Cells[J].Angew Chem Int Ed,2011,50(2):441-444.
31 Cheng L,Yang K,Chen Q,et al.Organic Stealth Nanoparticles for Highly Effective in Vivo Near-Infrared Photothermal Therapy of Cancer[J].ACS nano,2012,6(6):5605-5613.
32 MacNeill CM,Coffin RC,Carroll DL,et al.Low Band Gap Donor-Acceptor Conjugated Polymer Nanoparticles and their NIR-mediated Thermal Ablation of Cancer Cells[J].Macromolecular Bioscience,2013,13(1):28-34.
33 Lovell JF,Jin CS,Huynh E,et al.Porphysome nanovesicles generated by porphyrin bilayers for use as multimodal biophotonic contrast agents[J].Nat Mater,2011,10(4):324-332.
34 Jin CS,Lovell JF,Chen J,et al.Ablation of Hypoxic Tumors with Dose-Equivalent Photothermal,but Not Photodynamic,Therapy Using a Nanostructured Porphyrin Assembly[J].ACS Nano,2013,7(3):2541-2550.
35 Fu G,Liu W,Feng S,et al.Prussian blue nanoparticles operate as a new generation of photothermal ablation agents for cancer therapy[J].Chem Comm,2012,48(94):11567-11569.
36 Liu Y,Ai K,Liu J,et al.Dopamine-Melanin Colloidal Nanospheres:An Efficient Near-Infrared Photothermal Therapeutic Agent for In Vivo Cancer Therapy[J].Adv Mater,2013,25(9):1353-1359.
37 Yang XL,Fan CH,Zhu HS.Photo-induced cytotoxicity of malonic acid[C60]fullerene derivatives and its mechanism[J].Toxicology in vitro,2002,16(1):41-46.
38 Erbas S,Gorgulu A,Kocakusakogullari M,et al.Non-covalent functionalized SWNTs as delivery agents for novel Bodipy-based potential PDT sensitizers[J].Chem Comm,2009,(33):4956-4958.
39 Dong H,Zhao Z,Wen H,et al.Poly(ethylene glycol)conjugated nano-graphene oxide for photodynamic therapy[J].Sci China Chem,2010,53(11):2265-2271.
40 Tian B,Wang C,Zhang S,et al.Photothermally Enhanced Photodynamic Therapy Delivered by Nano-Graphene Oxide[J].ACS Nano,2011,5(9):7000-7009.
41 Tang F,Li L,Chen D.Mesoporous silica nanoparticles:synthesis,biocompatibility and drug delivery[J].Adv Mater,2012,24(12):1504-1534.
42 Yan F,Kopelman R.The Embedding of Meta-tetra(Hydroxyphenyl)-Chlorin into Silica Nanoparticle Platforms for Photodynamic Therapy and Their Singlet Oxygen Production and pH-dependent Optical Properties[J].Photochemistry and Photobiology,2003,78(6):587-591.
43 Vankayala R,Sagadevan A,Vijayaraghavan P,et al.Metal Nanoparticles Sensitize the Formation of Singlet Oxygen[J].Angew Chem Int Ed,2011,50(45):10640-10644.
44 Cheng Y,C Samia A,Meyers JD,et al.Highly Efficient Drug Delivery with Gold Nanoparticle Vectors for in Vivo Photodynamic Therapy ofCancer[J].JAm Chem Soc,2008,130 (32):10643-10647.
45 Huang P,Li Z,Lin J,et al.Photosensitizer-conjugated magnetic nanoparticles for in vivo simultaneous magnetofluorescent imaging and targeting therapy[J].Biomaterials,2011,32(13):3447-3458.
46 Gandra N,Chiu PL,Li W,et al.Photosensitized Singlet Oxygen Production upon Two-Photon Excitation of Single-Walled Carbon Nanotubes and Their Functionalized Analogues[J].J Phys Chem C Nanomater Inerfaces,2009,113(13):5182-5185.
47 Wang C,Tao H,Cheng L,et al.Near-infrared light induced in vivo photodynamictherapy ofcancerbased on upconversion nanoparticles[J].Biomaterials,2011,32(26):6145-6154.
48 Idris NM,Gnanasammandhan MK,Zhang J,et al.In vivo photodynamic therapy using upconversion nanoparticles as remote-controlled nanotransducers[J].Nat Med,2012,18(10):1580-1585.
(2013-09-28收稿)
(2013-10-31修回)
Functional nanomaterials for phototherapies of cancer
Liang CHENG,Chao WANG,Zhuang LIU
Zhuang LIU;E-mail:zliu@suda.edu.cn
Institute of Functional Nano&Soft Materials(FUNSOM)and Collaborative Innovation Center of Suzhou Nano Science and Technology,Soochow University,Suzhou 215123,China.
Current cancer therapies,including chemotherapies and radiotherapies,can induce toxic side effects to normal tissues with low specificity to cancer cells and usually have limited efficacy as results of drug resistance.Phototherapies kill cancer cells under irradiation of light,preferably near-infrared light with high tissue penetration,and would normally show little toxic effect in the dark.Over the past decade,nanomaterial-based phototherapies have made tremendous progress worldwide.These therapies show remarkable results against cancer in many preclinical studies.This study reviews the recent achievements in the use of functional nanomaterials for photothermal therapy,photodynamic therapy,and photo-controlled therapeutic platforms and discusses future prospects and challenges in this field.
phototherapy of cancer,nanomaterials,photothermal therapy,photodynamic therapy
10.3969/j.issn.1000-8179.20131829
苏州大学功能纳米与软物质研究院(江苏省苏州市215123)
*本文课题受国家自然科学基金项目(编号:51302180,51222203,51002100,51132006),国家973项目(编号:2011CB911002,2012CB932601)和江苏省自然科学基金(编号:BK20130005,BK20130305)资助
刘庄 zliu@suda.edu.cn
This work was supported by The National Natural Science Foundation of China(No.51302180,51222203,51002100,and 51132006),The National 973 Project(No.2011CB911002 and 2012CB932601),and The Natural Science Foundation of Jiangsu Province(No.BK20130005 and BK20130305).
(本文编辑:郑莉)

