基于量子点标记探针技术的肿瘤分子分型研究进展*
方 敏 彭春伟 陈 创 庞代文 李 雁
基于量子点标记探针技术的肿瘤分子分型研究进展*
方 敏①彭春伟①陈 创②庞代文③李 雁①

李雁 教授,医学博士,博士生导师,主任医师,现任武汉大学珞珈学者特聘教授,武汉大学肿瘤研究所所长,为教育部新世纪优秀人才支持计划及湖北省政府特殊津贴获得者。美国临床肿瘤学会会员,中国抗癌协会纳米肿瘤技术专业委员会常委,Biomaterials杂志(IF=7.882)副主编。主要从事消化道肿瘤的外科综合治疗,尤其是腹膜癌的综合治疗和基于纳米荧光探针技术的肿瘤微观分子影像学研究。主持国家自然科学基金重点项目和面上项目5项,承担国家重大科技专项2项。发表SCI论文88篇,影响因子累计超过280。科研成果获全国优秀博士论文(2004年),国家科技进步一等奖(2006年),美国临床肿瘤学会IDEA奖(2008年),湖北省科技进步一等奖(2011年)。
恶性肿瘤在分子水平上具有高度异质性,是个体化治疗的依据。发展同时显示肿瘤原位多分子指标的技术对研究肿瘤生物学行为至关重要。量子点标记探针技术因其具有独特的光学和化学特性,在肿瘤诊断、监测、治疗、发病机制、分子分型及异质性研究中均有广阔应用前景。本文总结该技术在肿瘤分子分型方面的应用进展。
量子点 肿瘤 分子分型 多色成像
肿瘤发生发展是一个多因素参与、多阶段渐进的过程,肿瘤异质性使不同个体对治疗反应迥异。因此,根据肿瘤不同生物学行为特征建立肿瘤分子分型,以此确定相应的肿瘤个体化治疗策略,是临床肿瘤学的重要发展方向[1]。
1 分子分型的概念及其意义
肿瘤分子分型(molecular classification)系采用高通量分子分析技术,根据分子遗传学或分子生物改变特征,使肿瘤的分类由主要依赖形态学转向以分子特征为基础的新分类系统[2];分子分型可不依赖于组织形态学鉴定,却可对后者进行有效补充。长期以来,组织病理学在肿瘤分型中一直处于主导地位,但临床实践日益显示,普通病理形态学已不能满足临床需要。以乳腺癌为例,以TNM分期系统为基础的分类体系,一直是乳腺癌综合治疗的主要依据[3]。该体系以病理形态学为基础,综合考虑肿瘤大小(T)、淋巴结状态(N)、有无远处转移(M),在一定程度上揭示了乳腺癌的生物学行为特征。尽管如此,临床实践表明同一病理类型、同一分期的恶性肿瘤患者,采用同一治疗方案,其疗效及预后可能有明显不同,说明该法尚不能全面展现乳腺癌发展演变过程中所蕴含的重要信息。个体化医疗为目前乳腺癌诊疗的主要方向,而准确的肿瘤分子分型对判断肿瘤组织学来源、鉴别组织学亚型、预测肿瘤复发转移风险、选择个体化治疗策略等均至关重要[4],迫切需要发展原位、定量、多分子同时分析技术,建立适应肿瘤个体化治疗需求的综合性分子分型体系。
2 量子点的物理特性及应用优势
分子成像技术是21世纪最重要的高新技术之一,基于纳米材料标记的分子探针技术在癌症诊断和治疗方面具有广阔的应用前景[5]。尤其是量子点(Quantum dots,QDs)标记分子探针技术在细胞分子成像及定量检测分析方面有显著优势[6]。量子点是一种直径在1~10 nm的半导体纳米晶粒。核(CdSe/CdS/CdTe)壳(ZnS)结构量子点可与一系列生物靶标包括蛋白质、抗体、核酸、亲和体等结合形成分子探针,与传统的荧光染料相比,具有以下优势:1)连续而宽的激发光谱,物理尺寸和组份比例可调性;2)可同时进行多色标记,检测灵敏度高;3)抗光漂白能力强;4)荧光强度高而稳定;5)生物相容性好,抗组织自发荧光干扰能力强;6)摩尔荧光量子产率高等。这些优点突破了传统荧光材料探针局限,已在肿瘤的分子成像、细胞成像和在体成像研究中取得重要进展[7]。同时,目前的基因组学、蛋白质组学等检测手段主要是对肿瘤发生发展过程中的关键分子进行定性、半定量研究,尚不能原位、实时展现关键分子与临床关键信息的相互作用关系,因此难以准确全面揭示肿瘤进展演变的规律,以及在宏观形态上实现对肿瘤侵袭行为的综合评估[8]。多分子成像技术有望突破这一技术障碍,有利于实现细胞或组织水平的原位、实时、定量、多组分、长时程成像,同时结合快速发展的生物信息学技术,快速有效准确地提取、挖掘和分析成像信息,为发展个体化诊疗提供全新的技术支撑平台。
3 量子点标记分子探针成像技术在肿瘤分子分型中的应用
尽管组织病理长期以来为肿瘤诊断的金标准,但已无法满足肿瘤个体化治疗需求;而且,肿瘤大体组织及病理形态并非总存在特异和典型的改变;因此,分子层面的变化及特点显得更为实用且有效[9]。量子点标记的分子探针技术能对肿瘤特异性标志物实现原位、实时、定量、高灵敏度成像,为肿瘤分子分型提供有效的技术手段。
3.1 量子点标记探针原位单分子成像及定量检测
量子点在肿瘤分子分型中的应用范例是乳腺浸润性导管癌中人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的检测。HER2是表皮生长因子受体家族成员,参与肿瘤增生、血管形成和转移,准确定位、定量并全面解析其生物学行为,对乳腺癌个体化治疗至关重要[10]。Wu等[11]利用量子点标记技术成功实现了HER2的靶向检测。Yezhelyev等[12]也实现了在不同细胞系及临床组织标本中的HER2检测,并证实HER2准确定量在临床实践中的应用价值,为个体化诊疗提供依据。我们课题组也开展了量子点标记探针对乳腺癌HER2靶向诊断应用基础研究[7,13-16](图1)。首次在乳腺癌临床病理标本中实现了HER2的靶向特异性检测,评估了量子点标记分子探针的可靠性、灵敏性与实用性,初步证实了该技术的体外定量检测优势[13]。随后,进一步在大样本乳腺癌随访患者中评估了该体系的价值,基于多光谱技术进一步提高了HER2检测的准确性和可靠性,实现了传统形态病理学关键指标肿瘤大小与HER2定量参数的整合,提出了乳腺癌HER2总量的概念。结果表明,用HER2总量来评估HER2状态,与目前检测金标准具有较高的一致性,可以较好地揭示乳腺癌HER2表达的生物学规律,可以甄别出目前传统方法难以发现的乳腺癌新亚型。以此来指导的乳腺癌分子靶向治疗,有望进一步提高乳腺癌疗效,推动乳腺癌的个体化、规范化治疗[15]。最近,通过对激素受体的定量与定性分析,建立了基于激素受体表达的亚型分类新标准,并联合HER2总量新指标,实现了乳腺癌亚型预后差异的有效预测[16]。
除了在乳腺癌研究中的应用外,Li等[17]利用量子点标记分子探针联合多光谱分析技术实现了对人前列腺癌Akt-1的定量检测,高通量组织芯片分析表明,高表达Akt-1与患者高特异性复发及死亡风险密切相关,该研究证实了量子点标记分子探针的定量检测优势。最近,Zhao等[18]基于量子点标记分子探针技术,实现了胃癌中Caveolin-1的定量检测,预测胃癌预后。
3.2 量子点标记探针原位多分子共成像
基于量子点标记探针多分子成像技术在个体化评估肿瘤生物学行为、鉴别诊断、分期分型及治疗方案制定等方面意义更大(表1)。Ghazani等[19]利用该技术对肺癌组织芯片进行多分子成像,结合计算机信息获取及计算方法,成功建立肺癌中三种关键蛋白表达信息的综合分析方法,为肺癌的诊断和治疗提供了新思路。Snyder等[21]利用该技术,对乳腺癌组织切片的三种标记分子CD44、CD24和Ki67进行原位多色成像,结果表明,在CD44和CD24亚组中,Ki67阳性率是不同的,这为不同亚组采取不同的治疗手段提供依据。
Liu等[22]也利用该技术成功建立了霍奇金淋巴瘤的分子分型方法。Reed-Sternberg(RS)细胞是病理诊断霍奇金淋巴瘤的标志,但其数量只占了淋巴组织中异质性浸润淋巴细胞的1%,诊断困难。基于量子点多色成像技术通过原位同时显示组织切片中的CD15、CD30、CD45和Pax5四种分子,可快速将霍奇金淋巴瘤中的少量异质性RS细胞(CD15+/CD30+/CD45-/Pax5+)从大量淋巴细胞中鉴别出来。该诊断技术已应用于临床转化研究,包括6例霍奇金淋巴瘤,2例可疑淋巴瘤和2例良性淋巴结增生。因此,基于量子点多色成像的肿瘤分子分型技术,有望提高对异质性RS细胞的检测灵敏度,提高霍奇金淋巴瘤的诊断分型准确度。

图1 量子点标记探针技术在分子病理中的应用Figure 1 QD-based immunohistochemistry(IHC)labeled the molecular pathology
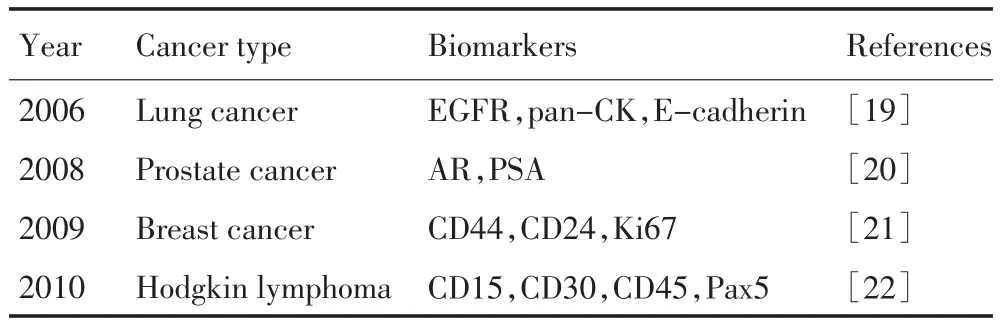
表1 基于量子点多分子成像技术的肿瘤分子分型研究Table 1 Molecular classification of tumors using quantum dot-based multiplexed imaging
3.3 量子点标记探针对肿瘤微环境的分子分型研究
1889年Paget提出“种子和土壤学说”,器官微环境可影响特定肿瘤细胞的存活、生长和侵袭。本课题组也开展了基于肿瘤微环境分析的胃癌分子分型研究(图2)。基于量子点标记分子探针技术,对肿瘤微环境关键分子进行原位多色成像,包括间质的主要成分Ⅳ型胶原,间质降解主要成分MMP9,免疫浸润细胞的代表巨噬细胞以及肿瘤新生血管标志CD105,揭示了肿瘤细胞与微环境的协同进化过程,提出微环境的5种特征[8,23-24],并将肿瘤侵袭模式分为4种类型[23]。同时,根据间质巨噬细胞的浸润程度,肿瘤新生血管的数量及新生血管的成熟度等三大特点,提出间质微环境特征分子分型概念,据此将胃癌分为4种亚型,各组间的临床预后具有显著差异[24]。并且,不同的胃癌病理类型呈现的肿瘤微环境差异显著,由浸润性巨噬细胞、肿瘤新生血管及肿瘤细胞构成的转移单元在低分化胃癌中显著多于高分化胃癌[25]。
另外,基于量子点多分子成像技术的肝细胞癌微环境研究结果显示,Ⅳ型胶原在肿瘤组织中分布具有异质性,并根据间质微环境差异总结出以下三方面特征[8]:1)相比于癌旁及肝硬化组织,肝癌细胞外间质中的主要成分Ⅳ型胶原由于机械应力的作用变得僵直并且缺乏弹性;2)胶原在降解之前,将发生压缩和重塑,与肿瘤新生血管的形成同时进行;3)胶原在侵袭的前锋部位被降解,而剩余的未被降解部位的胶原呈线性排列,围绕着癌巢与血管。上述工作表明,在开展肿瘤分子分型时,既要关注肿瘤细胞本身,也要分析间质微环境,后者的类型特征是肿瘤预后预测体系的必要部分。

图2 癌症侵袭过程中肿瘤微环境的5种组织学特征Figure 2 Five histopathologic characteristics of tumor microenvironment during tumor invasion
4 结语
肿瘤是多基因参与的复杂疾病,具有多阶段性发展的特点[8]。因此肿瘤研究模式也必须不断发展:从单基因向多基因、从单一层次向集成层次、从单种细胞向多种细胞转变,多维信息的获取和分析技术则是实现这一转变的先决条件。量子点标记探针多色成像技术和多光谱分析技术,为基于多分子差异表达的肿瘤分子分型提供了较好的平台,有望在指导肿瘤个体化治疗方面发挥重要作用。
1 Marusyk A,Polyak K.Tumor heterogeneity:causes and consequences[J].Biochim Biophys Acta,2010,1805(1):105-117.
2 Golub TR,Slonim DK,Tamayo P,et al.Molecular classification of cancer:class discovery and class prediction by gene expression monitoring[J].Science,1999,286(5439):531-537.
3 Veronesi U,Zurrida S,Goldhirsch A,et al.Breast cancer classification:Time for a change[J].J Clin Oncol,2009,27(15):2427-2428.
4 Joyce JA,Pollard JW.Microenvironmental regulation of metastasis[J].Nat Rev Cancer,2009,9(4):239-252.
5 Wang X,Yang L,Chen ZG,et al.Application of nanotechnology in cancer therapy and imaging[J].CA Cancer J Clin,2008,58(2):97-110.
6 Fang M,Peng CW,Liu SP,et al.In Vitro invasive pattern of hepatocellular carcinoma cell line HCCLM9 based on three-dimensional cell culture and quantum dots molecular imaging[J].J Huazhong Univ Sci Technolog Med Sci,2013,33(4):520-524.
7 Chen C,Peng J,Sun SR,et al.Tapping the potentials of quantum dots into clinical application for personalized oncology:current status and future perspectives[J].Nanomedicine,2012,7(3):411-428.
8 Fang M,Peng CW,Yuan JP,et al.Coevolution of the tumor microenvironment revealed by quantum dot-based multiplexed imaging of hepatocellular carcinoma[J].Future Oncol,2013,9(7):1029-1037.
9 Harris TJ,McCormick F.The molecular pathology of cancer[J].Nat Rev Clin Oncol,2010,7(5):251-265.
10 Ross JS,Slodkowska EA,Symmans WF,et al.The HER2 receptor and breast cancer:ten years of targeted anti-HER2 therapy and personalized medicine[J].Oncologist,2009,14(4):320-368.
11 Wu X,Liu H,Liu J,et al.Immunofluorescent labeling of cancer marker Her2 and other cellular targets with semiconductor quantum dots[J].Nat Biotechnol,2003,21(1):41-46.
12 Yezhelyev MV,Al Hajj A,Morris C,et al.In situ molecular profiling of breast cancer biomarkers with multicolor quantum dots[J].Adv Mater,2007,19(20):3146-3151.
13 Chen C,Peng J,Xia HS,et al.Quantum dots-based immunofluorescence technology for the quantitative determination of HER2 expression in breast cancer[J].Biomaterials,2009,30(15):2912-2918.
14 Chen C,Peng J,Xia HS,et al.Quantum dots-based immunofluorescent imaging of HER2 and ER provides new insights into breast cancer heterogeneity[J].Nanotechnology,2010,21(9):95101.
15 Chen C,Xia HS,Gong YP,et al.The quantitative detection of total HER2 load by quantum dots and the identification of a new subtype of breast cancer with different 5 year prognosis[J].Biomaterials,2010,31(33):8818-8825.
16 Chen C,Sun SR,Gong YP,et al.Quantum dots-based molecular classification of breast cancer by quantitative spectroanalysis of hormone receptors and HER2[J].Biomaterials,2011,32(30):7592-7599.
17 Li R,Dai H,Wheeler TM,et al.Prognostic value of Akt-1 in human prostate cancer:a computerized quantitative assessment with quantum dot technology[J].Clin Cancer Res,2009,15(10):3568-3573.
18 Zhao X,He Y,Gao J,et al.Caveolin-1 expression level in cancer associated fibroblasts predicts outcome in gastric cancer[J].PLoS One,2013,8(3):e59102.
19 Ghazani AA,Lee JA,Klostranec J,et al.High throughput quantification of protein expression of cancer antigens in tissue microarray using quantum dot nanocrystals[J].Nano Lett,2006,6(12):2881-2886.
20 Shi C,Zhou G,Zhu Y,et al.Quantum dots-based multiplexed immunohistochemistry of protein expression in human prostate cancer cells[J].Eur J Histochem,2008,52(2):127-134.
21 Snyder EL,Bailey D,Shipitsin M,et al.Identification of CD44v6+/CD24-breast carcinoma cells in primary human tumors by quantum dot-conjugated antibodies[J].Lab Invest,2009,89(8):857-866.
22 Liu J,Lau SK,Varma VA,et al.Multiplexed detection and characterization of rare tumor cells in Hodgkin's lymphoma with multicolor quantum dots[J].Anal Chem,2010,82(14):6237-6243.
23 Peng CW,Liu XL,Chen C,et al.Patterns of cancer invasion revealed by QDs-based quantitative multiplexed imaging of tumor microenvironment[J].Biomaterials,2011,32(11):2907-2917.
24 Peng CW,Tian Q,Yang GF,et al.Quantum-dots based simultaneous detection of multiple biomarkers of tumor stromal features to predict clinical outcomes in gastric cancer[J].Biomaterials,2012,33(23):5742-5752.
25 Fang M,Yuan JP,Peng CW,et al.Quantum dots-based in situ molecular imaging of dynamic changes of collagenⅣduring cancer invasion[J].Biomaterials,2013,34(34):8708-8717.
(2013-09-27收稿)
(2013-11-15修回)
Research progress on the molecular classification of tumors by quantum dot-based nanotechnology
Min FANG1,Chunwei PENG1,Chuang CHEN2,Daiwen PANG3,Yan LI1
Yan Li;E-mail:liyansd2@163.com
1Department of Oncology,Zhongnan Hospital of Wuhan University,Hubei Key Laboratory of Tumor Biological Behaviors and Hubei Cancer Clinical Study Center,Wuhan 430071,China.
2Department of Breast and Thyroid Surgery,Renmin Hospital of Wuhan University,Wuhan 430060,China.
3College of Chemistry and Molecular Sciences,Wuhan University,Wuhan 430072,China.
Malignant tumors are highly heterogeneous in terms of molecular phenotypes such that personalized therapy will become the standard for tumor therapy.Molecular classifications of cancer based on differences in biological behavior are important for selecting treatment strategies and prognostication.The unique optical and chemical properties of quantum dots have been widely used in biomedical applications such as tumor diagnosis,monitoring,pathogenesis,treatment,molecular pathology,and heterogeneity based on biological markers.In this study,we discuss the application of quantum dot-based nanotechnology and the molecular classification of cancer in personalized oncology.
quantum dots,tumor,molecular classification,multiplexed imaging
10.3969/j.issn.1000-8179.20131857
①武汉大学中南医院肿瘤科,湖北省医学临床研究中心,肿瘤生物学行为湖北省重点实验室(武汉市430071);②武汉大学人民医院乳腺甲状腺外科;③武汉大学化学与分子科学学院
*本文课题受国家自然科学基金面上项目(编号:81171396)、重点项目(编号:81230031/H18)和国家科技重大专项(编号:2012ZX10002012-12)资助
李雁 liyansd2@163.com
This work was supported by the National Natural Science Foundation of China(No.81171396,81230031/H18)and the National Science and Technology Major Project(No.2012ZX10002012-12).
(本文编辑:郑莉)

