MAPK通路抑制剂对不同PTEN状态子宫内膜癌细胞作用及机制
肖 兰,龙腾飞,何 婵,周家德
MAPK通路抑制剂对不同PTEN状态子宫内膜癌细胞作用及机制
肖 兰,龙腾飞,何 婵,周家德
目的 探讨PTEN缺失和表达下p38MAPK通路抑制剂(SB203580)对子宫内膜癌细胞Ishikawa及HEC-1A的作用及其机制。方法 PTEN小分子干扰RNA及PTEN基因转染后,激光共聚焦显微镜检测PTEN蛋白表达;SB203580干预48 h,流式细胞术、MTT法及Western blot法分别检测细胞干预后子宫内膜癌细胞早期凋亡、细胞增殖活性、p38MAPK通路的磷酸化水平及其下游底物4E-BP1蛋白的磷酸化情况。结果 PTEN小分子干扰RNA封闭与PTEN稳定转染使两株子宫内膜癌细胞(Ishikawa,HEC-1A)PTEN表达水平改变。SB203580干预使 PTEN缺失 Ishikawa及HEC-1A细胞生长显著抑制,细胞发生早期凋亡;p38MAPK通路磷酸化水平和磷酸化4E-BP1蛋白表达均显著下降;与PTEN表达两种细胞比较,差异均有统计学意义(P<0.01)。结论 内外源性PTEN 缺失使两株子宫内膜癌细胞中p38MAPK通路活化,对SB203580敏感性增加,其机制可能与PTEN缺失导致PTEN对p38MAPK信号通路负性调控功能丧失,引发p38MAPK信号通路下游底物4E-BP1激活导致p38MAPK通路活化有关。
子宫内膜癌;PTEN;p38MAPK通路抑制剂;敏感性
R 342.3;R 349.2;R 977
PTEN作为一个抑癌基因,在细胞生长、凋亡中具有重要生物学功能。研究[1]显示PTEN基因对整合多条上下游信号通路有重要作用。许多前期研究[2]显示,相关信号通路仅在PTEN缺失情况下对相关信号通路抑制剂敏感,而PTEN基因是目前人子宫内膜癌中突变率最高的基因。因此,该研究主要探讨MAPK家族中p38MAPK通路特异性抑制剂SB203580对不同PTEN表达人子宫内膜癌细胞的作用,为选择以相关信号通路为靶点的子宫内膜癌治疗人群提高临床疗效提供一定依据。
1 材料与方法
1.1 材料
1.1.1 细胞系及质粒 人子宫内膜癌细胞株Ishikawa及HEC-1A由华中科技大学附属协和医院王泽华教授惠赠;pcDNA3.1-GFP/PTEN质粒载体由华中科技大学附属同济医院张惠兰教授惠赠,G418抗性;pSilence TM siRNA表达载体(3.12 H1 hygro版本)、表达非特异siRNA的pSilenceTM siRNA表达载体购自英国Ambion公司,试验中作为阴性对照,亦表达G418抗性基因。
1.1.2 主要试剂 PTEN单克隆抗体购自美国Santa Cruz公司;p38MAPK、phospho-p38MAPK、4EBP1及phospho-4E-BP1购自美国CST公司;Annexin V-FITC试剂盒购自北京宝赛生物技术公司;p38MAPK抑制剂SB203580购自美国Biomol公司。
1.2 方法
1.2.1 细胞培养 Ishikawa和 HEC-1A细胞于含10%小牛血清DMEM培养液中培养。细胞在含5%CO2、饱和湿度及37℃条件下进行培养。
1.2.2 PTEN表达真核质粒和小分子干扰真核载体稳定转染 ①小分子干扰真核载体转染:无血清培养基洗涤2次,HEC-1A细胞90%融合时行转染pSilencerTM 3.1-siPTEN,具体转染步骤按 Lipofectamine 2000试剂说明书上操作,置细胞培养箱中4~6 h更换完全培养基。转染24 h细胞置400 μg/ml G418培养液中培养,约4周后筛选出抗G418的HEC-1A-siPTEN阳性克隆;②PTEN稳定转染:以每孔2.5×105个Ishikawa细胞浓度种板,细胞90%融合时转染pcDNA3.1/PTEN。具体转染步骤按Lipofectamine 2000试剂说明书上操作,转染24 h细胞置400 μg/ml G418培养液中培养,约4周后筛选出抗G418的Ishikawa-PTEN阳性克隆。
1.2.3 干预实验分组 根据PTEN表达或缺失情况,干预实验分组为 PTEN表达或敲除HEC-1A、HEC-1A+DMSO、HEC-1A+SB203580(SB)10 μmol/L;PTEN缺失或表达Ishikawa、Ishikawa+DMSO、Ishikawa+SB 10 μmol/L。
1.2.4 激光共聚焦显微镜检测PTEN蛋白表达
收集 Ishikawa、HEC-1A、PTEN 表达 Ishikawa、PTEN缺失HEC-1A细胞,每孔2.5×104个细胞浓度种板,放入多聚赖氨酸处理过的盖片,培养24 h后去培养液。预冷100%甲醇-20℃固定细胞5 min;0.2%Triton-PBS漂洗3次;0.5%Triton-PBS破膜5~10 min。0.2%Triton-PBS漂洗3次,5%BSA 封闭1 h,单克隆PTEN抗体(1∶250)4℃孵育过夜;0.2%Triton-PBS漂洗3次×10 min/次;羊抗鼠IgGFITC(1 ∶1 000)室温孵育1 h(避光);0.2%Triton-PBS漂洗3次×10 min/次,PI复染核15 min,封片,激光共聚焦显微镜下观察照相。细胞质中FITC标记PTEN蛋白表达绿色荧光为表达阳性,DAPI染细胞核表达蓝色荧光。
1.2.5 MTT法检测细胞增殖 各组细胞以1×104/ml的浓度种至96孔板,每孔100 μl,每组设3个复孔。继续培养24 h后每孔加入MTT(5 mg/ml)10 μl作用 2 h后弃上清,加入150 μl DMSO 作用振荡10~30 min,在自动酶标平板阅读仪上以570 nm波长读取吸光度(A)值。计算细胞存活率=(各浓度组A值/空白组A值)×100%。
1.2.6 流式细胞术检测各组子宫内膜癌细胞凋亡情况 消化各组细胞,1 000 r/min离心5 min去除培养基,PBS洗涤1次,弃上清液,收集细胞。100 μl PBS重悬细胞,分别加入Annexin V-FITC试剂5 μl,室温中避光孵育30 min,流式细胞仪(FACS Calibur,Becton-Dickinson公司)检测,Cell Quest软件分析。实验重复3次。
1.2.7 Western blot检测细胞内 p38MAPK 及 phospho-p38MAPK、phospho-4E-BP1及4E-BP1蛋白表达提取细胞总蛋白并检测蛋白浓度,取30 μg总蛋白,10%SDS-PAGE凝胶电泳,100 V,电泳至溴酚蓝达分离胶,加大电压至200 V,直至溴酚蓝达凝胶的底部,半干电转移至硝酸纤维素膜上,5%脱脂奶粉封闭,1∶500稀释p38MAPK及phospho-p38MAPK、phospho-4E-BP1及4E-BP1一抗,4℃孵育过夜,加入1∶5 000过氧化物酶标记羊抗兔二抗,37℃孵育2 h,洗涤,ECL 显影。
1.3 统计学处理 应用SPSS 11.5统计软件进行分析,数据均以x¯±s表示,采用t检验进行比较。
2 结果
2.1 各组子宫内膜癌细胞中PTEN蛋白表达 激光共聚焦显微镜显示 HEC-1A及Ishikawa细胞PTEN蛋白表达分别为阳性和阴性,其表达主要在细胞质中。PTEN稳定转染Ishikawa细胞内表达PTEN蛋白,而经siPTEN处理HEC-1A细胞PTEN表达受到抑制。见图1。
2.2 Annexin V-FITC检测不同PTEN表达各组细胞凋亡 PTEN缺失情况下,SB203580显著诱导Ishikawa及HEC-1A细胞发生早期凋亡,细胞早期凋亡率分别达(37.76±0.84)%及(32.75±1.36)%;显著高于SB203580诱导PTEN表达Ish-ikawa和HEC-1A细胞早期凋亡率(P<0.01);DMSO作用PTEN表达或缺失Ishikawa及HEC-1A细胞凋亡率无明显改变(P>0.01)。见表1和图2、3。
表1 细胞早期凋亡率比较(%,±s)

表1 细胞早期凋亡率比较(%,±s)
*PTEN缺失与PTEN表达各组细胞比较
组别 PTEN表达 PTEN缺失 t值 P值*HEC-1A 1.21 ±0.65 1.61 ±0.42-1.545 0.161 HEC-1A+DMSO 1.78 ±0.66 2.22 ±0.63-1.607 0.147 HEC-1A+SB 3.32 ±1.08 32.75 ±1.36-63.177 0.000 Ishikawa 1.42 ±0.77 1.39 ±0.75 0.892 0.398 Ishikawa+DMSO 1.25 ±0.42 1.76 ±0.56-1.971 0.084 Ishikawa+SB 3.13 ±0.72 37.76 ±0.84-138.729 0.000
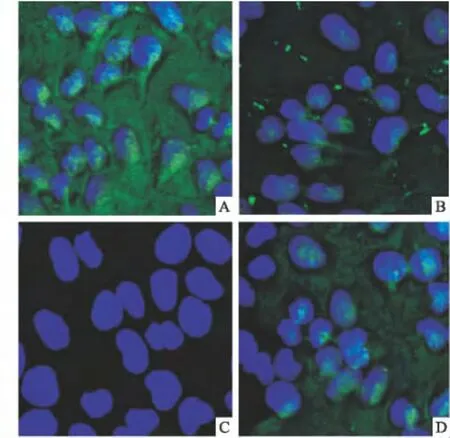
图1 两株子宫内膜癌细胞转染前后PTEN蛋白免疫荧光表达 ×400
2.3 不同PTEN表达各组细胞存活率 PTEN缺失HEC-1A及Ishikawa细胞经SB203580作用48 h,细胞生长明显受到抑制,两株细胞存活率仅为(49±3.0)%和(46±2.6)%,与SB203580作用PTEN表达HEC-1A及Ishikawa细胞比较,差异有统计学意义(P<0.01);DMSO作用PTEN表达或缺失Ishikawa及HEC-1A细胞存活率无明显改变(P>0.01)。见表2。
2.4 不同 PTEN表达各组细胞 p38MAPK及phospho-p38MAPK、4E-BP1及 phospho-4E-BP1蛋白表达 SB203580干预后,PTEN缺失HEC-1A及Ishikawa细胞phospho-p38MAPK表达下降,两株细胞分别为(28.2±1.5)%和(24.1±1.7)%,与PTEN表达HEC-1A及Ishikawa细胞比较,差异有统计学意义(P<0.01)。对磷酸化4E-BP1蛋白Western blot条带灰度值分析发现:PTEN缺失HEC-1A和Ishikawa细胞phospho-4E-BP1蛋白Western blot条带灰度值下降至(117 150±2 423)和(98 885±8 055),与 PTEN表达 HEC-1A及 Ishikawa细胞(370 120±1 903)和(410 051±1 009)比较,差异有统计学意义。SB203580干预前后,PTEN缺失或表达HEC-1A及Ishikawa细胞总4E-BP1蛋白无明显改变。见图4、5和表3。
表2 细胞存活率比较(%,±s)

表2 细胞存活率比较(%,±s)
*PTEN缺失与PTEN表达各组细胞比较
组别 PTEN表达 PTEN缺失 t值 P值*HEC-1A 96.0 ±1.7 97.0 ±2.4-0.209 0.840 HEC-1A+SB 90.0 ±1.3 49.0 ±3.0 8.200 0.000 HEC-1A+DMSO 95.8 ±1.0 94.1 ±2.2 0.423 0.121 Ishikawa 97.0 ± 2.5 96.0 ±2.1-0.207 0.841 Ishikawa+SB 89.0 ±1.8 46.0 ±2.6 9.383 0.000 Ishikawa+DMSO 96.0 ±1.2 95.6 ±0.9 0.701 0.192
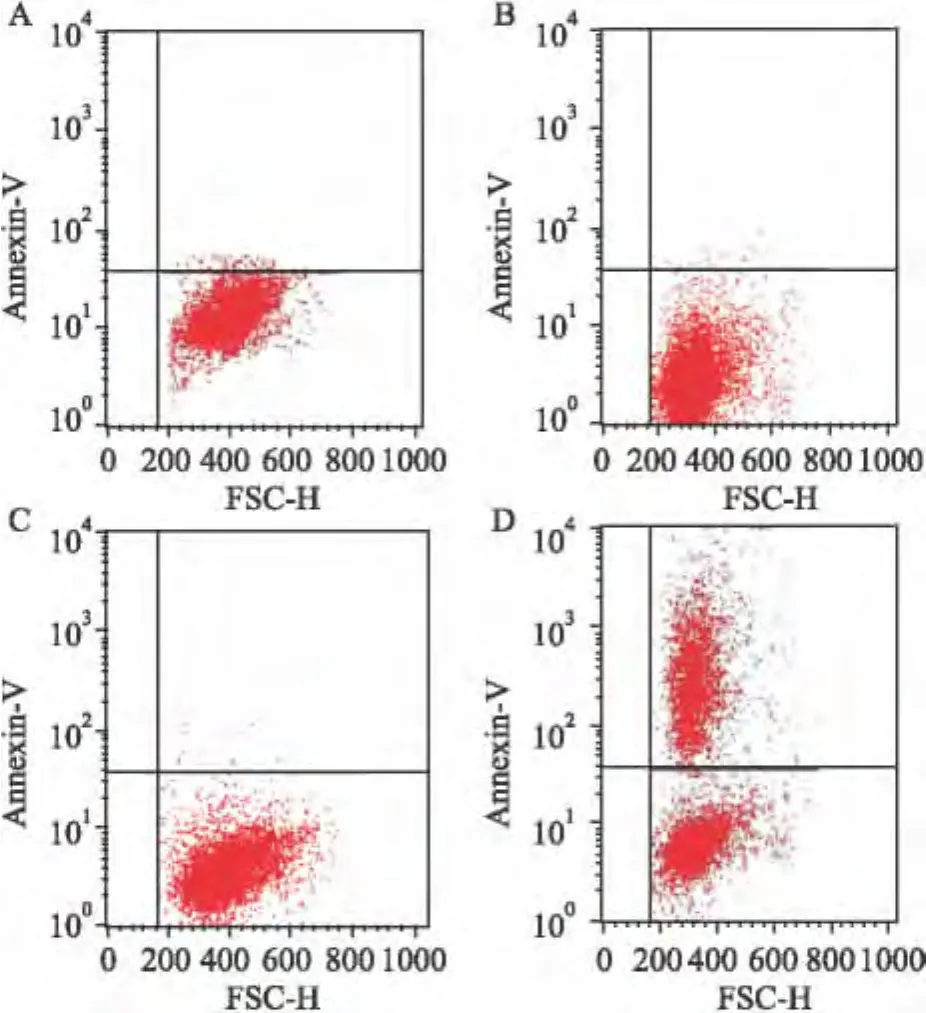
图2 Ishikawa细胞凋亡率比较

图3 HEC-1A细胞凋亡率比较
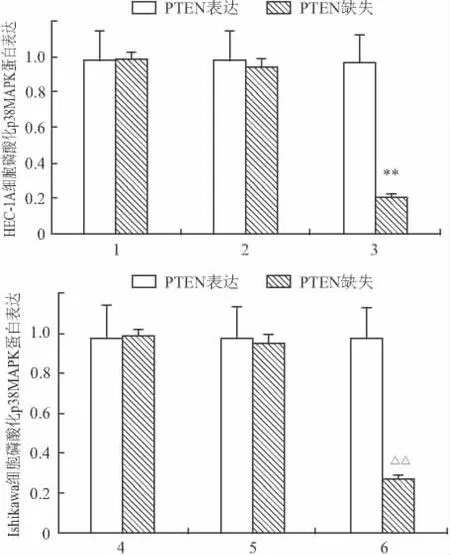
图4 SB203580干预前后不同PTEN表达两株细胞phospho-p38MAPK蛋白表达比较
表3 SB203580干预前后不同PTEN表达两株细胞phospho-p38MAPK蛋白表达率(%,±s)

表3 SB203580干预前后不同PTEN表达两株细胞phospho-p38MAPK蛋白表达率(%,±s)
*PTEN缺失与PTEN表达各组细胞比较
组别 PTEN表达 PTEN缺失 t值 P值*HEC-1A 97.0 ±1.9 98.0±1.0-0.125 0.616 HEC-1A+SB 96.0+1.8 24.1 ±1.7 61.310 0.000 HEC-1A+DMSO 97.8 ±0.9 93.6 ±2.1 1.347 0.278 Ishikawa 98.0 ±1.1 97.5 ±1.4 0.183 0.092 Ishikawa+SB 96.4 ±2.3 28.2 ±1.5 46.500 0.000 Ishikawa+DMSO 95.8 ±1.2 96.0±0.6 0.571 0.147
3 讨论

图5 SB203580干预前后不同PTEN表达两株细胞4E-BP1及phospho-4E-BP1蛋白表达
子宫内膜癌是女性生殖道最为常见恶性肿瘤之一[3],占女性生殖道恶性肿瘤的 20% ~30%,研究[4]显示在其发生发展过程中抑癌基因失活、突变导致的信号通路异常激活可能发挥了重要作用。MAPKs信号通路是一类在肿瘤形成、进展和转移中扮演着重要角色的蛋白激酶[5],p38MAPK通路是MAPK家族重要成员,在多数肿瘤中都存在不正常激活或异常表达[6],其主要通过细胞周期调控及诱导细胞凋亡发挥肿瘤抑制作用。
具有磷酸酶活性的肿瘤抑制基因PTEN在维持基因组稳定性方面起着重要作用。PTEN缺失可能导致肿瘤细胞对相关化疗、放疗敏感性降低[7-8]。但亦有一些研究[9-10]显示PTEN缺失或突变可导致肿瘤细胞对特异性信号通路抑制剂产生耐受。PTEN在人子宫内膜癌中丢失率可高达60%~80%[11],PTEN基因缺失突变与子宫内膜癌发生发展有着密切联系。目前有关子宫内膜癌PTEN缺失与相关信号通路关系的研究还未见报道。
因此,本研究采用稳定转染和小分子干扰RNA敲除改变Ishikawa和HEC-1A两株子宫内膜细胞PTEN表达,观察p38MAPK通路抑制剂诱导不同PTEN表达人子宫内膜癌细胞增殖、凋亡等情况。结果显示SB203580干预后,PTEN表达缺失子宫内膜癌细胞生长明显减缓,细胞发生显著早期凋亡,而PTEN表达子宫内膜癌细胞则无此趋势,说明p38MAPK信号通路是调控PTEN表达缺失子宫内膜癌细胞增殖的关键信号分子。蛋白定量结果显示,子宫内膜癌细胞中p38MAPK途径异常激活与PTEN缺失相关;p38MAPK特异性抑制剂SB203580可显著下调PTEN表达缺失子宫内膜癌细胞中p38MAPK通路及4E-BP1蛋白磷酸化水平。分析以上结果显示,子宫内膜癌细胞中 PTEN缺失使p38MAPK通路活化,其机制可能与PTEN缺失导致PTEN对p38MAPK信号通路负性调控功能丧失,引起PTEN下游靶基因4E-BP1转录改变有关。以上结果显示PTEN表达缺失时,子宫内膜癌细胞对p38MAPK信号通路抑制剂敏感性明显增加,提示PTEN水平可成为预测相关信号通路抑制剂敏感与否的标志物之一。
[1]Blanco-Aparicio C,Refiner O,Leal J F,et al.PTEN,more than the AKT pathway[J].Carcinogenesis,2007,28(7):1379-86.
[2]Carracedo A,Alimonti A,Pandolfi P P.PTEN level in tumor suppression:how much is too little?[J].Cancer Res,2011,71(3):629-33.
[3]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009[J].CA Cancer J Clin,2009,59(4):225-49.
[4]Xiao L,Yang Y B,Li X M,et al.Differential sensitivity of human endometrial carcinoma cells with different PTEN expression to mitogen-activated protein kinase signaling inhibits and implications for therapy[J].J Cancer Res Clin Oncol,2010,36(7):1089-99.
[5]Dhillon A S,Hagan S,Rath O,et al.MAP kinase signalling pathways in cancer[J].Oncogene,2007,26(22):3279-90.
[6]Davidson B,Konstantinovsky S,Kleinberg L,et al.The mitogenactivated protein kinases(MAPK)p38 and JNK are markers of tumor progression in breast carcinoma[J].Gynecol Oncol,2006,102(3):453-61.
[7]Lee S,Choi E J,Jin C,et al.Activation of PI3K/Akt pathway by PTEN reduction and PIK3CA mRNA amplification contributes to cisplatin resistance in an ovarian cancer cell line[J].Gynecol Oncol,2005,97(1):26-34.
[8]Jiang Z,Pore N,Cerniglia G J,et al.Phosphatase and tensin homologue deficiency in glioblastoma confers resistance to radiation and temozolomide that is reversed by the protease inhibitor nelfinavir[J].Cancer Res,2007,67(9):4467-73.
[9]Wang Z H,Gao Q Y,Fang J Y.Loss of PTEN expression as a predictor of resistance to anti-EGFR monoclonal therapy in metastatic colorectal cancer:evidence from retrospective studies[J].Cancer Chemother Pharmacol,2012,69(6):1647-55.
[10]Paraiso K H,Xiang Y,Rebecca V W,et al.PTEN loss confers BRAF inhibitor resistance to melanoma cells through the suppression of BIM expression[J].Cancer Res,2011,71(7):2750-60.
[11]Akiyama-Abe A,Minaguchi T,Nakamura Y,et al.Loss of PTEN expression is an independent predictor of favourable survival in endometrial carcinomas[J].Br J Cancer,2013,109(6):1703-10.
Effects of MAPK signal transduction inhibitors on endometrial carcinoma cells with different PTEN status and its mechanism
Xiao Lan,Long Tengfei,He Chan,et al
(Dept of Obstetrics and Gynecology,The First Affiliated Hospital of Anhui Medical University,Hefei230022)
ObjectiveTo explore whether sensitivity to p38MAPK inhibitors are specifically due to status of PTEN in endometrial cancer Ishikawa and HEC-1A cells,and its related mechanisms.MethodsVector mediated PTEN-siRNA and PTEN gene were transfected into two endometrial cancer cells.The expression of PTEN protein was detected by confocal spectral microscopy.SB203580 treated for 48 hours,cell proliferation,cell early apoptosis,were studied by MTT method and flow cytometry(FCM),respectively.The activation of p38MAPK and 4E-BP1 was examined by Western blot.ResultsThe PTEN protein expression in two endometrial carcinoma cells(Ishikawa,HEC-1A)was exchanged by vector mediated PTEN siRNA and PTEN plasmid stable transfection.SB203580 could inhibit cell viability,induce cell early apoptosis of PTEN loss Ishikawa and HEC-1A cells after the cells exposed to SB203580.The expression of phosphorylation of p38MAPK and 4E-BP1 protein in PTEN loss Ishikawa and HEC-1A cells was significantly decreased.Compared with PTEN intact Ishikawa and HEC-1A cells the difference was significant(P<0.01).ConclusionLoss of PTEN results in the activation of p38MAPK signal pathway,and due to sensitive to p38MAPK signal transduction inhibitors in endometrial carcinoma cells.Those results suggest that cells with loss of PTEN have a feedback downregulation of receptor p38MAPK signalling pathway,which leads to PTEN inactivation of p38MAPK signaling pathway,the transcription change of the downstream gene targeted p38MAPK.
endometrial carcinoma;PTEN;p38MAPK signal transduction inhibitor;sensitivity
A
1000-1492(2014)05-0613-06
2014-02-17接收
广东省自然科学基金(编号:7001568)
安徽医科大学第一附属医院妇产科,合肥 230022
肖 兰,女,博士,副研究员,主治医师;
周家德,男,主任医师,副教授,硕士生导师,责任作者,E-mail:zhoujiade@sina.com

