氯化锂介导经典Wnt/β-catenin信号通路在大鼠脂肪干细胞增殖和成骨中的作用
赵 璇,徐 燕,郑桂婷,沈继龙
氯化锂介导经典Wnt/β-catenin信号通路在大鼠脂肪干细胞增殖和成骨中的作用
赵 璇1,徐 燕1,郑桂婷1,沈继龙2
目的 探讨在体外生长环境下不同浓度氯化锂对脂肪干细胞(ADSCs)增殖和成骨分化的作用及其可能的机制。方法 ①从3周龄SD大鼠腹股沟脂垫分离出脂肪组织,使用0.1%Ⅰ型胶原酶消化后置于含10%胎牛血清DMEM培养,以 0、2.5、5、10、20、40 mmol/L 浓度的氯化锂作用 ADSCs 24、48、72 h,用 MTT法测定氯化锂对细胞增殖的作用;②ADSCs加入含0、2.5、5、10、20、40 mmol/L 氯化锂的成骨培养液中培养7 d后测定细胞中碱性磷酸酶(AKP)的活性;③用RT-PCR法检测成骨诱导3 d后,不同浓度氯化锂作用7 d时ADSCs中β-catenin、糖原合成激酶3β、AKP的表达。结果
在体外环境培养下,低浓度氯化锂(2.5、5、10 mmol/L)促进干细胞增殖,高浓度氯化锂(20、40 mmol/L)抑制细胞增殖。5、10 mmol/L氯化锂促进ADSCs中AKP的活性,但是40 mmol/L具有明显抑制AKP活性的作用。同时,氯化锂能上调β-catenin和AKP的表达。结论 氯化锂在体外对大鼠ADSCs增殖有双重影响,并且促进AKP活性和ADSCs成骨分化,具有剂量依赖性。5 mmol/L 浓度的氯化锂可作为促进大鼠ADSCs增殖和成骨分化的最适浓度。
Wnt信号通路;脂肪干细胞;氯化锂;增殖;成骨分化
脂肪干细胞(adiposed-derived stem cell,ADSCs)由 Zuk et al[1]于2001年发现,因其易取得、储量丰富性、自我增殖和多向分化的能力强等特点在牙周组织工程中引起关注[2]。Wnt信号通路参与细胞的增殖、分化、迁移、基因表达等各项活动[3],特别是经典的Wnt/β-catenin信号通路更是对干细胞的增殖和分化起到关键性的作用。该研究旨在使用不同浓度氯化锂对ADSCs进行刺激,探讨经典Wnt/βcatenin通路对于ADSCs增殖和成骨向分化的作用以及可能的机制。
1 材料与方法
1.1 实验动物 清洁级3周龄SD大鼠,体重50 g,雌雄不限,由安徽医科大学实验动物中心提供。
1.2 主要仪器、试剂 DMEM、胎牛血清(FBS)、0.25%胰蛋白酶(HyClone公司,美国);Ⅰ型胶原酶、β-甘油磷酸钠、抗坏血酸、地塞米松、氯化锂、MTT(Sigma公司,美国);碱性磷酸酶(alkaline phosphatase,AKP)试剂盒(南京建成生物工程研究所);TRIzol(Life Technologies公司,美国);逆转录试剂盒、第一链cDNA合成试剂盒(MBI Fermentas公司,加拿大);DNA Marker(TaKaRa公司,日本);倒置相差显微镜(Olympus公司,日本);ELX808U酶标仪(伯腾仪器,美国);Nikon eclipse 80i成像系统(尼康株式会社,日本);PCR仪(BIO-RAD公司,美国);高速冷冻离心机(日本株式会社,日本)。
1.3 方法
1.3.1 ADSCs分离、培养以及传代 SD大鼠ADSCs的分离主要采用酶消化法,无菌取大鼠腹股沟区脂肪垫,PBS漂洗2~3次后去除组织表面的筋膜、血管,剪碎至糊状移至50 ml离心管。加入0.1% Ⅰ型胶原酶于管中,37℃消化30~40 min后加入含10%FBS的DMEM液终止消化,2 500 r/min离心5 min。离心结束后吸去最上层的油脂及中层的DMEM,仅保留下层脂肪细胞,加入5 ml含10%FBS的DMEM液重悬细胞。以200目细胞筛过滤,并加入适量的红细胞裂解液,37℃孵育10 min裂解红细胞。再次800 r/min离心5 min后弃上清液,PBS漂洗后离心取细胞沉淀,5 ml含10%FBS的DMEM液重悬细胞并接种于培养瓶中,37℃、5%CO2孵箱培养,48 h后首次换液,以后每3 d换液1次,待细胞汇合至80%用PBS洗涤3次,加入0.25%的胰蛋白酶(含0.01%EDTA),当细胞由梭形变为圆形从瓶上脱落,用含10%FBS的DMEM液终止消化,吹打均匀并以1∶3比例传代。传至第3代备用。
1.3.2 MTT法检测 取对数生长期细胞消化制备成单细胞悬液,密度为4 000个/孔接种于96孔板培养,待细胞长成单层换成含氯化锂终浓度为0、2.5、5、10、20、40 mmol/L 的新鲜无血清培养液培养,每个浓度平行接种3孔,在第1、2、3天时检测,每孔加入 0.5%MTT 20 μl/孔,37 ℃ 孵育 4 h后,去除MTT,加入二甲基亚砜150 μl,低速震荡90 r/min约10 min后,在492 nm处酶标仪读出吸光度值(OD492),实验重复3次。
1.3.3 AKP活性检测 将对数生长期的细胞按4 000个/孔接种于96孔板内,24 h后更换含不同浓度氯化锂的成骨培养液,分为对照组(0 mmol/L)和实验组(2.5、5、10、20、40 mmol/L),作用 7 d 后检测每组细胞AKP的活性。每组设3个复孔。收集细胞后,依照试剂盒说明书检测,在酶标仪520 nm波长处读取数值。实验重复3次。
1.3.4 RT-PCR法检测Wnt信号通路组成以及成骨相关基因的表达 将细胞接种于6孔板中,分为对照组和实验组(氯化锂浓度为 2.5、5、10、20、40 mmol/L),成骨诱导3 d后氯化锂处理7 d,TRIzol一步法提取总RNA;分光光度法测量RNA的浓度以及纯度。使用Thermo逆转录试剂盒将RNA逆转录成cDNA。PCR产物经过1%琼脂糖凝胶电泳后,用紫外透射分析仪观察并且拍照,分析各个条带积分光密度(intergrated option density,IOD),计算相对于GAPDH的相对表达量。实验重复3次。引物由上海生工生物工程公司合成。见表1。
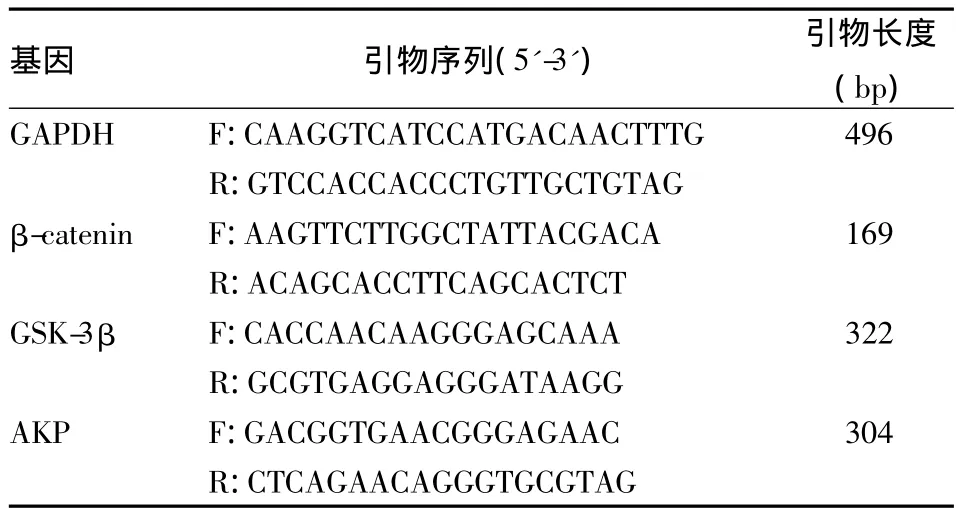
表1 mRNA扩增引物名称、核苷酸序列及产物大小
1.4 统计学处理 采用SPSS 16.0统计软件进行分析,数据以±s表示,组间均数比较采用单因素方差(ANOVA)分析,两组间比较采用t检验。
2 结果
2.1 ADSCs形态学 在倒置显微镜下观察,原代细胞刚接种时是悬浮于培养液中,24 h后小部分细胞零散贴壁,形态呈短梭形、三角形等,6~7 d后细胞体积增大,形态逐渐变化为长梭形,类似于成纤维细胞,呈漩涡状生长。当细胞传代次数增加,形态趋于均一,主要为梭形。见图1。

图1 倒置显微镜下第3代ADSCs形态 ×100
2.2 氯化锂对ADSCs增殖的影响 第1天氯化锂对各组作用效果不显著,各组差异无统计学意义。第2、3天氯化锂作用效果较明显,低浓度氯化锂(2.5、5、10 mmol/L)可以引起大鼠 ADSCs有丝分裂,有利于细胞增殖,第3天时效果显著;高浓度氯化锂(20、40 mmol/L)抑制细胞的增殖。见图2。
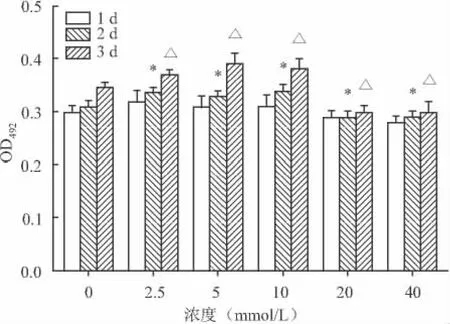
图2 不同浓度氯化锂对大鼠ADSCs增殖的影响(n=3,±s)
表2 不同浓度氯化锂对大鼠脂肪干细胞AKP活性的影响(n=3,±s)

表2 不同浓度氯化锂对大鼠脂肪干细胞AKP活性的影响(n=3,±s)
与对照组(0 mmol/L)比较:*P<0.05
氯化锂(mmol/L) AKP活性(U/100 ml)2.330 ±0.520 2.5 2.903 ±0.527 5 4.616 ±0.732*10 3.346 ±0.629*20 2.070 ±0.585 40 1.443 ±0.130 0*
2.3 AKP活性检测 大鼠ADSCs经过氯化锂处理7 d后检测,与对照组比较,5、10 mmol/L组对细胞AKP活性的促进作用较显著。见表2。
2.4 RT-PCR 检测 与对照组比较,β-catenin的mRNA表达量随着氯化锂浓度的升高而上升(F=64.74)。GSK-3β的mRNA表达量随着氯化锂浓度的升高而降低(F=47.51)。AKP mRNA表达在5 mmol/L组时最高,随后依次下降(F=68.83)。见图3。
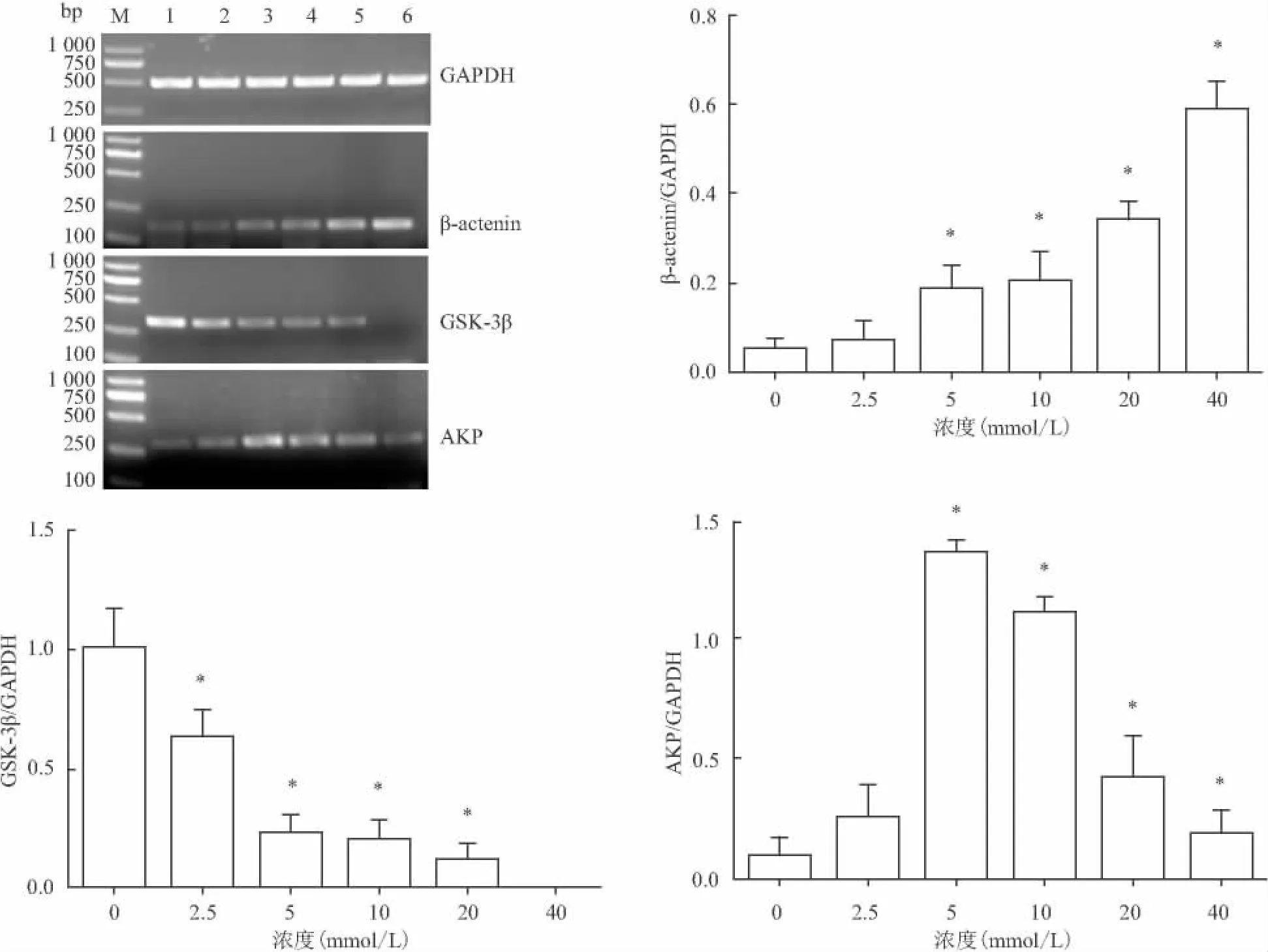
图3 不同浓度氯化锂作用ADSCs 7 d后mRNA的表达
3 讨论
脂肪干细胞被认为是牙周组织再生技术中具有重大潜力的干细胞之一,因其有取材便利,储量大,低免疫原性,自身可分泌多种生长因子等多个优势[4]。干细胞体外增殖和成骨向分化在不同成骨阶段涉及多个信号通路的调节,其中包括Wnt/βcatenin信号通路、丝裂原活化蛋白激酶途径、Notch信号通路途径、骨形态发生蛋白途径等[5-6]。Wnt/β-catenin途径是研究较多的经典Wnt信号转导途径,Wnt信号配体可以同跨膜蛋白低密度脂蛋白受体相关蛋白5/6以及细胞膜上七次跨膜的卷曲蛋白受体(Frizzled、Fzd)结合,随后Fzd胞内区域作用于蓬松蛋白(Dishevelled、Dsh或Dvl),Dvl的活化可抑制由细胞支架蛋白Axin、GSK-3β、腺瘤样结肠息肉病基因(adenomatous polyposis coli,APC)编码的蛋白组成的降解复合体对β-catenin的磷酸化,避免其降解,让β-catenin在细胞质中稳定积累,随后进入细胞核内激活转录因子(T-cell-specific transcription factor,TCF)/淋巴增强因子(lymphoid enhancing factor,LEF),形成 β-catenin-TCF/LEF 二聚体,从而激活下游靶基因如AKP转录与表达,此时信号通路被激活[7]。
氯化锂是被广泛应用的GSK-3β无机离子抑制剂,能通过抑制钾的丢失或者与镁竞争,使丝氨酸N端结构域被磷酸化,抑制 GSK3β 的活性[8],阻止Axin-APC-GSK-3β降解复合体的形成,促使β-catenin在细胞质内大量聚集从而激活通路[7]。氯化锂能通过经典的Wnt/β-catenin信号通路促进人视网膜母细胞瘤细胞系细胞和人骨髓来源间充质干细胞的增殖[6,9]。本研究显示氯化锂对增殖的影响是具有剂量依赖性的,ADSCs在2.5~10 mmol/L浓度作用时促进细胞增殖,而作用的浓度升高时(20、40 mmol/L)对细胞具有毒性,抑制增殖。40 mmol/L时细胞不仅增殖缓慢,形态也发生变化,不是呈长梭形而是向周围伸展,并且变得较扁平,细胞之间接触松散不紧密。说明可以选择2.5~10 mmol/L的氯化锂,对脂肪干细胞增殖具有促进作用。
AKP是早期成骨分化的特异性标志物[10]。AKP活性检测结果表明5、10 mmol/L氯化锂能够有效提高细胞AKP的活性。早期研究[11]显示在小鼠多能干细胞系C3H10T1/2细胞中,氯化锂能通过活化内源性的 β-catenin或者异位表达稳定的βcatenin来激活 Wnt/β-catenin信号通路,诱导 AKP mRNA的表达,在成骨前体细胞和成骨细胞增殖和分化中发挥作用。在大鼠和人的骨髓间充质干细胞中也能促进细胞成骨向分化[12-13]。Han et al[10]使用氯化锂活化Wnt/β-catenin信号通路能促进牙周膜干细胞中AKP、OPN基因的表达。根据这些研究结果,本实验选择氯化锂作为有效激活Wnt/β-catenin信号通路的激活剂,来观察不同浓度氯化锂对大鼠ADSCs成骨向分化的作用。RT-PCR实验结果显示随着氯化锂浓度增高,GSK-3β的mRNA表达量逐渐减少,β-catenin的mRNA表达量增加,说明氯化锂有效抑制了GSK-3β对于β-catenin的磷酸化,激活了Wnt/β-catenin信号通路。AKP的表达在5 mmol/L组最高,随后依次减少。实验结果说明氯化锂有效作用于Wnt/β-catenin信号通路,调控相关基因的表达并且具有剂量依赖性,可能由于氯化锂对GSK-3β具有双重抑制的作用而影响信号通路的激活,适当的部分抑制GSK-3β是有益处的,但是大量抑制其功能可能是具有毒性的[8,14]。
综上所述,氯化锂作为经典Wnt/β-catenin信号通路的激活剂,在ADSCs增殖和成骨向分化中起到重要作用,5 mmol/L的氯化锂可以作为同时促进ADSCs增殖和成骨向分化的适宜浓度,为今后牙周组织工程中骨再生研究提供了依据,但其作用的具体机制尚需进一步研究。
[1]Zuk P A,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Eng,2001,7(2):211-28.
[2]Vishnubalaji R,Al-Nbaheen M,Kandalmani B,et al.Comparative investigation of the differentiation capability of bone-marrowand adipose-derived mesenchymal stem cells by qualitative and quantitative analysis[J].Cell Tissue Res,2012,347(2):419-27.
[3]Logan C Y,Nusse R.The Wnt signaling pathway in development and disease[J].Annu Rev Cell Dev Biol,2004,20:781-810.
[4]Nakagami H,Maeda K,KanedaY,et al.Novel autologous cell therapy in ischemic limb disease through growth factors secretion by cultured adipose tissue-derived stromal cells[J].Arterioscler Thromb Vasc,2005,25(12):2542-7.
[5]Minear S,Leucht P,Jiang J,et al.Wnt proteins promote bone regeneration[J].Sci Transl Med,2010,2(29):29- 30.
[6]De Boer J,Wang H J,Van Blitterswijk C.Effects of Wnt signaling on proliferation and differentiation of human mesenchymal stem cells[J].Tissue Eng,2004,10(3- 4):393- 401.
[7]Davis L A,Zur Nieden N I.Mesodermal fate decision of a stem cell:the Wnt switch[J].Cell Mol Life Sci,2008,65(17):2658-47.
[8]Jope R S.Lithium and GSK-3:one inhibitor,two inhibitory actions,multiple outcomes[J].Trends Pharmacol Sci,2003,24(9):441-3.
[9]Silva A K,Yi H,Hayes S H,et al.Lithium chloride regulates the proliferation of stem-like cells in retinoblastoma cell lines:a potential role for thecanonical Wnt signaling pathway[J].Mol Vis,2010,16:36-45.
[10]Han P,Wu C,Chang J,et al.The cementogenic differentiation of periodontal ligament cellsviathe activation of Wnt/β-catenin signallingpathway by Li+ions released from bioactive scaffolds[J].Biomaterials,2012,33(27):6370-9.
[11]Bain G,Müller T,Wang X,et al.Activated beta-catenin induces osteoblast differentiation of C3H10T1/2 cells and participates in BMP2 mediated signal transduction[J].Biochem Biophys Res Commun,2003,301(1):84-91.
[12]Eslaminejad M B,Talkhabi M,Zeynali B.Effect of lithium chloride on proliferation and bone differentiation of rat marrow-derived mesenchymal stem cells in culture[J].Iran J Basic Med Sci,2008,11(3):143-51.
[13]Satija N K,Sharma D,Afrin F,et al.High throughput transcriptome profiling of lithium stimulated human mesenchymal stem cells reveals priming towards osteoblastic lineage[J].PLoS One,2013,8(1):e55769.
[14]Grimes C A,Jope R S.The multifaceted roles of glycogen synthase kinase 3beta in cellular signaling[J].Prog Neurobiol,2001,65(4):391-426.
Effect of Lithium chloride mediated canonical Wnt/β-catenin signaling on proliferation and osteogenic differentiation of rat adiposed-derived stem cells
Zhao Xuan,Xu Yan,Zheng Guiting,et al
(Dept of Periodontal Oral Medicine,Stomatologic Hospital of Anhui Medical University,Key Lab of Oral Diseases Research of Anhui Province,Hefei230032)
ObjectiveTo investigate the effect of different concentrations of Lithium chloride on proliferation and osteogenic differentiation of rat adiposed-derived stem cell(ADSCs)in vitroculture and its possible mechanism.Methods① The ADSCs were harvested from the fat pad in the groin of 3-week-old rats,then maintained in Dulbecco's modified Eagle's medium supplemented with 10%fetal bovine serum after digesting with 0.1%collagenase type Ⅰ.ADSCs were exposed to Lithium chloride at 0,2.5,5,10,20,40 mmol/L for 24,48 and 72 hours.The effect of Lithium chloride on cells proliferation was determined by MTT assay.② Alkaline phosphatase(AKP)activity in cells was detected after ADSCs cultured for 7 days in osteogenic differentiation medium in 2.5,5,10,20,40 mmol/L or with no Lithium chloride.③ The ADSCs were treated with different concentrations of Lithium chloride for 7 days after treating with osteogenic differentiation medium for 3 days,and the expressions of β-catenin,glycogen synthase kinase-3β,AKP were detected by using RT-PCR method.ResultsIn vitro,low doses of Lithium chloride(2.5,5 and 10 mmol/L)sitimulated ADSCs proliferation,whereas high doses caused a inhibition of proliferation.5 and 10 mmol/L Lithium chloride induce AKP activity in ADSCs which were induced the differentiation towards osteolasts,however 40 mmol/L significantly inhibited AKP activity.Meanwhile,Lithium chloride upregulated the expression of β-catenin and AKP.ConclusionIn vitro,Lithium chloride has a dual effect on ADSCs proliferation,and it improves AKP activity as well as promoting osteogenic differentiation in a dose-dependent manner.5 mmol/L Lithium chloride can be used as the optimum concentration for stimulating cell proliferation and promoting osteogenic differentiation in rat ADSCs.
Wnt/β-catenin signaling pathway;adiposed-derived stem cell;Lithium chloride;proliferation;osteogenic differentiation
R 781.4
A
1000-1492(2014)05-0590-05
2014-01-05接收
安徽省自然科学基金(编号:1308085MH130)
1安徽医科大学口腔医学院,安徽医科大学附属口腔医院,安徽医科大学附属省口腔医院牙周黏膜科,安徽省口腔疾病研究中心实验室,合肥 230032
2安徽省病原生物学省级实验室和人兽共患病安徽省重点实验室,合肥 230032
赵 璇,女,硕士研究生;
徐 燕,女,教授,副主任医师,硕士生导师,责任作者,E-mail:173236344@qq.com

