巯嘌呤甲基转移酶基因多态性对成人急性淋巴细胞白血病6-MP治疗个体化的意义
葛 健,夏瑞祥,杨明珍,夏海龙,王永庆,曾庆曙
巯嘌呤甲基转移酶基因多态性对成人急性淋巴细胞白血病6-MP治疗个体化的意义
葛 健,夏瑞祥,杨明珍,夏海龙,王永庆,曾庆曙
目的 检测使用6-巯基嘌呤(6-MP)维持治疗的成人急性淋巴细胞白血病(ALL)患者巯嘌呤甲基转移酶(TPMT)基因型和酶活性,并应用至临床以指导6-MP维持治疗。方法 提取白细胞基因组DNA,以PCR结合限制性片断长度多态性(PCR-RFLP)等技术检测TPMT基因型;以高效液相色谱法(HPLC)检测TPMT酶活性,对使用6-MP和甲氨蝶呤(MTX)维持化疗的69例成人ALL患者,监测化疗药物的临床和血液学毒性。结果 69例成人ALL患者中有4例酶活性较低的TPMT*1/*3C杂合子,未发现TPMT*2、TPMT*3A、TPMT*3B。成人ALL患者使用6-MP治疗后,TPMT酶活性较治疗前上升。TPMT突变型组与野生型组观察到的临床药物毒性反应相近,但前者维持治疗期间6-MP的使用量明显低于后者[42.17 mg/(m2·d)和69.36 mg/(m2·d),P<0.01]。结论 TPMT基因多态性对6-MP治疗的药物毒性有实质性影响。成人ALL患者使用6-MP治疗前监测TPMT基因型和活性,有助于减少6-MP药物不良反应,实现临床治疗个体化。
巯嘌呤甲基转移酶;急性淋巴细胞白血病;6-巯嘌呤;基因多态性;维持治疗
夏瑞祥,男,教授,主任医师,博士生导师,责任作者,E-mail:xrx2041@163.com
6-巯基嘌呤(6-mercaptopurine,6-MP)是成人急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)维持治疗中广泛应用的巯嘌呤类药物,在体内经过代谢转变为巯嘌呤核苷酸(thioguanine nucleotides,TGNs),通过后者产生细胞毒作用;巯嘌呤甲基转移酶(thiopurine S-methyltransferase,TPMT)是一种通过催化6-巯嘌呤S-甲基化、减少TGNs生成的胞质酶[1]。TPMT存在基因多态性,目前发现有24种和TPMT酶活性降低相关的突变型等位基因,最重要的4 种TPMT*2、TPMT*3A、TPMT*3B、TPMT*3C涵盖了人群中95%的低及中等活性[2]。中国汉族人也存在TPMT基因多态性,TPMT*3C是其最主要的突变型等位基因[3]。TPMT缺乏(或低活性)的儿童ALL患者因红细胞内TGNs浓度过高而对标准剂量6-MP不耐受[1]。该研究旨在探讨汉族成人ALL患者进行6-MP治疗时的耐受性,以及在6-MP治疗前进行TPMT活性和基因型检测对化疗个体化的临床意义。
1 材料与方法
1.1 病例资料 ALL患者来自安徽医科大学第一附属医院血液内科,均为汉族,年龄均>18岁,经细胞形态学、免疫学和细胞遗传学(MIC)分析明确诊断。初诊成人ALL患者以DVP(或IVP)方案诱导化疗,达完全缓解后,对于没有合适供者无法行造血干细胞移植的患者,予以强化治疗[方案1:大剂量甲氨蝶呤(HD-MTX)+VM26 与 VM26+Ara-c+NVT两者交替进行共6疗程;方案2:HyperCVAD/MA方案6疗程]。强化治疗间歇期及强化治疗后,予以标准剂量6-MP每日75 mg/m2和MTX每周20 mg/m2联合口服维持治疗。最初入选90例,最终在维持治疗期间接受试验观察的患者共69例(患者均知情同意,并坚持维持治疗至少6个月)。另有12例患者6个月内疾病复发,9例患者选择脐血干细胞移植或其他治疗方案退出观察。
1.2 仪器与试剂 蛋白酶K购自德国MERCK公司;TaqDNA聚合酶以及dNTPs购自上海华美生物工程公司;限制性内切酶AccⅠ购自大连宝生物公司;MwoⅠ购自美国NEB公司;常用化学试剂均为国产分析纯级别;600E高效液相色谱仪、2996 PAD紫外检测器、Empower Pro色谱数据工作站(美国Waters公司)。
1.3 DNA提取和TPMT基因型检测 从肝素抗凝的成人ALL患者外周血分离单个核细胞,余红细胞裂解冻存,采用酚/氯仿抽提法提取成人ALL患者基因组 DNA。采用等位基因特异性 PCR(ASPCR)和PCR结合限制性片断长度多态性(PCRRFLP)技术对接受试验观察的成人ALL患者TPMT*2(G238C)、TPMT*3A(G460A/A719G)、TPMT*3B(G460A)和TPMT*3C(A719G)的等位基因频率进行分析,具体步骤参照之前的研究[3]。
1.4 TPMT活性检测 应用前期建立的HPLC方法[4],检测成人ALL患者初次接受化疗前外周血红细胞中TPMT的活性。具体是将6-MP加入红细胞裂解液中,利用 S-腺苷-L-甲硫氨酸提供甲基,经过孵育,6-MP 转化为 6-甲基巯基嘌呤(6-methylmercatopurine,6-MeMP)。以高效液相色谱法(HPLC)检测6-MeMP生成量。TPMT的活性(U/ml PRBC)用37℃孵育时,每毫升红细胞每小时生成的6-MeMP量(nmol)来计算。为研究维持治疗前后TPMT活性的变化,随机选取30例患者,检测其治疗前与治疗开始后(6-MP维持治疗2周之后)血红细胞中TPMT的活性。
1.5 维持治疗期间药物剂量调整方案及药物毒性观察指标
1.5.1 基因型指导6-MP起始用量 进行维持治疗的成人ALL患者以TPMT基因型指导6-MP起始用量,具体为:TPMT野生型使用足量(75 mg/m2)起始,纯合子突变型使用10%起始量(7.5 mg/m2),杂合子突变型使用50%起始量(37.5 mg/m2)。
1.5.2 白细胞计数指导6-MP剂量调整 维持治疗在强化治疗间歇期及强化治疗后进行,治疗过程中6-MP用量参照白细胞、中性粒细胞计数调整。每2周检测1次血常规,以了解是否发生骨髓抑制,并予以调整6-MP剂量,保持白细胞计数(total leukocyte count,TLC)在(2.0~3.0)×109/L范围,中性粒细胞绝对数(absolute neutrophil count,ANC)在(1.0~1.5)×109/L范围。强化治疗需等粒细胞计数恢复后进行。药物剂量调整方案如下:①当外周血TLC<2.0×109/L(ANC <1.0×109/L),减少维持药物总量的50%。②当外周血TLC<1.0×109/L(ANC <0.5×109/L)时,暂停维持治疗。等待TLC/ANC恢复正常时,再次给予6-MP治疗(以总药量的50%、75%、100%的给药过程逐周递增),根据TLC/ANC调整6-MP至合适剂量。③ 如出现血小板(PLT)<50×109/L、黏膜炎、发热或肝毒性≥Ⅱ度等其他毒性反应时,予减量或暂停维持化疗。④ 足量使用6-MP(75 mg/m2)后,如 TLC>3.0×109/L,不予增量使用。⑤ 除非前述严重药物毒性导致维持治疗停止,MTX剂量维持不变。
1.5.3 药物毒性观察指标 患者维持治疗过程中观察和记录以下指标进行分析:血常规(TLC/ANC/Hb/PLT)与生化指标(肝、肾功能);药物毒副反应评价参考抗癌药物不良反应的WHO分度标准(如黏膜炎、药物性发热、骨髓抑制等);TPMT基因型;6-MP和MTX药物剂量。其中,每位患者的6-MP处方剂量的均数被定义为治疗期间每平方米体表面积药物剂量的总和除以总的维持化疗的天数。随后,各组患者使用6-MP剂量的均数得以计算。
1.6 统计学处理 使用SPSS 13.0软件进行数据分析,计量资料以±s表示,组间比较采用t检验;两种基因型之间的定性资料比较采用χ2检验。
2 结果
2.1 成人ALL患者TPMT基因型 对接受观察的69例成人ALL患者进行TPMT*1(野生型)、TPMT*2、TPMT*3(A-C)检测,共检测到 TPMT*3C突变型(A719G)杂合子(TPMT*1/*3C)4例(图1所示扩增产物长373 bp,被AccⅠ酶切后得到373、283、90 bp 3个片段),余65例为野生型纯合子(TPMT*1/*1),未发现TPMT*3C纯合子(TPMT*3C/*3C)、TPMT*2、TPMT*3A 和 TPMT*3B。

图1 TPMT*3C突变型杂合子电泳分析结果
2.2 成人ALL患者初次诊断时TPMT活性 4例TPMT*3C杂合子(TPMT*1/*3C)ALL患者TPMT平均酶活性为(7.25±1.22)U/ml PRBC,而65例野生型TPMT基因纯合子(TPMT*1/*1)ALL患者平均活性为(13.40±2.57)U/ml PRBC。TPMT*1/*3C成人ALL患者TPMT平均酶活性低于TPMT*1/*1患者(P<0.01)。见图2。
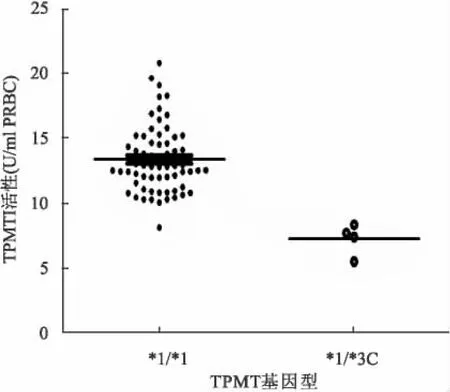
图2 不同基因型ALL患者TPMT活性
2.3 成人ALL患者6-MP维持治疗前后TPMT活性变化 随机抽取的30例成人ALL患者未治疗前(初次诊断)TPMT平均活性为(13.59±2.56)U/ml PRBC;服用6-MP等药物维持治疗开始后2周TPMT平均活性为(16.81±3.19)U/ml PRBC。成人ALL患者使用6-MP维持治疗后TPMT平均酶活性高于治疗前(P<0.01)。
2.4 维持治疗中6-MP剂量个体化调整及毒性观察 对TPMT*3C杂合子组的4例成人ALL患者,仅给予50%剂量6-MP起始维持治疗2周后,均出现不同程度骨髓抑制(发生率100%,表现为外周血TLC、ANC减少)。其中1例发生粒细胞缺乏合并肺部感染,减量至停用6-MP。血象恢复后再次按药物剂量调整方案先使用50%剂量6-MP治疗,仍因迅速发生严重血液学毒性无法耐受停药,后经调整仅能耐受20%剂量6-MP维持治疗;余3例患者可耐受50%剂量6-MP,按药物调整方案加量至100%量6-MP治疗,但均因血液学毒性无法耐受100%量,再次减至50%剂量维持治疗。65例使用100%量6-MP起始维持治疗的TPMT*1纯合子组ALL患者中,20例出现骨髓抑制(发生率30.8%),其中有7例无法耐受足量6-MP治疗,根据白细胞计数调整为50%量后长期维持治疗。两组患者能够耐受100%足量6-MP化疗的人数有明显差异(P<0.01),见表1。治疗中MTX始终予以足量。两组患者维持治疗中TLC及ANC均数无明显差异(P>0.05),见表1。两组TLC及ANC平均数均高于方案设计时的骨髓抑制目标[维持TLC在(2.0~3.0)×109/L;ANC在(1.0~1.5)×109/L]。但TPMT*3C杂合子组患者6-MP维持治疗平均剂量[42.17±5.92 mg/(m2·d)]明显低于TPMT*1纯合子组[(69.36±10.57)mg/(m2·d)](P<0.01),见表1。
对两组患者维持治疗期间的其它常见化疗药物毒副反应(如感染、肝损、药物性发热、黏膜炎、呕吐及腹泻等)发生率进行观察,差异均无统计学意义(P>0.05),见表1。
表1 成人ALL患者维持治疗中临床资料比较(±s)

表1 成人ALL患者维持治疗中临床资料比较(±s)
TPMT项目 基因型*1/*3C(n=4)*1/*1(n=65)P值2/2 36/29 0.758年龄(岁) 34.0±19.1 30.3±13.2 0.594足量6-MP化疗例数 0 58 <0.010 TLC均数(×109/L) 3.20±0.18 3.32±0.47 0.597 ANC均数(×109/L) 1.68±0.27 1.77±0.37 0.627 6-MP剂量[mg/(m2·d)]42.17±5.92 69.36±10.57 <0.010感染≥2级(n) 1 4 0.265肝损伤≥2级(n) 1 8 0.436药物性发热(n) 0 2 1.000黏膜炎(n) 1 7 0.396呕吐(n) 1 6 0.355腹泻(n)性别(男/女)0 5 1.000
3 讨论
6-MP和硫唑嘌呤等巯嘌呤类药物一直用于治疗ALL、自身免疫性疾病和器官移植受者。6-MP和硫唑嘌呤均为无活性的药物前体,须在体内代谢为TGNs,以发挥细胞毒性。6-MP的另一重要代谢途径是由TPMT催化的甲基化反应合成无活性的6-MeMP,这一途径减少了 TGNs的合成[5]。TPMT 存在遗传多态性,至少发现24种突变型等位基因和TPMT酶活性降低相关[2-3]。个体如存在2个突变型等位基因会出现TPMT酶活性缺失,人群中约10%因存在一种突变型杂合子而导致TPMT酶活性降低[3]。研究[1]显示TPMT缺失的患者服用标准剂量6-MP后,因为生成过多TGNs导致严重的血液学毒性,这些患者仅需使用6-MP标准剂量的1/10进行治疗。
对于中等TPMT酶活性的突变型杂合子患者,使用6-MP维持治疗是否需要调整起始药物剂量,之前尚无研究论证。本研究和之前的研究[3]显示中国健康汉族人也存在TPMT基因多态性,TPMT*3C杂合子突变(TPMT*1/*3C)是中国健康汉族人和成人ALL患者最主要的突变型等位基因。本研究显示TPMT*1/*3C成人ALL患者TPMT酶活性低于TPMT*1/*1,提示TPMT*1/*3C患者酶活性和基因型具有相关性。TPMT*1/*3C组患者在使用了50%起始量6-MP作为起始维持化疗量后,仍出现明显骨髓抑制。且TPMT*1/*3C组能够耐受的6-MP维持治疗平均剂量明显低于TPMT*1/*1组,这提示杂合子成人ALL患者较野生型更不耐受6-MP毒性而难以完成标准剂量化疗。这与 Vannaprasaht et al[6]的研究一致,该研究报道TPMT*1/*3C杂合子突变型的肾移植患者,使用硫唑嘌呤治疗导致骨髓抑制的风险明显高于野生型患者。本研究显示,成人ALL患者在开始6-MP维持治疗前均需检测TPMT基因型,根据基因型调整6-MP起始用药剂量会减少临床治疗过程中药物毒副反应。
本研究中,6-MP后续维持治疗剂量是根据血常规检测中TLC/ANC数据进行调整,期望达到轻度骨髓抑制。最终两组TLC及ANC平均数均高于方案设计时的骨髓抑制目标,可能因为临床医师在维持治疗门诊给药中尽力避免粒细胞严重减少和感染。两组患者治疗过程中TLC/ANC平均数相近,这解释了两组患者(除初始血液学毒性外)其他化疗药物毒副反应发生率相近的原因,也使得可以比较两组对于6-MP用量的耐受性。TPMT*1/*3C组能够耐受的6-MP平均剂量[42.17 mg/(m2·d)]远远低于TPMT*1/*1组[69.36 mg/(m2·d),P<0.01],提示杂合子突变组使用较低的药物剂量也可达到野生型组骨髓抑制程度,也印证了药物基因组学研究和应用在现代化疗中的意义。
Fakhoury et al[7]发现,儿童 ALL 患者 TPMT 酶活性在维持治疗开始后会较治疗前明显上升。本研究显示,成人ALL患者TPMT酶活性在初次诊断时与基因型存在相关性,而在6-MP维持治疗后较前上升。Lennard et al[8]研究认为ALL患者经过诱导缓解化疗后的造血恢复过程,造血生成更多相对“年轻”的红细胞;后者TPMT酶活性比“成熟”的红细胞高。患者在化疗过程中的输血治疗也会对TPMT 活性有影响。而 Wennerstrand et al[9]的研究认为,大剂量的 MTX通过蛋白结合过程,会使TPMT酶活性短期内迅速降低。正因为TPMT活性在6-MP治疗前后会发生变化,应以治疗前TPMT酶活性结果判断6-MP可能的不良反应。
与检测患者TPMT基因型比较,酶活性的检测过程复杂,花费较大,且酶活性易受多种因素干扰发生变化。在本研究中,ALL患者初次诊断时简单的基因型检测能够可靠的预知酶活性。因此,对于成人ALL患者使用6-MP维持治疗,推荐以初次治疗前的基因型结果制定起始6-MP治疗的用量,结合6-MP治疗后药物毒性监测结果调整后续用量,以期达到治疗用药个体化。
[1]Relling M V,Gardner E E,Sandborn W J,et al.Clinical Pharmacogenetics Implementation Consortium guidelines for thiopurine methyltransferase genotype and thiopurine dosing[J].Clin Pharmacol Ther,2011,89(3):387-91.
[2]Albayrak M,Konyssova U,Kaya Z,et al.Thiopurine methyltransferase polymorphisms and mercaptopurine tolerance in Turkish children with acute lymphoblastic leukemia[J].Cancer Chemother Pharmacol,2011,68(5):1155-9.
[3]葛 健,夏瑞祥,卜丽佳,等.成人急性淋巴细胞白血病巯嘌呤甲基转移酶基因多态性研究[J].安徽医科大学学报,2006,41(2):185-8.
[4]葛 健,夏瑞祥,曾庆曙,等.高效液相色谱法测定急性淋巴细胞白血病患者巯嘌呤甲基转移酶活性[J].中国医院药学杂志,2006,26(5):520-2.
[5]Adam de Beaumais T,Fakhoury M,Medard Y,et al.Determinants of mercaptopurine toxicity in paediatric acute lymphoblastic leukemia maintenance therapy[J].Br J Clin Pharmacol,2011,71(4):575-84.
[6]Vannaprasaht S,Angsuthum S,Avihingsanon Y,et al.Impact of the heterozygous TPMT*1/*3C genotype on azathioprine-induced myelosuppression in kidney transplant recipients in Thailand[J].Clin Ther,2009,31(7):1524- 33.
[7]Fakhoury M,Andreu-Gallien J,Mahr A,et al.Should TPMT genotype and activity be used to monitor 6-mercaptopurine treatment in children with acute lymphoblastic leukaemia?[J].J Clin Pharm Ther,2007,32(6):633-9.
[8]Lennard L,Cartwright C S,Wade R,et al.Thiopurine methyltransferase genotype-phenotype discordance and thiopurine active metabolite formation in childhood acute lymphoblastic leukaemia[J].Br J Clin Pharmacol,2013,76(1):125- 36.
[9]Wennerstrand P,Mårtensson L G,Söderhäll S,et al.Methotrexate binds to recombinant thiopurine S-methyltransferase and inhibits enzyme activity after high-dose infusions in childhood leukaemia[J].Eur J Clin Pharmacol,2013,69(9):1641- 9.
Significance of TPMT gene polymorphism for individualizing 6-MP chemotherapy in adults with acute lymphoblastic leukemia
Ge Jian,Xia Ruixiang,Yang Mingzhen,et al
(Dept of Hematology,The First Affiliated Hospital of Anhui Medical University,Hefei230022)
ObjectiveTo observe thiopurine S-methyltransferase(TPMT)genotype and phenotype in adult patients with acute lymphoblastic leukemia(ALL)who had been given maintenance treatment with 6-mercaptopurine(6-MP)and to assess their clinical management for individualizing 6-MP chemotherapy.MethodsGenomic DNA was extracted from peripheral blood leukocytes.PCR-restriction fragment length polymorphism(RFLP)technique was used to determine the TPMT genotype.TPMT activity was quantitated by reversed-phase high-performance liquid chromatography(HPLC)assay.Clinical and hematological toxicities were detected during the first 6 months of maintenance therapy with oral 6-MP and methotrexate(MTX)in the 69 adults with ALL.ResultsThe heterozygous TPMT*1/*3C genotype with low activity was found in 4 of the 69 adults with ALL;TPMT*2,TPMT*3A and TPMT*3B were not.We found a higher TPMT activity during maintenance treatment with 6-MP than at diagnosis.The median 6-mercaptopurine dose administered during the maintenance therapy was lower among patients with heterozygous TPMT alleles versus the rest[2.17 mg/(m2·d)and 69.36 mg/(m2·d),P<0.01],though the clinical toxicities were similar in both groups.ConclusionTPMT gene polymorphism has a substantial impact on mercaptopurine toxicity.Identification of TPMT genotype and activity appears to be important in making the ALL treatment less toxic and individualizing 6-MP chemotherapy.
thiopurine methyltransferase;acute lymphocytic leukemia;6-mercatopurine;genetic polymorphism;main tenance treatment
R 733.71;R 979.1;R 394.6
A
1000-1492(2014)05-0665-05
2013-12-20接收
国家自然科学基金(编号:81200371);高等学校博士学科点专项科研基金联合资助课题(新教师类联合,编号:20123420120011);安徽省自然科学基金(编号:1208085QH154、1308085MH157)
安徽医科大学第一附属医院血液内科,合肥 230022
葛 健,男,博士,副主任医师;

