膀胱尿路上皮癌术后吉西他滨联合顺铂辅助化疗的疗效分析
仓晨 郭剑明 林宗明 孙立安 戎瑞明 徐志兵 王杭 许明
(复旦大学附属中山医院泌尿外科,上海 200032)
膀胱癌是泌尿系统最为常见的恶性肿瘤,其中膀胱尿路上皮癌是其最常见的病理类型,约占膀胱癌的90%[1]。因膀胱癌容易复发,如何通过辅助治疗来降低膀胱癌患者术后复发率一直是泌尿外科的研究热点。膀胱尿路上皮癌细胞对铂类、吉西他滨、阿霉素及紫杉醇等化疗药物敏感。转移性膀胱尿路上皮癌患者对含铂类药物的联合化疗方案总体反应率可达50%[2]。我院从2012年2月开始应用吉西他滨联合顺铂(gemcitabine plus cisplatin,GC)方案对膀胱尿路上皮癌术后患者进行辅助化疗,现报告如下。
1 资料与方法
1.1 一般资料 选择2012年2月—2013年1月在我院接受经尿道膀胱肿瘤切除术(trans-urethral resection of bladder tumor,TURBT)、膀胱部分切除术或全膀胱切除术且病理证实为膀胱尿路上皮癌的TNM分期为T2-3N0-2M0的30例患者。患者术后接受2~6个疗程的GC化疗。30例患者平均年龄(61.26±7.63)岁,其中男性25例,女性5例;患者病理分级及分期资料见表1,其中6例接受TURBT,17例接受膀胱部分切除术,7例接受全膀胱切除术。
1.2 方法 化疗在术后1个月开始,采用21 d的GC方案,化疗第1、8天给予吉西他滨1.0 g/m2静脉滴注;化疗第2天起给予顺铂70 mg/m2,分2 d连续静脉滴注;每21 d重复。化疗期间每周监测血常规及肝肾功能,每3个月行影像学或膀胱镜检查,以评估肿瘤有无复发。
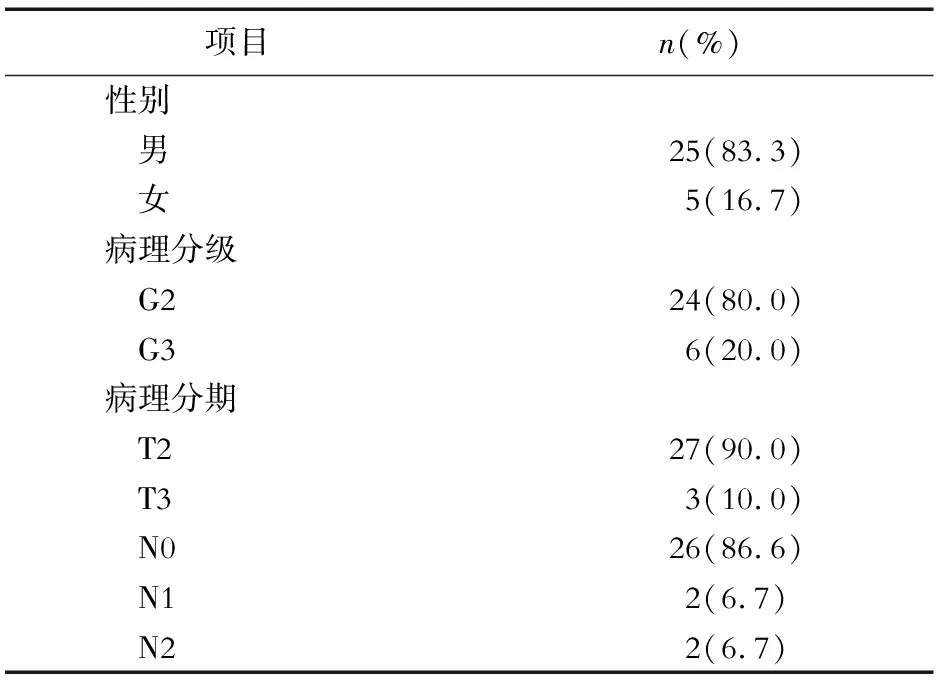
表1 患者病理分级及分期
2 结 果
30例患者均得到随访,随访至2013年8月,平均随访11.86个月;平均化疗4个疗程,无病死病例,仅1例临床证实肿瘤复发,复发率为3.33%。1例复发者为52岁男性患者,分期为T2G2N0M0,于2013年3月行膀胱部分切除术+输尿管膀胱再植术,术后给予4个疗程的GC方案辅助化疗,术后第16个月出现血尿,膀胱镜检查提示膀胱肿瘤复发。2例存在盆腔多发淋巴结转移(N2)的患者,化疗后1年内均未出现复发病灶。
化疗期间有13例(43.33%)患者出现白细胞下降,其中1级9例,2级4例,无3级以上白细胞下降。4例2级白细胞下降不良反应患者均接受6个疗程化疗;有17例(56.67%)患者出现恶心不良反应,其中1级13例,2级4例,无3~4级恶心不良反应出现。
3 讨 论
治疗膀胱尿路上皮癌的传统方案为氨甲喋呤、长春花碱、阿霉素和顺铂(MVAC)的四药联合化疗方案。多项临床试验[3-4]证明,该方案用于辅助和新辅助化疗都有良好的疗效。但是,MVAC方案不良反应较多。近年来,不良反应更小且疗效可靠的GC方案更多地被应用于临床。吉西他滨是一种新型的抗嘧啶核苷酸代谢化疗药物,与顺铂联用有协同作用。Von der Maase等[5]报告了GC方案比较MVAC方案治疗转移性膀胱尿路上皮癌的疗效,2种方案的化疗反应率相似,GC组为49%,MVAC组为46%;但GC组的毒性死亡率仅为1%,低于MVAC组的3%。Dash等[6]的一项回顾性研究显示,采用GC方案能降低肿瘤分期,并且GC方案在延长无病生存时间以及缩小或消灭残留灶方面与MVAC方案相似。
由于在转移性膀胱尿路上皮癌治疗中的良好疗效和安全性,GC方案逐渐成为膀胱癌治疗的一线化疗方案,但是对其在膀胱癌辅助治疗中的疗效尚未达成一致。我院从2012年2月开始将GC方案用于膀胱癌患者术后的辅助治疗,结果显示,1年效果良好,30例患者中仅1例复发,复发率3.33%;本研究中2例存在盆腔多发淋巴结转移(N2)的患者,化疗后1年内均未出现复发病灶,提示对于淋巴结转移患者,术后应用辅助GC方案化疗可减少复发。本研究30例患者无1例出现3级以上化疗相关不良反应,仅有8例出现2级不良反应(包括4例白细胞下降和4例恶心),体现了GC方案化疗的良好安全性。
综上所述,GC方案用于膀胱尿路上皮癌患者术后辅助化疗的安全性良好,且辅助化疗后,患者的复发率较低。
[1]Babjuk M,Oosterlinck W,Sylvester R,et al.EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder[J].Eur Urol,2008,54(2):303-314.
[2]von der Maase H,Sengelov L,Roberts JT,et al.Long-term survival results of a randomized trial comparing gemcitabine plus cisplatin,with methotrexate,vinblastine,doxorubicin,plus cisplatin in patients with bladder cancer[J].J Clin Oncol,2005,23(21):4602-4608.
[3]Grossman HB,Natale RB,Tangen CM,et al.Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer[J].N Engl J Med,2003,349(9):859-866.
[4]Stemberg CN,de Mulder PH,Schornagel JH,et al.Randomized phase III trial of high-dose-intensity methotrexate,vinblastine,doxorubicin,and cisplatin(MVAC)chemotherapy and recombinant human granulocyte colony-stimulating factor versus classic MVAC in advanced urothelial tract tumors:European Organization for Research and Treatment of Cancer Protocol no.30924[J].J Clin Oncol,2001.19(10):2638-2646.
[5]von der Maase H,Hansen SW,Roberts JT,et al.Gemcitabine and cisplatin versus methotrexate,vinblastine,doxorubicin,and cisplatin in advanced or metastatic bladder cancer:results of a large,randomized,multinational,multicenter,phase Ⅲ study[J].J Clin Oncol,2000,18(17):3068-3077.
[6]Dash A,Pettus JA 4th,Herr HW,et al.A role for neoadjuvant gemcitabine plus cisplatin in muscle-invasive urothelial carcinoma of the bladder:a retrospective experience[J].Cancer,2008,113(9):2471-2477.

