酵母菌发酵黄芪的抑菌作用初探
郭 羽,薛慧清,高 丽,岳晓华,刘必旺
(山西中医学院,山西太原030024)
黄芪是中医临床常用的传统滋补中药材,具有补气固表、利水消肿、托毒排脓、敛疮生肌的功效[1]。现代医学研究表明,黄芪含皂苷、黄酮、多糖以及多种氨基酸和微量元素等活性物质,具有增强机体免疫功能、抗衰老、抗肿瘤、抗病毒和较广泛的抗菌作用,对痢疾杆菌、炭疽杆菌、白喉杆菌、葡萄球菌、链球菌、肺炎双球菌等均有抗菌作用[2]。
中药发酵技术是在传统微生物发酵炮制的基础上,结合现代生物技术而形成的一种中药制药新技术,为中医药现代化研究和中药材资源的高效利用提供了新的思路[3]。以中药材为发酵基质,微生物细胞能够以其特有的酶系和代谢方式进行合成或转化,使某些活性成分的含量提高或产生新的活性物质,从而提高药效,节约资源。本研究以生长繁殖快、发酵能力强的酿酒酵母为发酵菌种,以黄芪为基质进行酵母菌发酵,研究经酵母菌转化的黄芪发酵液的抑菌活性,为黄芪的现代化研究提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 昆明种小鼠,雌雄各半,体重18 g~22 g,购自山西医科大学实验动物中心。
1.1.2 实验药材 黄芪药材购自产地山西应县,经山西中医学院实验管理中心尚彩玲老师鉴定为豆科植物蒙古黄芪,发酵前粉碎成65目粉末。发酵菌株:酿酒酵母(saccharomyces cerevisiae),由山西大学生物技术研究所惠赠;受试菌株:金黄色葡萄球菌(staphylococcus aureus)、大肠杆菌(escherichia coli)、肺炎链球菌(streptococcus pneumoniae)、绿脓杆菌(pseudomonas aeruginosa)、普通变形杆菌(proteus vulgaris)由山西医科大学第一附属医院提供。
1.1.3 试剂与仪器 营养肉汤培养基、营养琼脂培养基,杭州天和生物技术有限公司;青霉素、链霉素,上海生工。高压蒸汽灭菌器(山东新华医疗器械公司)、BBS-DSC超净工作台(上海巴艾贝斯有限公司)、THZ-D台式恒温振荡器(海门市林贝仪器制造有限公司)、离心机(安徽中科中佳仪器公司)、电子天平(德国Sartorius公司)、旋转蒸发仪(德国Heidolph公司)。
1.2 实验方法
1.2.1 黄芪酵母菌发酵液的制备及预处理 将低温保藏的酿酒酵母菌种斜面活化3次,液体摇瓶培养1次,作为液体种子备用。无菌条件下将10 g黄芪药材粉末加入100 mL豆芽汁培养基中,按10%接种量接入酵母菌液体种子,28℃、150 r/min,恒温振荡培养7 d。发酵液8000 r/min离心15 min,取上清液,经抽滤后置于旋蒸仪上浓缩,过滤除菌,分别配成质量浓度为0.1 g/mL,1.0 g/mL,2.5 g/mL的药液备用。
1.2.2 体外抑菌实验
1.2.2.1 滤纸片扩散法测定 抑菌圈直径:将各受试菌于肉汤培养基中过夜培养,调节菌悬液浓度为1×106CFU/mL。实验分为青霉素对照组(2 g/L)、链霉素对照组(2 g/L)、黄芪水煎液组(1.0 g/mL)、酵母菌培养液组、黄芪发酵液低、中、高浓度组(0.1 g/mL,1.0 g/mL,2.5 g/mL)。用打孔器将普通定性滤纸打孔,制成直径为6 mm的圆形纸片,121℃、0.15 MPa灭菌15 min,烘干备用。用移液器吸取50 μL各组药液于无菌滤纸片上,反复吸收、干燥,制成含药纸片,备用。吸取0.5 mL菌液均匀涂布于琼脂平板上,将各组含药滤纸片贴于培养基表面,置于恒温培养箱中37℃培养24 h,每组药物平行重复5次实验,用游标卡尺测量抑菌环直径,取平均值[4-5]。
1.2.2.2 药物最小抑菌浓度(MIC)的测定 采用试管二倍稀释法[4,6]。取 10 支灭菌试管,依次编号,无菌操作。于每管先加入肉汤培养基2 mL,然后在1号试管中加入灭菌的黄芪发酵液(2.5 g/mL)2 mL,充分混匀后吸取2 mL放入2号试管,依次类推,药液依次被稀释为 1∶2,1∶4,1∶8……1∶256,即生药含量为1.250 g/mL,0.625 g/mL,0.313 g/mL,0.156 g/mL,0.078 g/mL,0.039 g/mL,0.020 g/mL,0.010 g/mL,第 9 管不加药液作为阳性对照,阴性对照管不加受试菌。将各受试菌接种于肉汤培养基中,37℃孵育8 h,用生理盐水稀释至1×10-3浓度,各菌株均取0.1 mL菌悬液,分别接种于含有不同浓度药液的试管和阳性对照管中,混匀,于37℃培养24 h,观察记录结果。以浊度为指标判断试管中是否有细菌生长。若肉汤浑浊,表示有细菌生长;若肉汤完全清亮,则无细菌生长。将无肉眼可见细菌生长的试管中的肉汤接种到营养琼脂平板上,若仍无细菌生长,则该试管药物浓度即为受试药物的最低抑菌浓度(MIC)。
1.2.3 体内抑菌实验
1.2.3.1 体内抑菌的预实验 将低温保藏的金黄色葡萄球菌试管斜面活化,接种于肉汤培养基,37℃过夜培养,过夜的肉汤培养物用肉汤作系列稀释成1×103CFU/mL,1×104CFU/mL,1×105CFU/mL,1×106CFU/mL,1×107CFU/mL的菌悬液。取小鼠50只,体重18 g~22 g,雌雄各半,随机分成5组,每组10只,将上述各浓度细菌悬液0.5 mL腹腔注射于小鼠,逐日观察各组小鼠死亡情况,记录3 d内的死亡数,选定使小鼠死亡率达80%(LD80)的菌液浓度为正式实验注射浓度。
1.2.3.2 体内抑制金黄色葡萄球菌的实验 18 g~22 g健康小鼠140只,随机分为空白对照组、细菌对照组、黄芪水煎液组(1 g/mL)、黄芪发酵液低(0.1 g/mL)、中(1 g/mL)、高(2.5 g/mL)浓度组、阳性对照药青霉素V钾片(0.98 g/kg)组7组,每组20只,雌雄各半。各实验组动物灌胃给予20 mL/kg相应药液,空白对照组、细菌对照组灌胃给予等量蒸馏水,连续给药7 d。将LD80金黄色葡萄球菌菌液0.5 mL/只腹腔注射感染小鼠,继续给药,记录3 d内小鼠死亡数,计算死亡率[7-8]。数据用SPSS13.0软件处理分析,各浓度药物与细菌对照组之间死亡率差异的比较采用χ2检验。
3 结果
3.1 对不同致病菌的抑制作用
结果见表1。
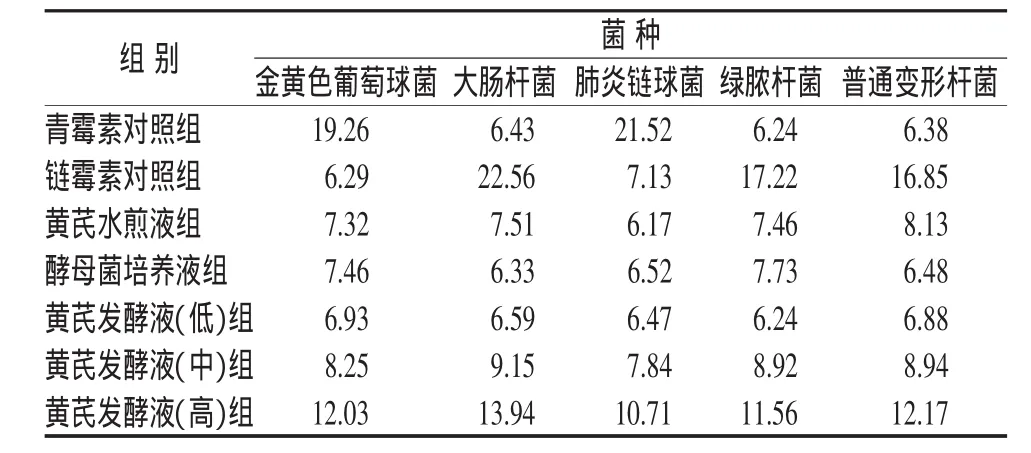
表1 滤纸片扩散法检测黄芪酵母菌发酵液的抑菌活性 (抑菌圈直径/mm)
由表1可知,阳性对照组青霉素对革兰氏阳性菌金黄色葡萄球菌和肺炎链球菌有较强的抑制作用;链霉素对革兰氏阴性菌大肠杆菌、绿脓杆菌和普通变形杆菌有较强的抑制作用。黄芪发酵液对5种致病菌均有一定抑制作用,并且随着浓度的升高,抑菌作用也逐渐增强。黄芪发酵液高浓度组对致病菌具有较强的抑制作用,与同浓度黄芪水煎液比较,抑菌圈直径增大。但参比酵母菌培养液组各致病菌抑菌圈的大小,表明黄芪酵母菌发酵液抑菌作用的增强,不是由单纯酵母菌自身代谢引起,而是酵母菌和黄芪共同作用的结果,推测可能是转化成分所致。
3.2 对金黄色葡萄球菌引起小鼠死亡的影响
腹腔注射金黄色葡萄球菌的浓度为1×105CFU/mL时,小鼠死亡率为80%,因此本实验采用浓度1×105CFU/mL为小鼠腹腔注射浓度。黄芪水煎液组、青霉素V钾片以及黄芪酵母菌发酵液低、中、高浓度均能提高感染小鼠的存活数,与细菌对照组比较小鼠死亡率显著降低(P<0.05,P<0.01),提示黄芪酵母菌发酵液有明显的抗感染作用,对金黄色葡萄球菌感染小鼠具有明显的保护作用。且黄芪发酵液组小鼠死亡率低于相同浓度黄芪水煎液组,与体外抑菌实验抑菌圈测定结果一致。结果见表2。
3.3 不同菌株的MIC测定结果
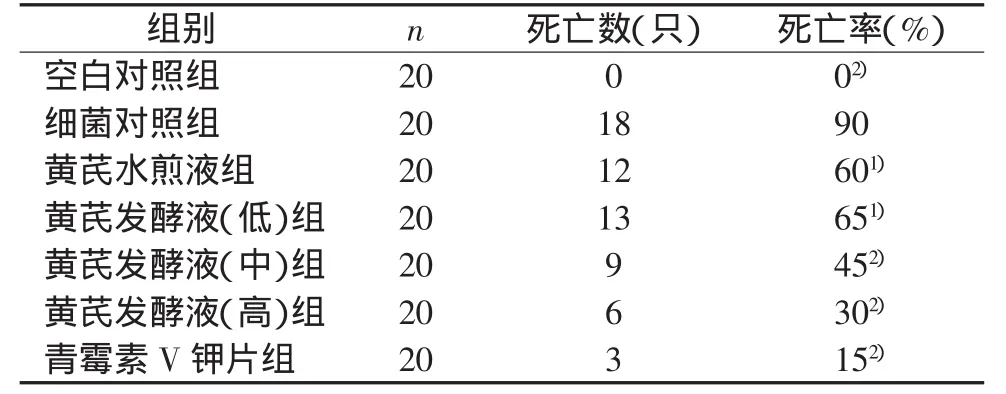
表2 黄芪发酵液对金黄色葡萄球菌致小鼠死亡的保护作用
黄芪酵母菌发酵液对金黄色葡萄球菌、大肠杆菌、肺炎链球菌、绿脓杆菌、普通变形杆菌的MIC分别为 0.313 g/mL,0.078 g/mL,0.625 g/mL,0.313 g/mL,0.156 g/mL。结果见表3。
4 讨论
黄芪的有效成分具有广谱抗病毒、抗细菌、抗真菌作用,同时,可增强与调节机体的免疫系统功能[9]。但近年来,随着黄芪用量的逐年增加,传统使用方法对药材的有效成分利用率较低,已不能满足当前的用药需求。中药发酵技术是现代生物技术与传统中医药研究的完美结合,已成为中药现代化研究的新热点。在发酵过程中,微生物可以中药材为营养源进行生长、分裂、代谢和繁殖,利用其自身特有的强大酶系和代谢途径,完成常规化学方法难以实现的生化反应;一些不能被人体直接利用的活性成分,通过生物转化,被修饰后可直接被人体吸收利用,从而进一步提高了药效。发酵后期的次生代谢产物有可能成为新的活性物质,使中药材产生新的预防、保健和治疗功能[10]。
酿酒酵母本身无毒,且培养条件简单,生长繁殖快,发酵能力强。因此,本研究以黄芪药材为基质进行酵母菌发酵,选取了临床常见的5种致病菌,从体外和体内两个途径考察了黄芪酵母菌发酵液对5种致病菌的抑制作用。滤纸片法测定致病菌抑菌圈直径的平行重复试验结果表明,酵母菌发酵液在体外对这些致病菌均有较好的抑制作用,并且抑菌作用随浓度升高而增强。体内实验表明,黄芪酵母菌发酵液对金黄色葡萄球菌引起的小鼠感染有明显的抗感染作用,体内、体外抑菌效果均优于同浓度的黄芪水煎液。推测可能是因为酵母菌在代谢过程中向胞外分泌蛋白酶、淀粉酶、纤维素酶、果胶酶等酶类进入到培养基,使黄芪细胞通透性增强、细胞间隙增加,从而使有效成分向胞外扩散的阻力减小而得以更多地释放出来发挥抑菌作用[11];或者酵母菌直接以黄芪成分为营养源,在发酵过程中产生了新的活性物质,抑或将无活性的底物转化成了有活性的物质。而且黄芪本身有调节机体免疫功能的作用,在体内可能通过提高自身免疫力杀灭致病菌[12]。本研究证实发酵后黄芪抑菌作用增强,但究竟是哪些有效成分或部位发生了变化,或何种成分被修饰转化,是否产生了新的活性成分,仍有待进一步研究。
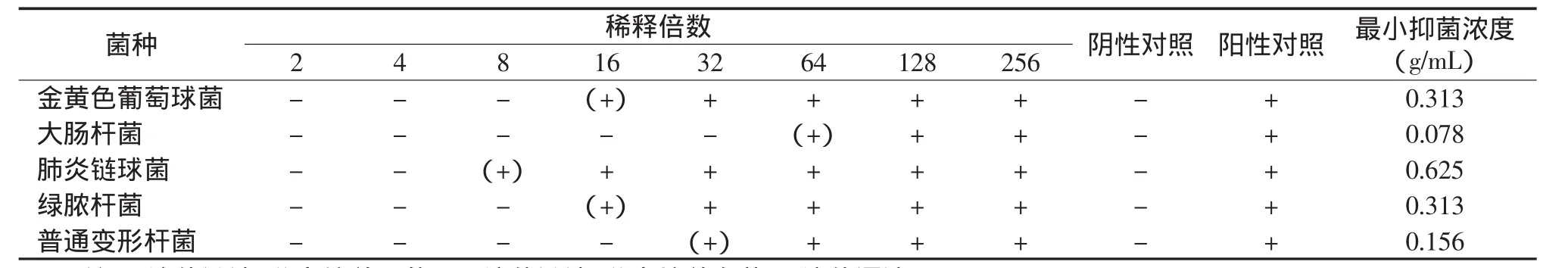
表3 黄芪酵母菌发酵液的最小抑菌浓度
[1]中华人民共和国药典委员会.中国药典[S].北京:中国医药科技出版社,2010:283.
[2]李淑芳.中药黄芪药理作用研究进展[J].湖北中医杂志,2010,35(3):73-75.
[3]姜良,赵长琦.中医药与微生态学[M].北京:化学工业出版社,2008:26-30.
[4]陈奇.中药药理研究方法学[M].2版.北京:人民卫生出版社,2006:263.
[5]尚彩玲,崔赟焱,薛慧清.老翘提取物的抑菌活性研究[J].时珍国医国药,2012,23(5):1139-1140.
[6]袁叶飞,邓家刚,胡祥宇,等.芒果苷单钠盐的抑菌作用研究[J].中国实验方剂学,2011,17(3):173-175.
[7]秦海宏,贾琳玉,阎建义,等.凤仙花水提物体外和体内的抑菌活性[J].吉林大学学报,2013,39(1):61-64.
[8]秦文艳,赵金明,齐越.射干提取物体内体外抑菌作用研究[J].中国实验方剂学杂志,2011,17(4):147-150.
[9]胡清宇.黄芪总苷的提取及药理作用的研究[J].科技信息:学术版,2006,169(5):237-238.
[10]喻春皓,张海红,张萍.中草药生物转化工程与中医药创新[J].亚太传统医药,2009,5(6):1-4.
[11]王兴红,李旗德,曹秋娥.微生物发酵中药应成为中药研究的新内容[J].中草药,2001,32(3):267.
[12]杨向竹,薛慧清,冯前进,等.黄芪糖蛋白对T淋巴细胞增殖活性的影响[J].上海中医药大学学报,2009,23(5):66-68.

