乙酰半胱氨酸辅助治疗慢性阻塞性肺疾病急性加重期患者的疗效及其对氧化应激、肺功能的影响
买尼沙木·亚生
(阿克苏职业技术学院,新疆 阿克苏,843000)
慢性阻塞性肺疾病(COPD)是在全球范围内发病率较高的慢性呼吸系统疾病,具有较高的致残率和致死率,该病好发于中老年人群,与肿瘤、心脑血管意外一起成为危害中老人群健康的主要致死性疾病[1]。COPD的发病不仅与患者的年龄有关,而且与吸烟、有害毒物或粉尘接触等环境因素均具有相关性[2]。COPD以持续进展的肺部气流受限为主要临床症状,COPD的急性加重(AECOPD)和COPD合并症的发病是威胁患者健康和生命的主要因素,当患者的通气功能受限症状较重时,患者可合并Ⅱ型呼吸衰竭,进而危及患者的生命安全[3]。有研究结果显示,COPD患者普遍存在氧化-抗氧化平衡的失调,氧化应激水平显著升高,而增强的氧化应激可引起肺动脉压升高、肺血管重塑,进而加速患者肺功能的损害进程。因此,抑制COPD患者的氧化应激对于提高治疗效果、改善患者肺功能、遏制病情的进展具有十分重要的作用[4]。本研究针对N-乙酰半胱氨酸(NAC)辅助治疗AECOPD患者的疗效及对氧化应激、肺功能的影响进行了观察和分析,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2012年1月—2013年6月本院呼吸内科收治的AECOPD患者100例,均符合中华医学会呼吸病学分会慢性阻塞性肺疾病学组于2007年修订的《慢性阻塞性肺疾病诊治指南》,纳入患者均出现呼吸困难、咳嗽加重、咳黏液脓性痰等症状,排除对本研究应用药物过敏及合并有肺结核、心律失常、心力衰竭、肺栓塞、胸腔积液等疾病的患者。其中,男59例,女41例,年龄55~82岁,平均(65.8±8.2)岁,病程4~27年,平均病程为(15.6±6.3)年。应用随机数字表将纳入患者分为观察组和对照组,每组50例。观察组中男29例,女21例,平均年龄为(64.1±7.9)岁,平均病程为(15.1±5.8)年;对照组中男30例,女20例,平均年龄为(66.3±7.5)岁,平均病程为(15.9±5.6)年。2组在性别构成、年龄、病程、临床症状严重程度等方面的差异均无统计学意义(P>0.05)。
1.2 治疗方法
2组患者均给予吸氧、β-受体阻滞剂吸入、抗感染等常规对症治疗措施,观察期间均不应用除本研究药物之外的镇咳、祛痰药物及糖皮质激素类药物,观察组在对症治疗的基础上加用NAC颗粒剂,用量为3次/d,200 mg/次,2组均以2周为一个疗程。
1.3 观察指标及疗效评价标准
对2组患者治疗前后的呼吸困难、咳嗽、咳脓痰量、肺部罗音情况进行观察和记录,并根据患者治疗前、后上述临床症状的变化情况进行疗效评价,评价标准为: ① 显效:治疗后咳嗽、咳痰、肺部罗音等症状显著减轻或消失; ② 有效:治疗后咳嗽、咳痰、肺部罗音等症状有所减轻; ③ 无效:治疗后咳嗽、咳痰、肺部罗音等症状无变化或加重,以疗效为“显效”或“有效”为临床有效;对2组患者治疗前后的第一秒钟用力呼气容积(FEV1)、第一秒钟用力呼吸容积占用力肺活量的比值(FEV1/FEC%)和FEV1占预计值百分比等肺功能指标进行检测和记录;采集2组患者的治疗前、后的清晨空腹肘静脉血标本,离心分离血清后置于-70 ℃冰箱中,应用比色法对血清标本中的谷胱甘肽硫转移酶(GSH-ST)活力、抑制羟自由基能力和抗超氧阴离子自由基能力等抗氧化应激指标进行检测和比较。
1.4 统计学处理
所有数据应用EXCEL建立数据库,应用SPSS 13.0统计软件包进行统计学分析,计量资料应用t检验进行处理,计数资料应用卡方检验进行处理,P<0.05为差异有统计学意义。
2 结 果
2.1 2组临床疗效的比较
经治疗,2组的临床有效率分别为94%和72%,观察组的临床有效率显著高于对照组(P<0.05),而且观察中疗效为“显效”的患者比例显著高于对照组(P<0.05),疗效为“有效”或“无效”的患者比例显著低于对照组(P<0.05),见表1。
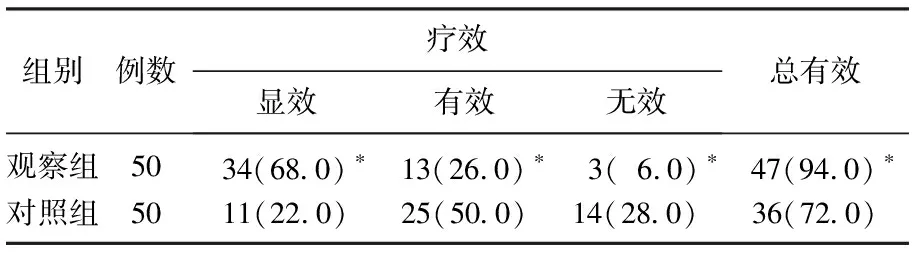
表1 2组临床疗效的比较[n(%)]
2.2 2组患者治疗前、后肺功能的比较
2组患者治疗前各项肺功能指标的差异无统计学意义(P>0.05); 经治疗,2组患者的各项肺功能指标均较治疗前显著提高(P<0.05),而且治疗后观察组患者的各项肺功能指标均显著高于对照组(P<0.05),见表2。
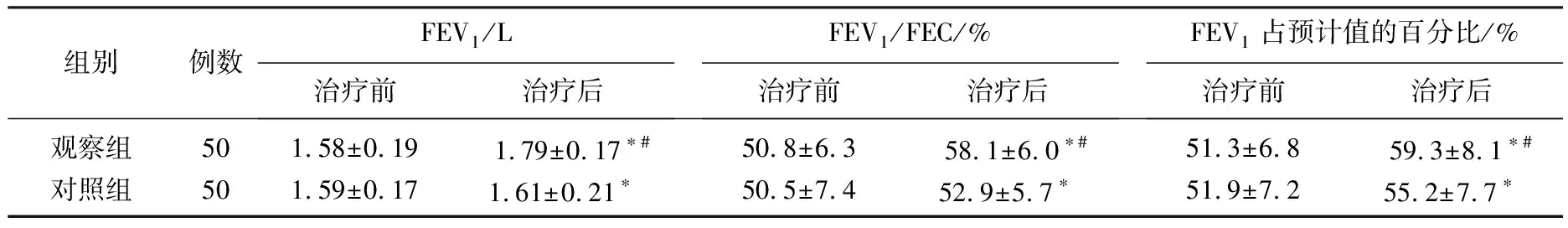
表2 2组患者治疗前后肺功能的比较
2.3 2组患者治疗前、后抗氧化应激指标的比较
2组患者治疗前抗氧化应激指标的差异无统计学意义(P>0.05); 经治疗,2组患者的各项抗氧化应激指标均较治疗前显著提高(P<0.05),而且治疗后观察组患者的各项抗氧化应激指标均显著高于对照组(P<0.05),见表3。
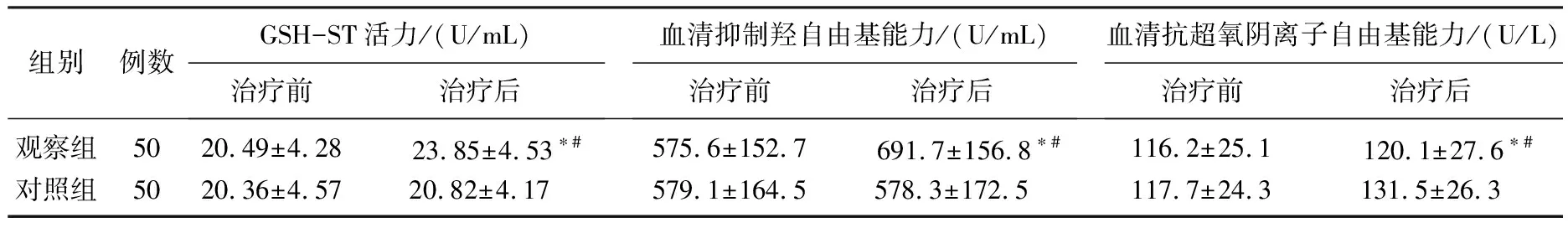
表3 2组患者治疗前、后抗氧化应激指标的比较
3 讨 论
相关统计数字显示,COPD引发的死亡病例数量名列各种慢性致死性疾病的第4位,在中国年龄大于35岁的社区人群中,COPD的患病率可超过5%。相关研究[5]已证实,COPD的发病是环境因素、患者体质因素、生活习惯因素以及社会心理因素共同作用的结果。COPD是一种具有较高致死率的疾病,患者的死亡风险与患者的年龄、血气情况、住院次数、并发症发病情况均具有密切的相关性[6]。虽然COPD是一种可防可治的疾病,但临床治疗方法却十分有限,尤其是对于AECOPD患者,临床上一般主要采取吸氧、抗感染、纠正代谢紊乱等对症治疗措施,加之患者的临床表现、治疗反应等多方面都存在着显著的差异,该病的治疗效果多不尽如人意[7]。
COPD的确切发病原因尚未阐明,一般认为COPD的主要病理生理特征是发生在气道的氧化应激反应和炎症反应,而且由此产生的大量炎症介质还可进入血液循环,引起全身性的异常炎症反应,引发多个器官的结构和功能损害,因此,氧化应激反应和炎症反应的亢进是促进COPD临床进展的重要因素[8]。有研究[9]结果显示,AECOPD患者体内的中性粒细胞、炎症细胞因子、炎症因子等表达水平均高于COPD稳定期患者,而且其炎症反应的程度会随病情的恶化而加重。有研究[10]结果显示,流感病毒感染引发的AECOPD患者痰液中的丙二醛水平和血浆IL-6和IL-8显著升高,而痰液中的超氧化物歧化酶SOD水平显著降低,这反映了AECOPD患者同时具有气道氧化应激状态增强和全身炎症增强的病理改变,而稳定期COPD患者经过系统性的运动训练后,其血浆丙二醛水平会出现显著降低,血浆超氧化物歧化酶会出现显著升高,这也提示了氧化-抗氧化功能的失衡是COPD患者的病情向不稳定状态发展的重要因素[11]。总之,COPD患者的氧化应激反应与炎症细胞和细胞因子的异常活化具有相互促进的作用,氧化应激和炎症反应共同构成了COPD病情持续性恶化和AECOPD发生的病理进程[12]。
临床上针对COPD的治疗目标是控制COPD肺通气功能损害症状、减少AECOPD的发病频率和严重程度、提高患者的运动耐力和生活质量[13],NAC是近年来常用于AECOPD治疗的药物,最初临床上只将其作为一种黏液溶解剂进行应用,随着相关研究的深入,大量研究结果证实,NAC具有多重的药理作用,可以对心、肺、肠、肝及神经细胞等组织器官发挥显著的保护作用,有关其抗氧化、调节凋亡和防核酸分子损害等的作用研究已成为学术界的研究热点。NAC治疗AECOPD的主要作用机制是其富含巯基并具有抗氧化、抗感染等作用。NAC的活性巯基可对黏液的三维结构产生破坏作用,从而使痰液的黏度降低,促进黏蛋白的分泌、使浆液层厚度增加进而使痰液变稀薄,同时可加速呼吸道纤毛的摆动,使痰液易于咳出; NAC与谷胱甘肽过氧化酶结合,对各类过氧化物进行清除,减少过氧化脂质的生成,对AECOPD患者的氧化应激状态进行纠正。此外,NAC还可提高GSH-ST的活力。近年来的研究[14-15]证实,GST-ST酶系以香烟中的多种毒性物质作为底物,可促进这些毒物的生物转化代谢,在防止COPD发生和发展中发挥着重要的作用,而GSH-ST的基因多态性则与COPD的易感性具有密切关系; NAC还可发挥抗感染作用,对IL-8的表达和中性粒细胞的聚集产生抑制作用; NAC还可对气道上皮增厚和重构产生抑制作用,从而发挥维持肺泡弹性、改善肺换气功能的作用。相关临床研究结果显示,NAC能明显降低COPD患者的血清hs-CRP、IL-8、TNF-α、IL-10等炎症介质的水平,改善PaO2、PaCO2等血气指标和通气功能,对于AECOPD患者,NAC具有显著的疗效,可改善患者的临床症状,缩短疗程并改善患者的预后。还有研究[16-17]证实,应用NAC雾化吸入辅助治疗AECOPD,可显著改善患者的肺功能,显著降低患者血清CRP和PCT等炎症标志物水平,而且不良反应较轻。本研究结果显示,经治疗后2组的临床有效率分别为94%和72%,观察组的临床有效率显著高于对照组(P<0.05),而且观察中疗效为“显效”的患者比例显著高于对照组(P<0.05),疗效为“有效”或“无效”的患者比例显著低于对照组(P<0.05),说明应用NAC辅助治疗AECOPD具有显著的疗效,可明显改善患者的临床症状; 2组患者的各项肺功能指标均较治疗前显著提高(P<0.05),而且治疗后观察组患者的各项肺功能指标均显著高于对照组(P<0.05),说明应用NAC辅助治疗AECOPD可更加显著地改善患者的肺功能指标,促进肺通气功能的恢复; 2组患者的各项抗氧化应激指标均较治疗前显著提高(P<0.05),而且治疗后观察组患者的各项抗氧化应激指标均显著高于对照组(P<0.05),说明应用NAC辅助治疗AECOPD可显著增强患者机体的抗氧化能力,缓解患者的氧化应激反应。
综上所述,应用NAC辅助治疗AECOPD具有显著的疗效,可显著改善患者的肺功能,缓解患者的氧化应激反应。
[1] 刘文先,高振,木合塔尔·阿尤甫,等.基于中国不同地区流行病学调查的慢性阻塞性肺疾病患病因素分析[J].医学综述,2013,19(7): 1243.
[2] 覃善芳,张庆团,张凯.慢性阻塞性肺疾病发病相关危险因素Logistic回归分析[J].中华全科医学,2013,11(4): 597.
[3] 于美玲,张中和.慢性阻塞性肺疾病研究进展[J].中国临床研究,2013,26(1): 82.
[4] 戴轶,徐春明,钱文霞,等.无创辅助通气对慢性阻塞性肺疾病患者氧化应激水平的影响[J].河北医药,2013,35(19): 2935.
[5] 侯刚,尹燕,孙丽丽,等.社区35岁以上人群慢性阻塞性肺疾病流行病学患病率及危险因素研究[J].中国全科医学,2012,15(6A): 1831.
[6] 陈婷,曾红,陆建芳,等.慢性阻塞性肺疾病呼吸衰竭死亡相关因素分析[J].中国社区医师: 医学专业,2013,15(7): 131.
[7] 吴饶仙,况九龙.慢性阻塞性肺疾病临床表型的研究进展[J].解放军医学杂志,2013,38(6): 519.
[8] 叶陈毅,汪俊祥,申永春.慢性阻塞性肺疾病相关合并症临床研究进展[J].临床肺科杂志,2013,18(7): 1305.
[9] 张敏,陈志鹏,王玉梅.COPD患者不同时期气道炎症反应及细胞因子变化的研究[J].当代医学,2013,8(19): 65.
[10] 卢文宣,张明泳,韩伟,等.流感病毒感染对慢性阻塞性肺疾病患者氧化应激和全身炎性反应的影响[J].吉林医学,2013,34(25): 5093.
[11] 周文波,聂秀红.稳定期慢性阻塞性肺疾病患者康复治疗氧化应激的随访研究[J].首都医科大学学报,2013,34(4): 615.
[12] 田慧芸,顾玉海.细胞因子IL-10、IL-13与COPD[J].临床肺科杂志,2013,18(6): 1103.
[13] 陈开宇,江丽萍,陈盛新.慢性阻塞性肺疾病的药物治疗进展[J].药学实践杂志,2012,30(6): 408.
[14] 戴诗敏,向永红,梁世锋,等.N-乙酰半胱氨酸治疗COPD的疗效观察[J].临床肺科杂志,2013,18(6): 978.
[15] 刘晓辉,金妍,邓淑仙,等.乙酰半胱氨酸对慢性阻塞性肺疾病患者呼吸功能及血清细胞因子的影响[J].中国医药科学,2013,3(13): 42.
[16] 胡正旺,黎曙明,汪启龙,等.乙酰半胱氨酸泡腾片治疗AECOPD的疗效观察[J].临床肺科杂志,2013,18,(3): 486.
[17] 黄万秀,庆萍,唐霞.N-乙酰半胱氨酸雾化吸入治疗对重度AECOPD患者血液中CRP和PCT水平的临床观察[J].西部医学,2013,25(6): 892.

