牦牛、黄牛卵巢卵泡发育及卵母细胞体外成熟培养的比较研究
陈生梅,孙永刚,徐惊涛
(青海省畜牧兽医科学院,青海 西宁 810016)
牦牛、黄牛卵巢卵泡发育及卵母细胞体外成熟培养的比较研究
陈生梅,孙永刚,徐惊涛*
(青海省畜牧兽医科学院,青海 西宁 810016)
对53头成年黄牛和44头成年牦牛卵巢形态、表面卵泡数量、黄体状况以及卵母细胞体外成熟培养等进行了比对研究,探讨牦牛和黄牛卵巢的形态学差异和卵泡卵母细胞发育变化规律。结果表明,成年黄牛卵巢的体积(11.12±5.77vs.6.92±7.0)和重量(5.85±2.98 vs.3.19±1.58)显著大于成年牦牛卵巢(P<0.05);成年黄牛Ⅰ级卵泡数(13.04±8.12vs.7.97±3.72)、Ⅲ级卵泡数(0.42±0.52vs.0.02±0.15)、总卵泡数(14.46±8.92vs.8.98±3.87)和卵巢黄体直径(1.54±0.44 vs.1.2±0.51)显著大于牦牛(P<0.05);采集卵巢卵母细胞,黄牛卵母细胞数量显著多于牦牛,经体外成熟培养A级卵母细胞培养24 h第一极体的排除率显著高于B级和C级卵母细胞,同一体外成熟时间和相同分级的黄牛和牦牛卵母细胞第一极体的排除率差异不显著。
牦牛;黄牛;卵巢;卵泡;卵母细胞
牦牛作为是青藏高原畜牧业的支柱,对当地牧区的经济、文化、社会发展具有举足轻重的意义[1],由于牦牛品种原始、生存环境和分布区域独特,其母牛繁殖利用年限较短,产犊间隔较长,繁殖力较低,多数母牦牛两年产一胎或三年两胎,牦牛选育改良因世代间隔长而导致进展缓慢,如何提高牦牛繁殖力是目前生产中亟待解决的问题[2-3]。卵巢为雌性动物最重要的生殖器官,能够周期性地排出卵子和产生雌激素及黄体酮的内分泌功能。卵巢上卵泡与黄体周期性的交替变化参与调节哺乳动物的生殖生理过程[4]。本研究通过对成年牦牛和成年黄牛卵巢进行形态学比较,卵泡的分级比较以及可供体外培养有效卵母细胞数量的研究,探讨牦牛和黄牛卵巢的形态学差异及卵泡卵母细胞发育变化规律,为牦牛繁殖生理研究提供参考资料。
1 材料与方法
1.1 试验材料
53头成年黄牛和44头成年牦牛卵巢采集于青海高原肉食品加工中心。卵巢样品采集时间为10~11月。屠宰前试验牛精神、营养状况良好,年龄在3-6岁。卵巢采集后左右两侧做好标记后置于含青霉素(100 U/mL)和链霉素(100 μg/mL)的生理盐水中,2 h内运回实验室。
1.2 卵巢的测定和卵泡分类
剪去卵巢周围的组织、用生理盐水洗净卵巢表面血液后用游标卡尺测量其长、宽、厚以及上面黄体基部直径及重量,卵巢长、宽、厚之积作为体积;参照崔燕等[5]对牦牛卵泡的分类方法对卵泡进行分类:Ⅰ级卵泡(直径≤5 mm),Ⅱ级卵泡(5 mm < 直径≤10 mm),Ⅲ级卵泡(直径> 10 mm)。
1.3 卵母细胞成熟培养
黄牛和牦牛卵巢经生理盐水冲洗后用10 mL注射器带12号针头抽吸卵巢表面卵泡。将收集到的卵泡液置体视显微镜下检出卵丘卵母细胞复合体。卵丘卵母细胞复合体按照包裹卵丘细胞进行分类:A级:卵丘细胞层完整而致密的卵母细胞;B:卵丘细胞层部分脱落的卵母细胞;C:卵丘细胞极少或全部脱落的裸卵。卵母细胞于50 μL培养滴(TCM-199含25 mM Hepes、10%FCS、0.2 mM丙酮酸钠、0.2 U/mL FSH、1 μg/mL E2、100 U/ml青霉素、100 μg/mL链霉素、0.26 mM NaHCO3)置38.6℃ 5% CO2饱和湿度的培养箱中成熟培养24 h。
1.4 卵母细胞成熟的判定
培养后卵母细胞用含0.1%透明质酸酶的m-PBS液消化除去卵丘细胞,将得到的裸卵在实体显微镜下观察,排出第一极体(Pb1)的卵母细胞定义为成熟,否则认为未成熟。
1.5 数据统计
检测结果以平均值±标准差(Mean±SD)表示,数据采用SPSS 15.0软件进行t检验和方差分析。
2 结果与分析
2.1 牦牛和黄牛卵巢形态、表面卵泡比较
牦牛和黄牛卵巢的形态相似,牦牛卵巢较黄牛卵巢小,黄牛卵巢颜色发白而牦牛卵巢表面颜色较暗,部分卵巢表面有卵泡和黄体而略有变形,呈现圆形或三角形,卵巢门无明显凹陷(图1A,1D)。对44头成年牦牛和53成年黄牛卵巢的形态学比较研究,结果见表1:成年黄牛卵巢的长度、宽度、体积为和重量显著大于牦牛(P<0.05);而成年牦牛和黄牛卵巢的厚度差异不显著(P>0.05)。
对比成年牦牛和黄牛卵巢表面卵泡,由表2可见,黄牛卵巢表面总卵泡数为显著大于牦牛(P<0.05)。对于不同级别的卵泡,黄牛卵巢表面Ⅰ级卵泡数和Ⅲ级卵泡数同样显著多于牦牛(P<0.05),而两个品种Ⅱ级卵泡数差异不显著(P>0.05)。

表1 牦牛和黄牛卵巢形态比较Table 1 Morphological comparison of Yak and Cattle ovarian
注:*表示差异显著(P<0.05)。表2、表4同。
Notes: Values with different superscripts differ significantly (P<0.05).The same as in Table 2 and Trble 4.

表2 牦牛和黄牛卵巢表面卵泡比较Table 2 Follicular comparison of Yak and Cattle ovarian
2.2 牦牛和黄牛卵巢上黄体对卵泡发育的影响
成年牦牛和黄牛卵巢上黄体对卵泡发育的影响见表3。由表3知,成年黄牛的黄体直径为显著大于牦牛(P<0.05);同时,在两个品种上,有黄体卵巢的重量显著大于无黄体卵巢的重量(P<0.05),但是Ⅰ级卵泡数、Ⅱ级卵泡数和总卵泡数差异不显著(P>0.05);牦牛有黄体卵巢上Ⅲ级卵泡数为0.06±0.24个,而无黄体卵巢上无Ⅲ级卵泡;黄牛卵巢上有无黄体其Ⅲ级卵泡数差异不显著。采集黄牛和牦牛卵巢卵母细胞,黄牛卵巢平均卵母细胞和A、B级卵母细胞数显著高于牦牛(P<0.05),见表4。
2.3 牦牛和黄牛卵母细胞体外成熟培养
黄牛卵母细胞胞质颜色浅,周围颗粒细胞较为松散,而牦牛卵母细胞胞质颜色较深,颗粒细胞包裹完整而致密(图1B、1E),胞质颜色较暗,而黄牛卵母细胞周围卵丘细胞较为松散,胞质颜色稍浅;卵母细胞经体外成熟培养后,周围颗粒细胞扩散(图1C、1F)。成熟培养结果见图2,黄牛和牦牛卵母细胞体外培养16 h成熟率显著低于20 h、24和28 h的成熟率(P<0.05),而两个品种卵母细胞培养20 h后的成熟率差异不显著(P>0.05);在体外培养相同时间,黄牛和牦牛卵母细胞的成熟率差异不显著。对卵母细胞进行分级后培养24 h,结果如图3所示,A卵母细胞的成熟率显著高于B级和C级,3个等级卵母细胞的成熟率之间差异显著(P<0.05)。
3 讨 论
牦牛为季节性发情的动物,其发情季节主要集中在气候温暖、牧草丰盛的暖季(7~10月)[6],屠宰时间一般集中于10~11月份,由于受屠宰季节的限制,其非发情季节牦牛卵巢卵泡的发育还有待进一步研究。牦牛繁殖率较低的原因之一是母畜一生中卵巢中排出的成熟卵母细胞数量较少有关[7]。
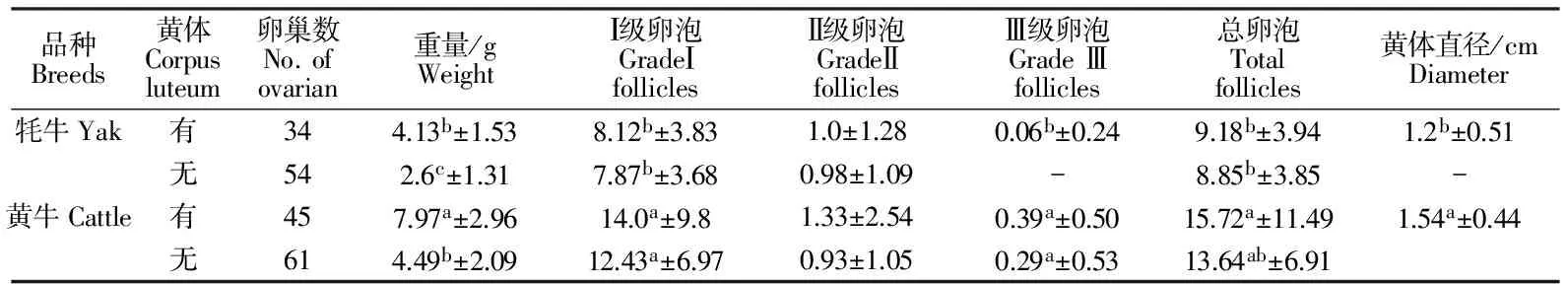
表3 牦牛和黄牛卵巢上黄体对卵泡发育的影响Table 3 Effect of corpus luteum on follicular development in Yak and Cattle
注:同列数据肩标小写字母不同表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。
Notes:Data in same column with lowercase superscripts indicate significant difference(P<0.05);data with same letter indicate insignificany differens(P>0.05).

表4 牦牛和黄牛卵巢卵泡卵母细胞数及可用卵母细胞比较Table 4 Total oocytes and available oocytes in Yak and Cattle ovarian

图1 牦牛、黄牛卵巢及卵母细胞形态A,D分别为黄牛和牦牛卵巢;B,E分别为黄牛和牦牛卵母细胞;C,F分别为成熟培养24 h后的黄牛和牦牛卵母细胞Fig.1 Mmorphology of ovarian and oocytes in Yak and Cattle A,D are cattle and yak ovary respectively.B,E are cattle and yak oocytes respectively;C,F are oocytes of cattle and yak after 24 h culturing respectively

图2 培养时间对黄牛和牦牛COCs IVM的影响Fig.2 Effect of culture time on COCs IVM in cattle and yak

图3 卵母细胞分级对黄牛和牦牛COCs IVM的影响Fig.3 Effect of oocyte grade on COCs IVM in cattle and yak
试验对比成年牦牛和黄牛卵巢表面卵泡,发现黄牛卵巢表面总卵泡数显著多于牦牛。对于不同级别的卵泡,黄牛卵巢表面Ⅰ级卵泡数和Ⅲ级卵泡数同样显著多于牦牛,而两个品种Ⅱ级卵泡数差异不显著。成年牦牛卵巢形态和卵泡数量与张寿[7]等、蔺国珍等[8]的研究结果基本一致。成年牦牛和成年黄牛有黄体卵巢重量显著大于无黄体卵巢,主要是卵巢上黄体生长显著增加了卵巢的重量,牦牛有黄体卵巢上有优势卵泡、无黄体的卵巢无优势卵泡;而黄牛卵巢有无黄体均存在优势卵泡;研究表明,怀孕母牛黄体持续分泌孕酮对下丘脑和垂体前叶产生负反馈作用,抑制垂体前叶产生FSH ,雌激素的分泌量不足,使卵巢上既使有卵泡发育也难以成熟排卵[8],而卵巢黄体与优势卵泡之间的关系有待进一步研究。卵母细胞作为一个高度特化的生殖细胞,卵母细胞的成熟及质量对卵母细胞的激活、受精及其后继的胚胎发育均有重要影响[9],卵母细胞的成熟是一个复杂的、动态生物学过程,涉及细胞核、细胞质、细胞膜、卵丘细胞和透明带等的形态学变化[10]。研究发现体内成熟的卵母细胞发育形成的胚胎/比体外成熟的卵母细胞具有更强的发育能力[11],主要原因是体外培养的卵母细胞核质成熟不同步,在卵胞质积累发育必要的因子达到完全成熟之前卵母细胞核已经成熟[12]。对黄牛和牦牛的卵母细胞进行体外培养,随体外培养时间的延长,卵母细胞成熟率增加,黄牛和牦牛卵母细胞之间成熟率差异不显著,依卵丘细胞的包裹层数对卵母细胞进行分类后体外成熟,A级、B级和C级卵母细胞成熟率差异显著,而同等级的黄牛和牦牛卵母细胞之间差异不显著,研究表明,卵丘细胞对卵母细胞体外成熟效果和胚胎的发育程度有重要的调节作用[13]。
[1]Gerald W,Han J L,Long R J.The yak[M].Bangkok: RAP publication,2003.
[2]Sarkar M,Meyer H D,Prakash B S.Is the yak (Poephagus grunniens L.) really a seasonal breeder[J].Theriogenology,2006,65 :721-730.
[3]Zi X D,Lu H,Yin R H,et al.Development of embryos after in vitro fertilization of bovine oocytes with sperm from either yaks (Bos grunniens) or cattle (Bos taurus)[J].Animal Reproduction Science,2008,108: 208-215.
[4]常 兰,张 寿,贾荣莉,等.不同繁殖类型牦牛卵巢有腔卵泡的观测[J],中国兽医科技,2002,32(11): 28-29.
[5]崔 燕,余四九,宁文芳,等.不同年龄母牦牛内生殖器官的形态学观测[J].中国牦牛,1995(1):18-21.
[6]字向东,钟金城.牦牛繁殖科学研究进展[J].西南民族大学学报:自然科学版,2007,32(6): 79-83.
[7]张 寿,王应安,常 兰,等.不同繁殖类型牦牛卵巢原始卵泡的观测[J].中国畜牧杂志,2003,39(4): 16-17.
[8]蔺国珍,樊江峰,余四九.牦牛妊娠期卵巢、卵泡及黄体的形态学观测[J].甘肃农业大学学报,2006,41(1): 1-4.
[9]陈 涛,曹鸿国,张卫琴,等.卵母细胞成熟发生机制的研究进展[J],生命科学,2009,21(2): 307-311.
[10]Martino A,Palomo M J,Mogas T,et al.Influence of the collection technique of prepubertal goat oocytes on invitro maturation and fertilization[J].Theriogenology,1994,42:859-8734.
[11]Watson A J.Oocyte cytoplasmic maturation: a key mediator of oocyte and embryo developmental competence[J].J Anim Sci,2007,85(13): E1-3.
[12]李永海,刘瑞华,焦丽红,等.哺乳动物卵母细胞核质成熟的差异及其影响因素[J].农业生物技术学报,2003,11(1):94-100.
[13]赵学明,杜卫华,郝海生,等.卵丘细胞在牛卵母细胞体外受精生产胚胎中的作用[J].农业生物技术学报,2011,19(2):375-380.
StudyonOvarianandFollicleDevelopmentandinvitroMaturationofOocytesinCattleandYak
CHEN Sheng-mei,SUN Yong-gang,XU Jing-tao*
(QinghaiAcademyofAnimalScienceandVeterinaryMedicine,Xining,Qinghai810016,China)
In order to study ovarian and follicle development in Cattle and Yak,the experiment compared ovarian morphology,number of follicles,luteal situation and oocyte IVM.The results showed that adult cattle ovarian volume(11.12±5.77vs.6.92±7.0),weight(5.85±2.98vs.3.19±1.58),number of Grade Ⅰ follicles(13.04±8.12vs.7.97±3.72),number of Grade Ⅲ follicles(0.42±0.52vs.0.02±0.15),total follicles(14.46±8.92vs.8.98±3.87) and luteal diameter( 1.54±0.44 vs.1.2±0.51) were significantly higher than those of yak (P<0.05).Collection oocyte in ovarian of cattle and yak,the number of cattle oocytes were significantly higher than that of yak.The maturation rate of grade A oocytes cultured for 24h was significantly higher than that of B and C grade oocytes.But there was no significant difference between cattle oocytes and yak oocytes in same culture time and same grade.
yak; cattle; ovarian; follicle; oocytes
2014-05-03,
2014-05-19
科技部国际科技合作项目(2013DFA31420)
陈生梅(1968-),女,青海湟中人,大专,主要从事动物胚胎工程研究。E-mail:chenshengmei2014@163.com
徐惊涛(1964-),男,河南西华人,副研究员,本科,主要从事动物胚胎工程研究。E-mail:xujt.8964@aliyun.com
S811.6
A
1005-5228(2014)07-0054-04

