GP方案对晚期非小细胞肺癌患者肺功能的影响
许文景,姜正华,黄 谦,葛 辉
(扬州大学临床医学院 江苏省苏北人民医院 呼吸内科,江苏 扬州,225001)
肺癌是呼吸系统的常见肿瘤,其发病率及死亡率呈逐年上升的趋势,大多数患者就诊时已属晚期,无手术指征。本文对30例晚期非小细胞肺癌患者应用GP方案化疗前后的肺功能进行检测,并与63例正常人进行比较,以了解肺癌患者的肺功能改变及化疗对肺癌患者肺功能的影响,现报告如下。
1 资料与方法
1.1 一般资料
选择2008年11月—2011年10月在本院住院的肺癌患者30例设为GP组,均经纤维支气管镜活检、CT引导下肺穿刺活检后病理证实为原发性肺癌。GP组患者应用吉西他滨联合铂类化疗,2~3个疗程后行相关检查评估化疗疗效,均为PR或CR,男28例,女2例,年龄42~77岁,平均年龄(66.23±8.10)岁;腺癌16例,腺鳞癌1例,鳞癌13例,所有患者均行胸部CT、头颅MRI、B超、ECT等检查,根据TNM分期,均为晚期肺癌(IIIb期或IV期)。63例健康体检者设为对照组,其中男51例,女12例,年龄41~88岁,平均年龄(56.76±8.90)岁。
1.2 方法
2组患者均采用德国耶格肺功能仪进行肺功能检测。测定前输入患者的身高、体质量、性别、年龄、温度、大气压等指标,由电脑自动产生相应的预测值。对所有患者进行肺活量(VC)、第1秒用力呼出量(FEV1)、用力肺活量(FVC)、第1秒用力呼出量/用力肺活量(FEV1/FVC)、最大通气量(MVV)、残气量/肺总量(RV/TLC)及一氧化碳弥散量(DLCO)、弥散系数(DLCO/VA)检测。
1.3 统计学处理
采用PEMS3.1软件对数据进行处理,所有结果均采用均数±标准差表示,两样本均数的比较采用t检测。
2 结 果
2.1 2组化疗前肺功能指标比较
与对照组相比,GP组患者肺通气功能的RV和RV/TCL指标较高但无显著差异,VC、VC%、FEV1、FEV1%、FVC、FVC%、FEV1/FVC%、PEF、PEF%、MVV、MVV%均显著低于对照组,差异有统计学意义(P<0.01)。见表1。GP组小气道功能指标V25、V25%、V50、V50%均显著低于对照组(P<0.01)。见表2。GP组肺弥散功能的各项指标DLCO、DLCO%、DLCO/VA、DLCO/VA%均显著低于对照组(P<0.05),见表3。
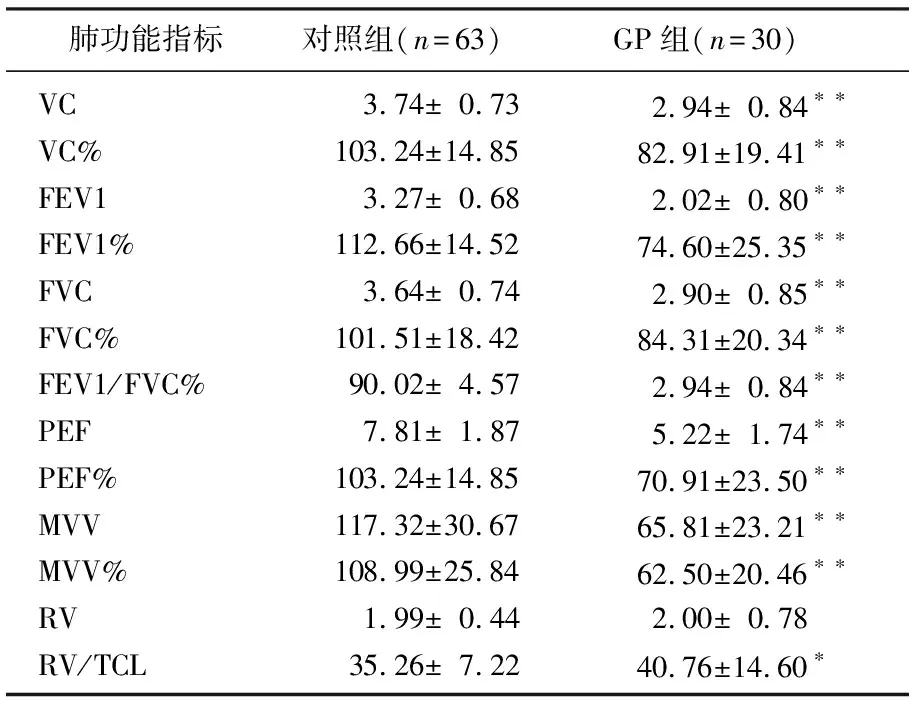
表1 2组肺通气功能检测结果分析
2.2 GP方案化疗对肺癌患者化疗前后肺功能指标的影响
GP方案化疗的肺癌患者化疗后肺通气功能指标FEV1/FVC%较化疗前显著增高(P<0.05),其余各通气功能指标化疗前后无显著差异。GP方案化疗的肺癌患者化疗后肺弥散功能各指标均显著低于化疗前(P<0.05)。见表4。

表2 2组小气道功能检测结果分析
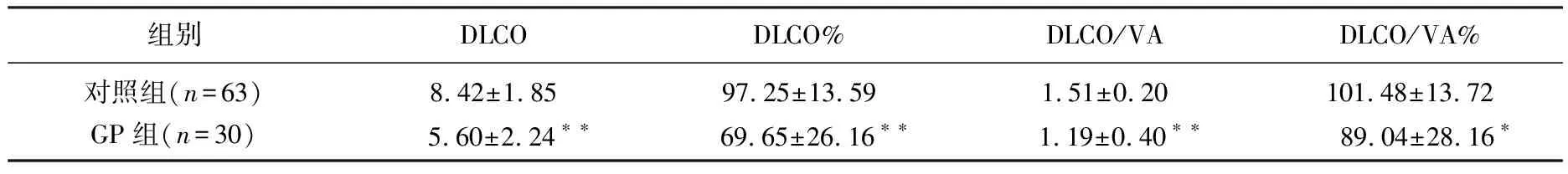
表3 2组肺弥散功能检测结果分析

表4 GP方案化疗前后肺功能比较
3 讨 论
肺癌本身以及部分肺癌患者同时合并慢性阻塞性肺疾病,皆能影响患者的肺功能,所以许多肺癌患者遭受着呼吸困难带来的痛苦。胸内肿瘤可能通过两种方式影响患者的肺功能:一种是通过造成肺容积减少或影响气体交换导致非阻塞性通气功能障碍;另一种通过阻塞气道引起阻塞性通气功能障碍。以往对肺癌患者进行肺功能指标检测主要用于手术前患者以评估患者术前肺功能是否能够耐受手术,近年来肺部放疗患者放疗前行肺功能检查已逐渐作为常规,但对于晚期肺癌患者进行化疗前肺功能检查仍被忽视。本研究表明肺癌组患者化疗前肺通气功能指标RV和RV/TCL指标高于正常对照组,但无显著差异;其余各项指标VC、VC%、FEV1、FEV1%、FVC、FVC%、FEV1/FVC%、PEF、PEF%、MVV、MVV%均显著低于正常对照组,这与相关研究是一致的[1]。这表明肺癌患者合并阻塞性通气功能障碍,可能与患者吸烟、肺部肿块、肺不张、合并肺气肿及支气管炎有关,也与患者发生肺癌后前列腺素增多引起细支气管痉挛或部分肺泡闭合有关。
弥散功能是肺换气功能的重要组成部分,通过弥散O2从肺泡进入到肺毛细血管,而CO2则从肺毛细胞血管排出到肺泡。正常人的弥散功能>预测值的80%。Margaritora等[2-3]研究证实DLCO水平是一种有效的肺部并发症的预测因素。Baser 等[4]研究表明术前低水平的DLCO(<45%)与术后肺部并发症的发病率与死亡率增加是相关的,且预示较差的生活质量。本研究表明,肺癌组化疗前与正常对照组相比,肺弥散功能的各项指标DLCO SB、DLCO SB%、DLCO/VA、DLCO/VA%均显著降低,这说明肺癌导致患者弥散功能下降。其主要原因如下: ① 肿瘤压迫阻塞气管引起阻塞性炎症、肺不张及胸膜病变等原因,引起肺容量减少、通气功能受限,造成弥散面积减少;同时周围肺组织的代偿使通气量增加,引起通气/血流比例失调; ② 癌肿压迫血管,血流受阻,血流量减少,通气血流比例增高; ③ 肺癌细胞还可经血流转移,阻塞小血管,导致通气血流比例的进一步失调; ④ 肺癌患者大多为中老年者,大多有长期吸烟史,有的患者伴有慢性肺部疾病。
化疗药物对肺有毒性作用但无明显临床损伤,肺功能检测能在临床表现出现前测定药物相关性肺毒性。应用GP方案化疗组的肺癌患者化疗后肺通气功能指标FEV1/FVC%较化疗前显著增高,其余各通气功能指标化疗前后无显著差异。这与熊建萍等[5]的研究是一致的。Pinson等[6]研究表明肺癌患者经过3个疗程化疗有效者肺功能FEV1、VC值有改善。这种研究上的差异可能与样本例数少有关。这些结果表明应用GP方案化疗对肺癌患者通气功能影响不显著。GP组肺癌患者化疗后肺弥散功能各指标均显著低于化疗前,这与国内外相关研究是一致的[5-7]。吉西他滨是一种抑制DNA合成的抗代谢类药物,是广泛应用于治疗晚期非小细胞肺癌一线化疗药物[8]。吉西他滨导致的呼吸系统毒副反应通常较轻微且有一定的自限性,主要表现为一过性呼吸困难,可能是支气管痉挛所致。严重和致命性的肺毒性除进行性呼吸困难外,多表现为肺部实质病变,包括急性过敏性肺炎、非心源性肺水肿/ARDS、慢性间质性肺泡炎/纤维化及胸腔积液。Dimopoulou等[9]研究显示,41例不同肿瘤类型患者应用吉西他滨联合顺铂方案化疗后有中度的,大多数无症状的肺弥散功能的下降,这种弥散功能的改变是可逆的。晚期肺癌患者应用吉西他滨联合顺铂方案化疗后出现超敏性肺炎已被报道[10-11]。Patricia等[12]研究在接受术前吉西他滨化疗的早期非小细胞肺癌患者肺弥散功能改变是常见的,虽然观察到肺弥散功能DLCO有8%的下降,但这种降低并没有临床症状。Pinson等[6]研究表明,多数对化疗有效或无效肺癌患者化疗前后肺弥散功能有不同程度的下降,虽然有些患者接受到的化疗药物本身对肺有一定的毒性,但这不能完全解释这一发现。研究[13-15]表明化疗药物通过损害肺泡毛细血管内膜结构影响肺弥散功能,这种损害程度与DLCO的下降是成比例的。Maas等[16]研究对III期非小细胞肺癌患者行新辅助化疗前后肺功能指标检测,发现应用吉西他滨联合卡铂化疗后DLCO明显下降,这种下降与性别、化疗疗效、化疗周期、有无合并慢性阻塞性肺疾病无关。这些证据均提示化疗药物对肺组织产生损害,这些证据均表明提示GP方案化疗对肺癌患者弥散功能有损害。
综上所述,肺癌患者肺通气功能与弥散功能指标明显下降,肺癌患者应用GP方案化疗后肺通气功能指标改变不大,弥散功能指标明显下降,化疗药物对于肺癌患者产生了肺功能损害,化疗前肺功能的测定极其重要。
[1] 周怡,张金花,赵卫国. 肺癌病人最大呼吸流速容量曲线及弥散功能变化的意义[J].中国医学工程,2007,15(2): 169.
[2] Margaritora S,Cesario A,Gusumano G,et al. Is pulmonary function damaged by neoadjuvant lung cancer therapy A comprehensive serial time-trend analysis of pulmonary function after induction radiochemotherapy plus surgery[J]. The Journal of Thoracic and Cardiovascular Surgery,2010,139(6): 1457.
[3] Takeda S,Funakoshi Y,Kadota Y,et al. Fall in diffusing capacity associated with induction therapy for lung cancer:a predictor of postoperative complication[J].Ann Thorac Surg,2006,82:232.
[4] Baser S,Shannon VR,Eapen GA,et al. Smoking cessation after diagnosis of lung cancer is associated with a beneficial effect on performance status[J]. Chest,2006,130:1784.
[5] 熊建萍,徐骏,钟陆行,等.低剂量吉西他滨治疗晚期非小细胞肺癌的疗效观察和对肺功能的影响[J]. 临床肿瘤学杂志,2005,10(6): 643.
[6] Pinson P,Klastersky J.The value of lung function measurements for the assessment of chemotherapy in lung cancer patients[J]. Lung Cancer ,1998,19:179.
[7] Nowak A K,Byrne M J,Williamson R,et al. Amulticentre phase II study of cisplatin and gemcitabine for malignant mesothelioma[J].Br J Cancer,2002,87: 491.
[8] Treat J,Belani C,Edelman M,et al.A randomized phase III trial of gemcitabine(G) in combination with carboplatin(C) or paclitaxel(P) versus paclitaxel plus carboplatin in advanced(stage IIIB,IV) non-small cell lung cancer(NSCLC):update of the Alpha Oncology Trial(AI-99002L)[J].Proc Am Soc Clin Oncol,2005,23:7025.
[9] Dimopoulou I,Efstathiou E,Samakovli A,et al. A prospective study on lung toxicity in patients treated with Gemcitabine and Carboplatin: clinical radiological and functional assessment[J]. Ann Oncol,2004,15:1250.
[10] Kudrik F J,Rivera M P,Molina P L,et al. Hypersensitivity pneuonitis in advanced non-small cell lung cancer patients receiving gemcitabine and paclitaxel:report of two cases and a review of the literature[J]. Clin Lung Cancer,2002,4: 52.
[11] 蔡少华,王雅娟,张晓军,等. 吉西他滨致严重肺毒性和全身性毛细血管漏综合征1例[J].中国药物应用与监测,2004,4: 37.
[12] Patricia R,Frank C,Mark A,et al. Impact of preoperative chemotherapy on pulmonary function tests in respectable early-stage non-small cell lung cancer[J].Chest,2009,135(6):1588.
[13] Takeda S,Funakoshi Y,Kadota Y,et al. Fall in diffusing capacity associated with induction therapy for lung cancer: a predictor of postoperative complication[J].Ann Thorac Surg,2006,82:232.
[14] Leo F,Solli P,Spaggiari L,et al. Respirator function changes after chemotherapy: an additional risk for postoperative respiratory complications[J].Ann Thorac Surg,2004,77:260.
[15] Videtic GM,Stitt LW,Ash RB,et al. Impaired diffusion capacity predicts for decreased treatment tolerance and survival in limited stage small cell lung cancer patients treated with concurrent chemoradiation[J]. Lung Cancer,2004,43:159.
[16] Maas KW,Van der LEE I,Bolt K,et al.Lung function changes and pulmonary complications in patients with stage III non-small cell lung cancer treated with gemcitabine/cisplatin as part of combined modality treatment[J].Lung Cancer,2003,41(3):345.

