乳腺癌患者术前18F-FDG PET/CT显像肿瘤代谢体积测定的预后价值
刘晓强,周海中,杜 鹃
(扬州大学临床医学院,1. 核医学科; 2. 肿瘤科,江苏 扬州,225001)
乳腺癌是全世界妇女最常见肿瘤和主要死亡原因,2008年估计乳腺癌新增140万病例,死亡45.8万例[1]。2014年美国估计女性新增23.267万例乳腺癌,占所有新发肿瘤的14.0%,年发病率为124.6/10万人;估计死亡4万例,占所有肿瘤死亡人数的6.8%,年死亡率22.6/10万女性; 5年生存率89.2%,有区域淋巴结转移者5年生存率84.6%,远处转移者5年生存率仅25.0%[2]。中国乳腺癌年发生率42.55/10万,占女性肿瘤的16.81%,女性乳腺癌死亡率10.24%,占女性肿瘤死亡率的7.54%[3]。近年来,18F-FDG PET/CT显像在肿瘤的诊断、治疗方面发挥着重要的作用[4],18F-FDG PET/CT显像代谢体积测定已用于胰腺癌、食道癌、肺癌、宫颈癌、头颈肿瘤等的预后评估[5-9]。本文回顾分析18例晚期女性乳腺浸润性导管癌患者18F-FDG PET/CT显像,探讨其肿瘤代谢体积(MTV)测定在预后评估中的价值。
1 资料与方法
1.1 临床资料
18例入选者为初发原发性女性乳腺癌,18F-FDG PET/CT显像后10~15 d手术病理证实为浸润性导管癌(IDC),ER/PR及HER-2阳性,既往无肿瘤病史。患者年龄37~75岁,平均51.8岁;Ⅲ期8例(ⅢA期4例,ⅢB期3例,ⅢC期1例),Ⅳ期10例。18例患者均采取手术、术后放疗、辅助性化疗、内分泌治疗、生物靶向治疗。手术治疗6例采取术前新辅助化疗+保留乳房手术,4例术前新辅助化疗+改良根治术手术,8例行改良根治术手术;术后放射治疗常规采取胸壁切线野、锁骨上/下野、腋窝照射或采取三维适形调强技术;化疗采取CEF或AC→T或A→F→C方案,化疗6个周期;内分泌治疗绝经前采取枸橼酸他莫昔芬、卵巢去势者联合应用第3代芳香化酶抑制剂来曲唑,绝经后患者使用来曲唑或联合应用他莫昔芬;生物靶向治疗采用赫曲妥珠单抗。随访12~48个月,将PET/CT结果与病理、临床治疗效果、血清肿瘤标志物、CT、MRI、ECT等资料进行综合分析。
1.2 疾病进展(PD)判断
目标病灶的长径LD总和增大≥20%,或出现新的病灶即为PD。治疗后肿瘤缩小则以所能达到的最小总和长径LD为参照,如果肿瘤治疗以来LD总和从未缩小则仍以基线总和LD为参照。非目标病灶只是辅佐“目标病灶”评价总体疗效,其构成: ① >10个的所有可测量病灶全部归入非目标病灶; ② 所有不可测量病灶都只能列为非目标病灶。对非目标病灶不要求测量,但在基线及随访时,应记录每一个非目标病灶是非存在或消失。出现一个或多个新病灶,和/或现有的非目标病灶明显进展即为PD。无进展生存期(PFS)从研究入组(乳腺癌初诊)到肿瘤出现进展或死亡。
1.3 检查方法
18F-FDG PET/CT显像采用GE公司的Discovery TM VCT PET-CT System (Discovery TM VCT Whole-Body Integrated PET-CT Imaging System),18F-FDG由上海原子科欣公司提供,放化纯>95%。患者禁食6 h、测定空腹血糖正常后,按4.07 MBq/kg (0.11 mCi)静脉注射18F-FDG。患者避光、静卧休息45 min,注射显像剂后20 min饮水500 mL,检查前再饮水500~750 mL,排尿后行PET/CT 扫描。先行脑部扫描再行体部扫描,脑部扫描先行CT扫描(64排螺旋CT),DFOV 25.0 cm,层厚3.75 mm,管电压120 keV,管电流300 mA,螺距1.375∶1; 然后进行PET采集,使用3D扫描。体部扫描从颅底至股骨中上段(必要时扫全双下肢),患者平静呼吸,仍然先行CT扫描,DFOV 50.0 cm,层厚3.75 mm,管电压120 keV,管电流130 mA,层厚3.75 mm,螺距0.516∶1; 然后进行PET采集,使用3D扫描,每个床位采集3 min,共采集5~7个床位。经CT衰减矫正、OSEM迭代法图像重建,分别得到全身或局部的冠状位、矢状位、横断位的CT、PET以及PET/CT融合图像。
1.4 PET/CT图像分析及MTV测定
由2位从事ECT20年以上、PET/CT工作4年以上经验丰富的核医学医师独立完成。麦迪克斯公司提供ECT/PET医学影像工作站、图像融合重建软件,进行图像重建,设置感兴趣区边界等高线阈值为40%SUVmax,自动勾画肿瘤3-D感兴趣区计算肿瘤代谢体积(MTV)、最大标准摄取值(SUVmax)。
2 结 果
2.1 ROC曲线分析
MTV、SUVmax、Stage、Age对乳腺癌进展预测效能见表1。由ROC分析可见MTV对乳腺癌进展的预测有较高价值(AUCs>0.90,P<0.01),MTV=6.35 cm3时灵敏度+特异性最大,MTV的界值为6.35 cm3; SUVmax价值中等(0.9>AUCs>0.7,P<0.05),SUVmax界值9.05。MTV与SUVmax两者置信区间有重叠,两者曲线下面积间差异无统计学意义。
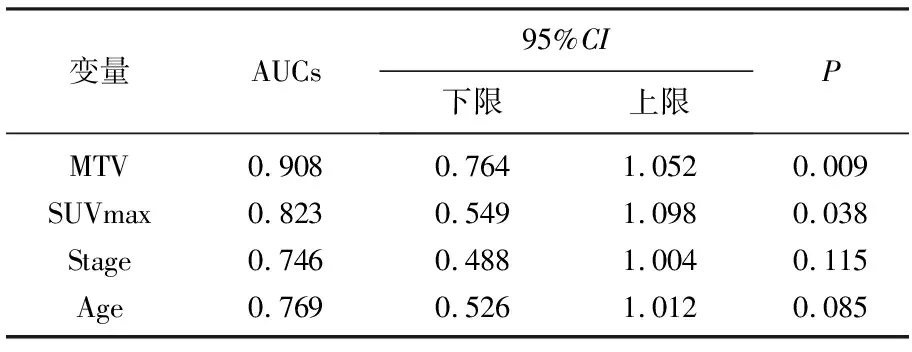
表1 ROC曲线下面积
2.2 Kaplan-Meier PFS分析
MTV<6.35 cm3组平均PFS45.50个月(95%CI41.26~49.74),MTV≥6.35 cm3组平均PFS26.13个月(95%CI22.87~29.39),2组间差异有统计学意义(P=0.001); 总体PFS 31.99个月(95%CI27.01~36.97),MTV≥6.35 cm3组中位无进展生存期27.00月(95%CI24.18~29.82),总体中位无进展生存期28.00月(95%CI25.34~30.66)。SUVmax<9.05组平均无进展生存期41.83个月(95%CI34.4~49.26),SUVmax≥9.05组平均无进展生存期26.64个月(95%CI22.75~30.53),2组间无进展生存率差异有统计学意义(P=0.008); 总体无进展生存期31.99月(95%CI27.01~36.97),SUVmax≥9.05组中位无进展生存期27.00月(95%CI24.74~29.26),总体中位无进展生存期28.00月(95%CI25.34~30.66)。

表2 单变量晚期乳腺癌进展风险分析
2.3 Cox回归风险分析
分别对晚期乳腺癌进展危险因素进行单变量和多变量分析,单变量分析结果见表2。多变量分析协变量进入模型的方法采用LR法(基于偏最大似然估计的前进法),MTV、Stage进入COX风险方程,Cox风险模型表达式为h(t)=h0(t)exp(1.428MTV+2.433stage)。MTV相对危险度HR4.169(95%CI1.691~10.281,P=0.002),StageHR11.392(95%CI0.949~136.731,P=0.055)。通过Cox回归分析,影响乳腺癌无病生存率的因素是代谢肿瘤体积、肿瘤分期,从回归系数的符号和相对危险度的大小看两者都是危险因素。本研究提示:肿瘤分期越晚、代谢体积越大预后越差。所在总体人群总的无病生存率变化情况显示:晚期乳腺癌(Ⅲ、Ⅳ期)29个月后无病进展生存率几乎为0,也即29个月后疾病进展风险几乎100%。
3 讨 论
乳腺癌中浸润性导管癌约占75%~85%,肿瘤的负荷、临床分期、分子类型( 雌激素受体ER、孕激素受体PR 、表皮生长因子受体 her2)表达水平与乳腺癌的治疗、预后密切相关[10]。本研究对象选择女性晚期(Ⅲ、Ⅳ期)浸润性导管癌,ER/PR及HER-2阳性,均采取手术、放疗、辅助性化疗、内分泌治疗、生物靶向治疗综合治疗者。乳腺癌作为全世界最流行的肿瘤,荷瘤生存较长,诊断后5年有440万幸存者[11]。尽管总生存期(OS)是最值得期待的结果,但由于随访时间长且常被随后其他治疗所干扰,所以PFS是应用最广泛的观察指标[12]。本研究所在总体人群总的无病生存率变化情况显示:晚期乳腺癌29个月后无进展生存率几乎为0%,疾病进展风险几乎100%。
SUVmax是目前18F-FDG PET/CT显像中最常用的参数,乳腺癌病灶的SUV值与肿瘤的浸润程度、核型分级、雌激素受体的表达等呈正相关,而这些病理指标均与患者的预后有一定的关联[13]。病灶的SUV值与肿瘤细胞内着丝粒蛋白F的mRNA的表达量呈正相关,而着丝粒蛋白F则与细胞分裂关系密切[14]。SUVmax可在一定程度上预测乳腺癌患者的预后,病灶的SUV值和组织病理学分级都与患者的无瘤生存期呈负相关,其中SUV值的相关性比组织病理学分级更好[15]。FDG亲和力测量是诊断乳腺癌骨转移生物预测标志,SUVmax是骨转移乳腺癌患者生存预测因子[16]。 Uematsu等[17]发现,23例行保乳手术的乳腺癌患者预后较差组的病灶SUV值显著高于预后较好组。Jung等[18]比较了66例乳腺癌患者新辅助化疗后病灶的SUV值下降程度与无瘤生存期呈正相关。本研究显示: SUVmax预测乳腺癌进展价值中等(0.9>AUCs>0.7,P<0.05),SUVmax<9.05组平均无进展生存期41.83个月,SUVmax≥9.05组平均无进展生存期26.64个月,2组间无进展生存率差异有统计学意义(P<0.01)。单变量Cox回归分析显示,SUVmaxHR2.962有统计学意义(P<0.01)。
肿瘤18F-FDG高摄取与肿瘤生命力和增殖生物学行为相关,对结局不利。由于SUVmax仅显示感兴趣区内18F-FDG最高摄取,不能反映整个肿瘤的代谢活性和代谢容量,而MTV是一种18F-FDG摄取增加肿瘤细胞体积测量,是一种尚待研究的18F-FDG PET/CT参数。MTV不仅能测量肿瘤体积,也显示代谢活性,有别于先前CT或MRI计算肿瘤体积,有助于预测治疗反应和患者预后。术前MTV是宫颈癌根治术无病生存期的独立预测因子[8],局部晚期胰腺癌适型调强放射治疗前MTV,是有潜力的生存预测因子,并有助于勾画放疗生物靶区[5],MTV是头颈部肿瘤结局的预测因子,高MTV则患者不良事件或死亡风险较高[9]。本研究显示: MTV对晚期女性乳腺浸润性导管癌进展的预测有较高价值(AUCs>0.908,P<0.01),MTV<6.35组平均无进展生存期45.50个月,MTV≥6.35组平均无进展生存期26.128个月,2组间无进展生存率差异有统计学意义(P=0.001)。单变量Cox回归分析MTVHR3.179,P=0.001。多变量MTVHR为4.169有意义(P<0.01),StageHR11.392无统计学意义(P>0.05)。通过Cox回归分析,影响乳腺癌无病生存率的因素是代谢肿瘤体积、肿瘤分期,从回归系数的符号和相对危险度的大小看两者都是危险因素。本研究提示:肿瘤分期越晚、代谢体积越大预后越差。
[1] Jemal A,Center M M,Desantis C. Global Patterns of Cancer Incidence and Mortality Rates and Trends[J].Cancer Epidemiol Biomarkers Prev ,2010,19(8): 1893.
[2] The National Cancer Institute of the U.S. Surveillance,Epidemiology,and End Results (SEER) Program. http://seer.cancer.gov/statfacts/html/breast.html(accessed Jue 24,2014).
[3] Wanqing Chen,Rongshou Zheng,Siwei Zhang,et al.Report of incidence and mortality in China cancer registries,2009[J]. Chin J Cancer Res,2013,25(1): 10.
[4] Kumar R,Halanaik D,Malhotra A. Clinical applications of positron emission tomography-computed tomography in oncology[J]. Cancer,2010,47(2): 100.
[5] Dholakia A S,Chaudhry M A,Leal J P,et al. Baseline Metabolic Tumor Volume and Total Lesion Glycolysis Are Associated With Survival Outcomes in Patients With Locally Advanced Pancreatic Cancer Receiving Stereotactic Body Radiation Therapy[J]. Int J Radiat Oncol Biol Phys,2014,89(3): 539.
[6] Soydal C,Yüksel C,Küük N,et al. Prognostic Value of Metabolic Tumor Volume Measured by18F-FDG PET/CT in Esophageal Cancer Patients[J]. Mol Imaging Radionucl Ther,2014,23(1): 12.
[7] Vu C C,Matthewa R,Kim B,et al. Prognostic value of metabolic tumor volume and total lesion glycolysis from18F-FDG PET/CT in patients undergoing stereotactic body radiation therapy for stage I non-small-cell lung cancer[J]. Nucl Med Commun,2013,34(10): 959.
[8] Chung H H,Kim J W,Han K H,Prognostic value of metabolic tumor volume measured by FDG-PET/CT in patients with cervical cancer[J]. Gynecol Oncol,2011,120(2): 270.
[9] Pak K,Cheon G J,Nam H Y,et al. Prognostic Value of Metabolic Tumor Volume and Total Lesion Glycolysis in Head and Neck Cancer: A Systematic Review and Meta-Analysis[J]. J Nucl Med,2014,55(6): 884.
[10] Groheux D,Giacchetti S,Moretti J L,et al. Correlation of high 18 F-FDG uptake to clinical,pathological and biological prognostic factors in breast cancer[J]. Eur J Nucl Med Mol Imaging,2011,38(3): 426.
[11] Parkin D M,Bray F,Ferlay J,et al. Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(02): 74.
[12] 李惠平. 进展期乳腺癌诊疗优化和ABC1指南部分解读[J]. 癌症进展,2013,11(11): 506.
[13] Ueda S,Tsuda H,Asakawa H,et al. Clinicopathological and prognostic relevance of uptake level using 18F-fluorodeoxyglucose positron emission tomography/computed tomography fusion imaging (18F-FDG PET/CT) in primary breast cancer[J]. Jpn J Clin Oncol,2008,38(4): 250.
[14] Ueda S,Kondoh N,Tsuda H,et al. Expression of centromere protein F (CENP-F) associated with higher FDG uptake on PET/CT,detected by cDNA microarray,predicts high-risk patients with primary breast cancer[J]. BMC Cancer,2008,8: 384.
[15] Emmering J,Krak N C,Van der Hoeven J J M,et al. Preoperative [18F]FDG-PET after chemotherapy in locally advanced breast cancer: prognostic value as compared with histopathology[J]. Ann Oncol,2008,19(9): 1573.
[16] Ulaner G A,Eaton A,Morris P G,Prognostic value of quantitative fluorodeoxyglucose measurements in newly diagnosed metastatic breast cancer[J]. Cancer Med,2013,2(5): 725.
[17] Uematsu T,Kasami M,Yuen S,Comparison of FDG PET and MRI for evaluating the tumor extent of breast cancer and the impact of FDG PET on the systemic staging and prognosis of patients who are candidates for breast-conserving therapy[J]. Breast Cancer,2009,16(2): 97.
[18] Jung S Y,Kim S K,Nam B H,et al. Prognostic Impact of[18F]FDG-PET in operable breast cancer treated with neoadjuvant chemotherapy[J]. Ann Surg Oncol,2010,17(1): 247.

