急性脑卒中患者血尿酸水平与颈动脉粥样硬化的研究
詹红艳,杨红英,袁 莉,牛春华,王丽英,陈丽丽*(.河北省唐山市丰润区第二人民医院神经内科,河北 唐山 064000;.河北省唐山市工人医院神经内科,河北 唐山 063000)
·论著·
急性脑卒中患者血尿酸水平与颈动脉粥样硬化的研究
詹红艳1,杨红英2,袁 莉2,牛春华2,王丽英2,陈丽丽2*
(1.河北省唐山市丰润区第二人民医院神经内科,河北 唐山 064000;2.河北省唐山市工人医院神经内科,河北 唐山 063000)
目的探讨急性脑卒中患者血尿酸(serum uric acid,SUA)水平与颈动脉粥样硬化(carotid athero sclerosis,CAS)的关系。方法纳入急性脑卒中患者300例,根据有无CAS分为CAS组和非CAS组,比较2组间临床相关指标差异,并分析CAS的危险因素。结果CAS组颈动脉内膜中膜厚度、SUA、三酰甘油水平高于非CAS组(P<0.01)。Logistic回归分析显示,三酰甘油、SUA、空腹血糖是内膜中膜厚度增厚的独立危险因素。结论急性脑卒中患者SUA水平升高是CAS的独立危险因素。
卒中;动脉粥样硬化;尿酸
缺血性脑卒中是多种病因和发病机制所致的临床综合征,颈动脉粥样硬化(carotid athero sclerosis,CAS)是导致缺血性卒中的最常见病因。在亚洲有33%~50%缺血性脑卒中患者归因于颅内动脉粥样硬化(athero sclerosis,AS),而在西方人群中的发病率为8%~10%[1],早期诊断和治疗CAS对于降低脑卒中的发生率具有重要作用。血尿酸(serum uric acid,SUA)与心脑血管疾病的关系一直备受关注,但也存在许多争议。国外研究[2]显示SUA是心肌梗死和卒中的独立危险因素,与之前认为的SUA是一种具有抗氧化作用的保护性代谢产物不同。颈动脉位置表浅易于检测,故颈动脉超声在临床上应用较为普及。颈动脉内膜中膜厚度(intima-media thickness,IMT)是AS早期病理改变,是AS程度的预测指标之一,IMT增厚程度及进展速度可反映其心、脑动脉血管并发症的危险性[3]。本研究检测急性脑卒中患者颈动脉IMT,旨在探讨SUA与急性脑卒中患者CAS的关系。
1 资料与方法
1.1 一般资料:选择2011年6月—2012年6月河北省唐山市工人医院神经内科收治的急性脑卒中患者300例,男性178例,女性122例,年龄20~83岁,平均(58.51±12.06)岁。均符合急性脑卒中的诊断标准,并均经CT或MRI证实。入选条件为发病24h内入院;年龄≥18岁;首发卒中。排除标准为进入研究前3个月使用过利尿剂、抗痛风药物、降脂药物等影响SUA水平的患者;急性感染者、外伤者、肿瘤者、妊娠期妇女、昏迷等严重应激状态者;无症状及体征的静止性脑梗死,其他原因引起的脑梗死;血液系统高凝状态、动脉炎、烟雾病,存在心源性栓子的潜在来源如心房颤动或结构性心脏病;患者或法定代表人拒绝参与调查者。将300例患者根据有无CAS分为CAS组102例,男性57例,女性45例,年龄22~81岁,平均(58.27±12.88)岁;非CAS组198例,男性121例,女性77例,年龄20~83岁,平均(58.63±11.66)岁。2组性别、年龄差异均无统计学意义(P>0.05),具有可比性。
1.2 方法:①所选病例入院第2天,抽取空腹6h静脉血,采用血浆葡萄糖氧化酶法检测空腹血糖(fasting plasma glucose,FPG)、餐后2h血糖(2 hour postprandial blood glucose,2hPG);糖化血红蛋白(hemoglobin A1c,HbA1c)应用日立7170A糖化血红蛋白分析仪,卫生部上海生物制品研究所生产的HbA1c测定试剂盒测定;血胆固醇(total cholesterol,TC)、血三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipid-cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipid-cholesterol,HDL-C)、SUA等生化参数使用日立H7600全自动生化分析仪测定,并测定身高、体质量,计算体质量指数(body mass index,BMI)。②检测研究对象双侧颈总动脉、颈动脉分叉处、颈内动脉起始段及颈外动脉。应用无创性高分辨率彩色超声仪进行检测,IMT<1mm为无动脉硬化者,IMT>1mm或发现斑块者定义为临床动脉硬化患者。
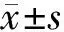
2 结 果
2.1 2组相关指标比较:CAS组TG、IMT、SUA高于非CAS组,差异有统计学意义(P<0.01);2组BMI、FPG、2hPG、HbA1c、TC、LDL-C、HDL-C差异均无统计学意义(P>0.05)。见表1。


组别例数BMIFPG(mmol/L)2hPG(mmol/L)HbA1c(%)TC(mmol/L)CAS组10228.25±3.967.44±2.8412.25±4.176.86±2.014.48±0.85非CAS组19828.00±3.698.02±3.8212.98±5.247.30±2.254.81±0.99 t0.5441.3571.2321.6751.185 P0.5870.1760.2190.0950.237组别例数TG(mmol/L)LDL⁃C(mmol/L)HDL⁃C(mmol/L)IMT(mm)SUA(μmol/L)CAS组1021.98±1.212.50±0.601.25±0.381.01±0.32316.42±79.20非CAS组1981.42±0.782.63±0.761.32±0.380.90±0.27291.88±72.14 t4.8731.5151.5043.1802.700 P0.0000.1310.1340.0020.007
BMI:body mass index;FPG:fasting plasma glucose;2hPG: 2 hour postprandial blood glucose;HbA1c:hemoglobin A1c;TC:total cholesterol;TG:triglyceride;LDL-C:low density lipid-cholesterol;HDL-C:high density lipid-cholesterol;IMT:intima-media thickness;SUA:serum uric acid
2.2 多元Logistic回归分析:以IMT为因变量,以相关指标为自变量(变量赋值见表2)进行多元Logitic回归分析,结果显示,TG、SUA、FPG是颈动脉IMT增厚的危险因素(P<0.05)。见表2,3。

表2 变量赋值表
BMI:body mass index;FPG:fasting plasma glucose;2hPG: 2 hour postprandial blood glucose;HbA1c:hemoglobin A1c;TC:total cholesterol;TG:triglyceride;LDL-C:low density lipid-cholesterol;HDL-C:high density lipid-cholesterol;SUA:serum uric acid;IMT:intima-media thickness

表3 多元Logistic回归分析
IMT:intima-media thickness;TG:triglyceride;SUA:serum uric acid;FPG:fasting plasma glucose
3 讨 论
AS是一种全身性、慢性炎症性疾病,导致心脑血管疾病的发生[4]。目前研究认为CAS斑块形成是缺血性脑卒中的重要发病原因[5]。AS主要影响大、中动脉内膜,有研究认为颈动脉内膜是最早受累的部位,主要变化是颈动脉内膜早期增厚、粗糙,血管黏稠度增加,逐渐形成斑块,斑块破裂形成栓子阻塞远端血管,斑块溃疡继发血栓形成,斑块突入管腔造成管腔狭窄,当颈动脉狭窄≥50%时可能发生血流动力学改变,引起狭窄远端血流的低灌注,导致局部组织缺血梗死[6]。颈动脉IMT是AS早期病理改变,可早期预测脑卒中等不良血管事件。本研究结果显示CAS组TG、IMT、SUA高于非CAS组,差异有统计学意义(P<0.01),提示颈动脉IMT可作为早期预测脑梗死的依据。刘啸虎等[7]研究颈动脉IMT与中青年脑梗死的相关性结果显示,脑梗死组患者颈动脉IMT水平明显高于健康对照组;多因素Logistic回归分析显示血压、血糖、TG、TC、HDL-C、LDL-C等为中青年脑梗死患者发病的危险因素,同时颈动脉IMT独立于以上危险因素,预测中青年脑梗死的发病风险明显增高(OR=2.760)。同样一项来自欧美人群的研究证实,颈动脉IMT增加及CAS性病变是缺血性卒中的预测因素[8]。
SUA主要是通过黄嘌呤脱氢酶或黄嘌呤氧化酶降解嘌呤形成的,约2/3 SUA经由肾脏排泄,其余由消化道清除。既往研究[9-10]证明SUA水平与心血管疾病相关,并且SUA水平升高的不利影响发生在动脉粥样硬化的早期阶段。Storhaug等[11]研究显示SUA 水平升高可独立预测卒中预后不良,尤其男性患者病死率增加31%。Li等[12]研究表明,SUA水平与糖尿病病程、FPG、HbA1c、HDL-C、TC呈负相关(均P<0.001),与BMI、C反应蛋白、TG、收缩压和IMT呈正相关(均P<0.05)。调整混杂因素后证明,SUA水平和代谢综合征相关,是CAS的独立危险因素。近年来随着超声技术的发展,颈动脉IMT的增加是评价AS内膜损害的重要标志,IMT是反映CAS的重要指标。本研究结果显示,CAS组SUA水平高于非CAS组,TG、SUA、FPG是颈动脉IMT增厚的危险因素(P<0.05),SUA高的患者发生颈动脉IMT增厚的危险与SUA正常患者相比,风险明显升高(OR=2.492,95%CI=1.290~2.499)。其可能机制为[13-14]:①SUA在管脉系统的有害作用机制可能与趋化因子和细胞因子表达增加,促进炎性介质的反应,如单核细胞趋化蛋白、白细胞介素6、肿瘤坏死因子α等,促进动脉硬化的发展有关;②诱导肾血管紧张素系统的激活和肾血管收缩,引起血管内皮细胞功能受损,促进局部氧化剂的生成;③升高的SUA促进LDL-C的氧化和脂质的过氧化,氧自由基生成的增加,导致内皮功能异常,显著加速血管动脉硬化进程;④SUA水平引起血浆抗氧化物浓度下降,清除自由基能力减弱;⑤激活血小板的功能,引起血小板黏附,启动凝血级联反应,促进血栓形成;⑥SUA水平的升高与内皮细胞释放一氧化氮水平的降低相关,并可能导致内皮功能失调,继而促进AS的发生与发展。
综上所述,SUA是AS性疾病的潜在危险因素,并且在疾病的早期阶段出现。SUA水平与缺血性脑卒中的发生发展有着密切的联系,为了防止SUA导致的动脉硬化,应当在疾病早期加以控制SUA水平,减少患者的不良预后。
[1] KHAN M,NAQVI L,BANSARI A,et al.Intracranial atherosclerotic disease[J].Stroke Res Treat,2011,2011:282845.
[2] KANBAY M,SEGAL M,AFSAR B,et al.The role of uric acid in the pathogenesis of human cardiovascular disease[J].Heart,2013,99(11):759-766.
[3] NOHARA R,DAIDA H,HATA M,et al.Effect of long-term intensive lipid-lowering therapy with rosuvastatin on progression of carotid intima-media thickness--Justification for Atherosclerosis Regression Treatment (JART) extension study[J].Circ J,2013,77(6):1526-1533.
[4] SILLESEN H,MUNTENDAM P,ADOURIAN A,et al.Carotid plaque burden as a measure of subclinical atherosclerosis:comparison with other tests for subclinical arterial disease in the High Risk Plaque BioImage study[J].JACC Cardiovasc Imaging,2012,5(7):681-689.
[5] ACCORSI F.Color Doppler of the extracranial and intracranial arteries in the acute phase of cerebral ischemia[J].J Ultrasound,2013,16(4):187-193.
[7] 刘啸虎,毛慧玲,李良红.颈动脉内中膜厚度与中青年脑梗死的相关性研究[J].临床荟萃,2013,28(9):1040-1041.
[8] YANG EY,CHAMBLESS L,SHARRETT AR,et al.Carotid arterial wall characteristics are associated with incident ischemic stroke but not coronary heart disease in the Atherosclerosis Risk in Communities(ARIC) study[J].Stroke,2012,43(1):103-108.
[9] ROTHENBACHER D,KLEINER A,KOENIG W,et al.Relationship between inflammatory cytokines and uric acidlevels with adverse cardiovascular outcomes in patients with stable coronary heart disease[J].PLoS One,2012,7(9):e45907.
[10] MUTLUAY R,DEGER SM,BAHADIR E,et al.Uric acid is an important predictor for hypertensive early atherosclerosis[J].Adv Ther,2012,29(3):276-286.
[11] STORHAUG HM,NORVIK JV,TOFT I,et al.Uric acid is a risk factor for ischemic stroke and all-cause mortality in the general population:a gender specific analysis from The Tromsø Study[J].BMC Cardiovasc Disord,2013,13:115.
[12] LI Q,YANG Z,LU B,et al.Serum uric acid level and its association with metabolic syndrome and carotid atherosclerosis in patients with type 2 diabetes[J].Cardiovasc Diabetol,2011,10:72.
[13] TAKAYAMA S,KAWAMOTO R,KUSUNOKI T,et al.Uric acid is an independent risk factor for carotid atherosclerosis in a Japanese elderly population without metabolic syndrome[J].Cardiovasc Diabetol,2012,11:2.
[14] TSIOUFIS C,KYVELOU S,DIMITRIADIS K,et al.The diverse associations of uric acid with low-grade inflammation,adiponectin and arterial stiffness in never-treated hypertensives[J].J Hum Hypertens,2011,25(9):554-559.
(本文编辑:赵丽洁)
2014-06-09;
2014-08-23
唐山市科学技术研究与发展指导计划项目(13130251b)
詹红艳(1973-),女,河北唐山人,河北省唐山市丰润区第二人民医院主治医师,医学硕士,从事神经内科疾病诊治研究。
*通讯作者。E-mail:chenlili20107@sohu.com
R743
B
1007-3205(2014)12-1420-03
10.3969/j.issn.1007-3205.2014.12.020

