IBDV丝素蛋白/壳聚糖DNA微球疫苗的制备及免疫原性分析
刘岩,吕志强,张存,祝新荣,石团员,钟石,孟智启
1 浙江省农业科学院蚕桑研究所 浙江省植物有害生物防控重点实验室——省部共建国家重点实验室培育基地,浙江 杭州310021
2 浙江省农业科学院畜牧兽医研究所,浙江 杭州 310021
传染性法氏囊病 (Infectious bursal disease,IBD) 是目前危害世界养禽业的三大主要传染病之一,其病原传染性法氏囊病病毒 (Infectious bursal disease virus, IBDV) 主要侵害雏鸡中枢免疫器官法氏囊,而引起免疫抑制为主的淋巴细胞衰竭综合症,进而造成对多种病原的易感性增加和其他疫苗的免疫失败。预防 IBD的传统方法是用减毒疫苗或灭活苗免疫鸡群,前者效果优于后者。但减毒疫苗一般仍保留了对雏鸡的中等毒力,基因工程亚单位疫苗则由于实验技术与成本等问题,产业化难度较大。与此相比,DNA疫苗则具有不受母源抗体影响、无感染风险、可以同时刺激机体产生体液和细胞免疫反应、成本低廉等优点[1],但目前使用的DNA疫苗需要大剂量才能维持其免疫反应,这与DNA疫苗肌注后,大部分在转运到组织细胞前发生降解失活,而致使转运到组织细胞 (特别是抗原递呈细胞) 的转运效率较低[2-4]。
近年来在药物递呈上使用的微球技术为这一问题的解决提供了新思路[5-6]。目前微球给药系统常用载体材料有PLGA、海藻酸钠、壳聚糖及其衍生物、蚕丝蛋白等生物降解材料。其中,来源于甲壳素脱乙酰化产物的壳聚糖(Chitosan,CS) 因其价格低廉、来源广泛、性质稳定、生物相容性和可降解性好、毒性极小等优点,已经广泛用作药物、酶和疫苗的微球载体[7-9]。家蚕丝素蛋白 (Silk fibroin, SF) 是一种源于蚕丝的弱两性氨基酸材料,与壳聚糖共混可交联成半互穿聚合物网络结构,可弥补壳聚糖球囊韧性差、降解快的缺点;同时也有利于改善单纯丝素蛋白干燥后脆性变大、形态差异大、成型不理想等缺点[10]。为此,本研究利用丝素蛋白-壳聚糖两种材料为壁材,以 IBDV DNA疫苗为芯材,研制缓释 DNA微球疫苗,探索预防 IBD的新途径,为研制新型鸡传染性法氏囊病毒疫苗进行探索性研究。
1 材料与方法
1.1 主要材料
蚕茧由浙江省农业科学院蚕桑研究所提供;壳聚糖脱乙酰度90%,粘度<100 cps (购自Sigma公司);pCI-VP2/4/3质粒[11]含 IBDV 多聚蛋白基因,由浙江大学动物预防兽医研究所构建并提供;质粒提取相关试剂、PCR酶及电泳检测试剂购自上海生工生物工程有限公司;其他生化试剂购自浙江长青化工公司。
1.2 质粒DNA的大量制备与纯化
碱裂解法大量抽提制备质粒pCI-VP2/4/3,用Sepharose 2B过柱纯化后溶于无菌PBS (pH 7.2)缓冲液中,紫外分光光度法测定核酸样品的纯度和浓度,–20 ℃保存备用。
1.3 壳聚糖及丝素蛋白溶液的制备
将壳聚糖以 1∶100的浴比溶解于 2%冰乙酸溶液中,形成无色透明粘稠溶液;调节pH为4.6、5.0、5.5并分别保存备用。
配制0.5% Na2CO3水溶液,将剪碎的蚕茧按20 g/L比例投入并加热煮沸0.5 h,取出用蒸馏水洗净,重复两次。50 ℃烘干后称取适量脱胶蚕丝,按文献[12]方法在60 ℃下溶解于9.3 mol/L LiBr,或在 80 ℃下溶解于氯化钙三元溶解体系 (摩尔比为 CaCl2∶C2H5OH∶H2O=1∶2∶8)[13-14],先将无水C2H5OH和H2O 混合,然后把一定量的脱胶桑蚕丝 (剪成2 cm左右) 浸入其中,润湿后加入无水CaCl2。搅拌,置60 ℃下继续搅拌制得丝素溶胶。再经半透膜 (MWCO 3500,Pierce) 在蒸馏水流水透析3 d除盐,离心弃去溶解过程中的少量凝聚物,确定最后丝素溶液的浓度[15]。
1.4 微球的制备
1.4.1 戊二醛交联剂法
[16]方法,取 50 mL液体石蜡和2 mL span-80在55 ℃左右搅拌片刻,缓慢加入1%的壳聚糖、DNA溶液,在55 ℃左右充分搅拌成W/O型乳液。调节乳液pH值在5.5,滴加pH 5.5的3%丝素蛋白溶液继续搅拌,并将pH调至中性,缓慢加入适量戊二醛交联,随后室温静置数小时。产物经离心分离、过滤、异丙醇和无水乙醇洗涤以及真空干燥得到粉末状丝素蛋白壳聚糖DNA微球。
按上述方法,去除滴加丝素溶液和/或pCI-VP2/4/3 DNA溶液步骤,制备出壳聚糖微球、丝素蛋白壳聚糖微球、壳聚糖DNA微球。
1.4.2 Na2SO4沉淀法
参考文献[17]和[18]在 Na2SO4溶液中配制不同浓度的质粒DNA疫苗,将含DNA的Na2SO4溶液与壳聚糖溶液等比例混合,室温搅拌10 min,自发形成乳白色微球,经 10 000 r/min离心15 min,弃去悬浮液后,沉淀用无菌水保存备用。
1.5 微球性状的观察
将不同条件下制备的微球分散在载玻片上,用倒置生物显微镜观察微球形态,拍照记录。另取适量微球液,通过激光纳米粒度分析仪 (英国Malvern仪器有限公司) 测定其粒径。参考文献[19]将微球混合液 20 000×g离心20 min后,取上清溶液测定OD260,根据如下公式计算微球对DNA疫苗的荷载率:

参考文献[18]通过在裸 DNA (3 μg溶解在20%的 Na2SO4)、微球悬浮液 10 μL (3 μg DNA)中加入DNaseⅠ,置37 ℃下作用15 min后电泳检测各组的DNA完整性。
1.6 动物试验的分组和免疫
14日龄非免疫鸡随机分成5组 (16只/组),分别为pCI-VP2/4/3质粒免疫组 (A组)、CS/pCIVP2/4/3微球免疫组 (B组)、SF-CS/pCI-VP2/4/3微球免疫组 (C组)、攻毒对照组 (D组) 和正常对照组 (E组)。肌肉多点注射,其中A组注射在 PBS 中溶解的重组质粒 (1.0 μg/μL) 200 μL/只;B组、C组分别测定包封率后按200 μg/只的荷载DNA量进行免疫;首免2 周后进行加强免疫,剂量与首免注射时相同。试验鸡于首免前0 d、首免后7 d、14 d和加强免疫后7 d、14 d、21 d、28 d、35 d 进行心脏采血,室温静置分离血清,并于–20 ℃保存备用。
1.7 抗IBDV血清ELISA抗体效价的测定
所有试验组定期随机采集 4 只鸡外周血,室温静置分离血清,56 ℃灭活30 min,–20 ℃保存备用。参照传染性法氏囊病病毒ELISA抗体检测试剂盒 (购自北京IDEXX生物科技有限公司) 操作说明进行检测,在650 nm测量记录吸光值。根据试剂盒说明计算样品 (Sample,S) 和阳性对照 (Positive control,P) 的S/P值,检测各组样品的 ELISA抗体水平。其中,样品 S/P值≤0.2,判为阴性;样品的S/P值>0.2判为阳性。
1.8 攻毒试验
试验组鸡各取 8只,于加强免疫后 3周时分别攻击中国标准强毒株BC6/85 株(100 bursal ID50/只,购自中国兽药监察所),同时设置空白对照组隔离饲养,攻毒后连续观察3 d。然后人工捕杀,称取鸡体重、法氏囊重和脾重,计算平均囊体比和脾体比,检查鸡的法氏囊、脾脏等器官的眼观病变。
1.9 统计学分析
利用SPSS 11.0软件包按生物统计学上的方差分析法对平均囊体比、平均脾体比、抗IBDV血清ELISA 抗体效价数据进行统计学处理,显著水平为P<0.05。
2 结果
2.1 丝素蛋白溶液的制备
通过比较三元复合剂、氯化锂、溴化锂、稀盐酸 4种溶剂溶解丝素后发现:氯化锂溶液很难溶解丝素蛋白;稀盐酸60 ℃下长时间处理后,丝素有一定的溶解,但残余未溶解渣滓较多;三元CaCl2复合溶液、9.3 mol/L的溴化锂两种溶液能完全溶解丝素蛋白,溶解后的溶液粘稠微黄;但相比较而言,三元复合剂的溶解速度更快,成本更低。
2.2 Na2SO4沉淀和戊二醛交联法制备微球的比较
壳聚糖、DNA疫苗混合丝素蛋白溶液,在Na2SO4盐溶液作用下,溶液发生凝聚形成白色浊状物,离心后出现微球沉积在管底 (图 1)。壳聚糖和丝素混合液在石蜡和 Span-80乳化下形成白色沉淀,逐滴加入适量戊二醛交联后产生出淡黄色微球沉淀。
将Na2SO4沉淀和戊二醛交联法制备的微球上清、沉淀分别作为模板,进行IBDV DNA片段的PCR扩增结果发现,戊二醛交联方法制备的壳聚糖DNA微球、丝素蛋白-壳聚糖DNA复合微球上清和沉淀均未扩增到目的条带;而以Na2SO4沉淀法制备微球沉淀中扩增获得相应条带,上清中无对应条带;表明戊二醛交联影响了疫苗DNA正常的扩增反应活性,而Na2SO4沉淀法制备的微球中,荷载DNA能正常扩增 (图2)。

图1 Na2SO4沉淀和戊二醛交联法制备的微球Fig. 1 Microspheres prepared in glutaraldehyde and Na2SO4 solution. 1: the SF/CS microspheres formed in Na2SO4 solution; 2: the emulsification products treated with paraffin and Span-80; 3: the microspheres products cross-linked by glutaraldehyde.
2.3 SF-CS微球工作条件的建立及其特性
对不同 Na2SO4浓度和壳聚糖 pH值条件下制备微球的检测发现:不同Na2SO4浓度条件下均可形成球囊,微球形成速度与Na2SO4浓度呈正相关性,与pH呈负相关性 (图3);0.2%以上壳聚糖浓度在包囊效果上差异不明显,但CS的pH显著影响微球形成速度和微球粒径大小;微球粒径还与丝素蛋白浓度呈正相关关系,但不同丝素蛋白浓度对微球的电泳、DNA扩增活性无明显影响。综合微球形态、荷载DNA活性等的检测后,研究确定壳聚糖浓度0.5% (pH 5.0),丝素蛋白浓度0.6%,质粒DNA溶解在2% Na2SO4溶液中,配制成浓度500 μg/mL的工作条件。
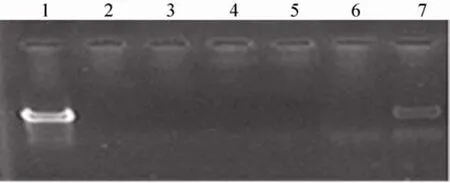
图 2 戊二醛交联法和 Na2SO4沉淀制备上清及微球沉淀的PCR扩增结果Fig. 2 PCR product of the microsphere samples cross linked by glutaraldehyde and Na2SO4. 1: PCR product of pCI-VP2/4/3 plasmid as positive control; 2–5 samples were cross-linked by glutaraldehyde while lane 6–7 were prepared in Na2SO4 solution. 1:pCI-VP2/4/3 plasmid; 2: CS/pCI-VP2/4/3 supernatant;3: CS/pCI-VP2/4/3 precipitate; 4: SF-CS/pCI-VP2/4/3 supernatant; 5: SF-CS/pCI-VP2/4/3 precipitate; 6:SF-CS/pCI-VP2/4/3 supernatant; 7: SF-CS/pCIVP2/4/3 precipitate.

图 3 不同 Na2SO4和壳聚糖 pH对微球形成的影响表现Fig. 3 Effects of Na2SO4 concentration and chitosan pH on the formation of microcapsules.
从图 4结果可见,微球能有效保护荷载DNA疫苗免受DNaseⅠ的降解,粒径仪检测显示SF-CS/pCI-VP2/4/3微球大小1.98 μm;荷载率89.14%。
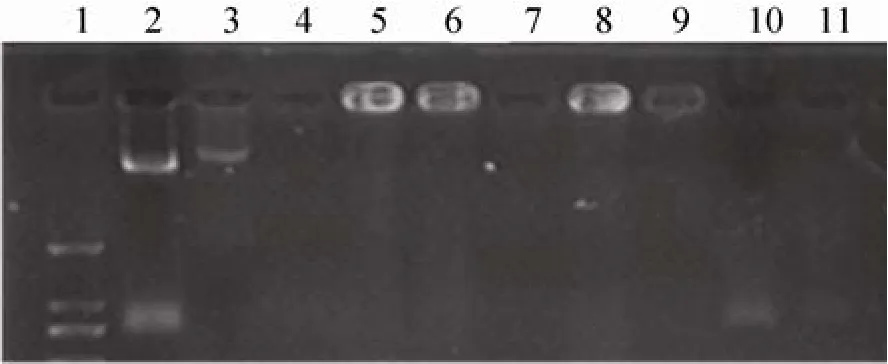
图4 DNase I对微球荷载DNA的消化表现Fig. 4 Digestion performance of different microsphere sample with or without DNaseⅠ. 1: DNA ladder’s three bands (2 000 bp, 1 000 bp and 750 bp from top to bottom) were showed respectively; 2–6 were samples treated before DNaseⅠdigestion while 7–11 were treated after DNaseⅠdigestion. 1: DNA ladder (DL2000); 2: pCI-VP2/4/3 plasmid in TE; 3:pCI-VP2/4/3 plasmid in 2% Na2SO4; 4: SF-CS/pCIVP2/4/3 supematant; 5: SF-CS/pCI-VP2/4/3 precipitate;6: SF-CS/pCI-VP2/4/3 microcapsule mixture; 7: SF-CS/pCIVP2/4/3 supematant; 8: SF-CS/pCI-VP2/4/3 precipitate;9: SF-CS/pCI-VP2/4/3 microcapsule mixture; 10:pCI-VP2/4/3 plasmid in TE; 11: pCI-VP2/4/3 plasmid in 2% Na2SO4.
2.4 抗IBDV血清ELISA抗体效价的测定
DNA 疫苗各试验组血清抗体效价动态规律如图 5所示,免疫前后不同时间采集各组试验鸡血清,检测并计算出ELISA抗体水平 (S/P值表示)。首免后2周内各疫苗组的抗IBDV血清ELISA 抗体效价均呈上升趋势,且相互之间并无明显差别。2周后的检测发现微球DNA疫苗组的抗IBDV 血清ELISA抗体效价开始明显高于单纯pCI-VP2/4/3免疫组(P< 0.05);特别是丝素蛋白-壳聚糖复合微球组,在之后的血清ELISA抗体效价动态检测中呈现更高的上升趋势,ELISA抗体效价优于CS/pCI-VP2/4/3微球疫苗组(P< 0.05)。这说明微球佐剂能更好地保护DNA疫苗,有效诱导抗IBDV血清ELISA抗体。相比较单纯的壳聚糖微球,添加丝素蛋白的复合微球对刺激机体产生的抗 IBDV血清ELISA抗体水平更高,这也表明了丝素蛋白所具有的非特异性免疫促进作用 (图5)。在整个试验过程中,正常对照组未检测到抗 IBDV特异性抗体。
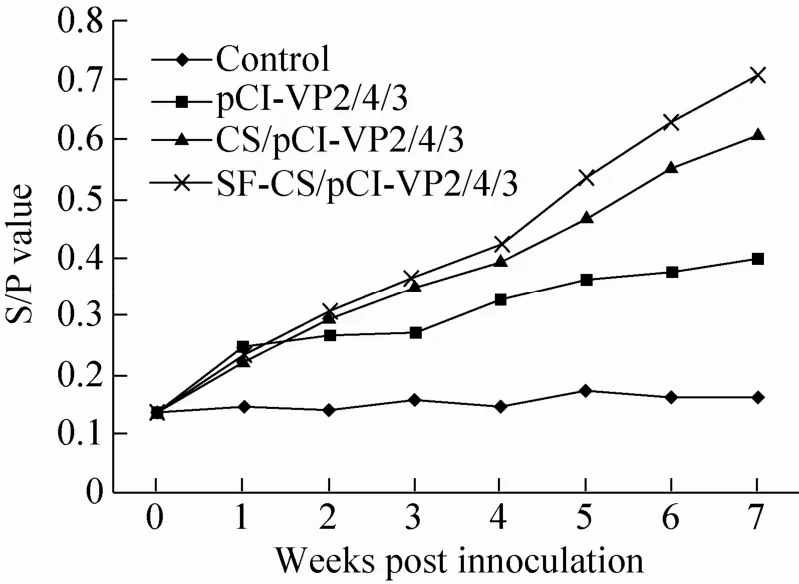
图 5 DNA 疫苗各试验组外周血抗 IBDV血清ELISA抗体效价动态规律Fig. 5 Peripheral blood anti-IBDV ELISA antibody levels of chickens immunized with different DNA vaccines.
2.5 DNA疫苗各试验组对强毒的攻击保护效果观察
在加强免疫3周后,用中国标准强毒株BC6/85攻击。攻毒3 d观察发现攻毒对照组出现IBD典型的临床症状、病理变化和组织学病变。病鸡主要表现精神萎顿、羽毛蓬松、拉白色粪便,剖检发现法氏囊和脾脏肿大。正常对照组和免疫组鸡只精神良好,临床表现上无明显差异。剖取法氏囊、脾脏,计算囊体比 (B/B)、脾体比(S/B) 统计结果 (表 1) 显示:免疫组和正常对照组间囊体比、脾体比值无明显差异;但均与攻毒对照组间有差异 (P<0.05)。
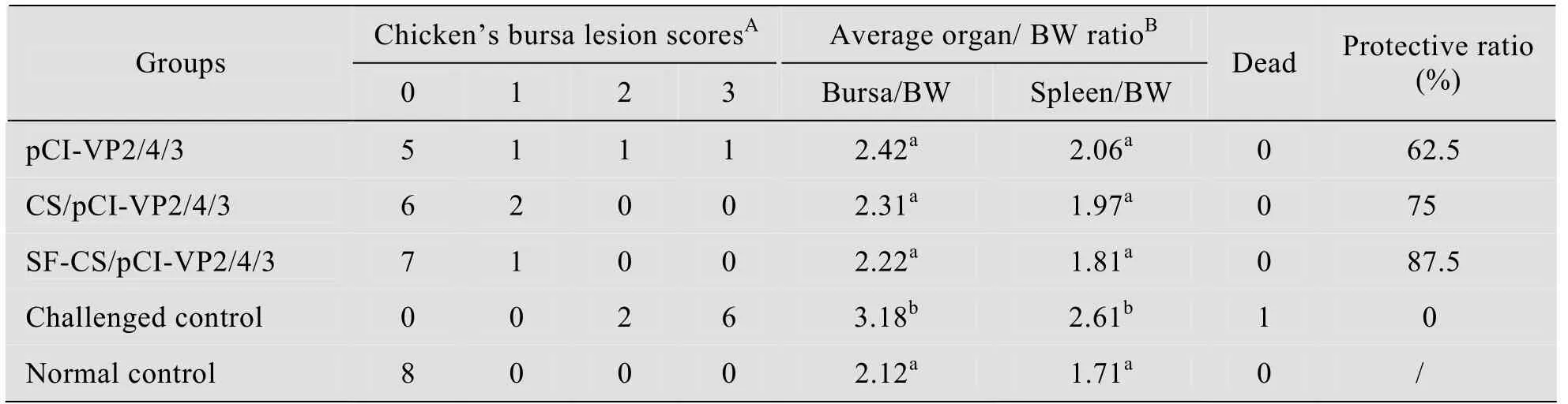
表1 不同疫苗组免疫后对强毒株BC6/85攻击的保护效果比较Table 1 Comparison of protective immune responses of different IBDV DNA vaccine immunized chickens challenged by virulent strain BC6/85
3 讨论
近年来,传染性法氏囊病呈现发病季节不固定和发病日龄两级分化的新特点,并随着IBDV超强毒株、变异株,以及感染后疫苗接种副作用增加等问题的出现,使整个防治工作变得更加错综复杂[20]。除了传统的减毒和灭活疫苗外,国内外研究者相继针对 IBDV VP2或VP2/4/3基因开展了大量工作,研究出了不同来源、不同表达系统的 VP2或 VP2/4/3基因工程亚单位疫苗,尽管试验结果提示这种疫苗有良好的免疫原性,但应用上仍不同程度地受到成本和实验技术等问题的制约[21]。因为存在易降解、递呈效率偏低等缺点,IBDV DNA疫苗的应用也受到制约[2,4]。此前学者曾用免疫刺激复合物 (ISCOM)[11]、鸡白细胞介素 2[22-23]、鸡白细胞介素18[24]与IBDV DNA疫苗配合使用,以促进机体特异性免疫应答。本研究在前人研究基础上,利用丝素蛋白、壳聚糖两种生物高分子材料为壁材,以IBDV VP2/4/3 DNA疫苗为芯材,研制出了复合缓释DNA微球疫苗,并验证了微球化IBDV DNA疫苗的保护及免疫原性,从血清抗 IBDV ELISA抗体及攻毒保护试验结果来看,微球特别是丝素-壳聚糖复合微球对机体免疫水平的提高有正促进作用。徐怀英等以壳聚糖为囊材,新城疫病毒液为芯材,戊二醛为交联剂,选择适当乳化系统制备新城疫微球疫苗,免疫SPF鸡群后的MTT试验、血清lgG HI试验等检测表明壳聚糖微球疫苗兼具了弱毒活疫苗和灭活苗的优点,具有较好的免疫效果[8-9]。Sun等对鸭疱疹病毒 glycoprotein C的DNA疫苗免疫研究中发现,壳聚糖载体能促进质粒DNA疫苗在鸭体多组织的分布[25]。这也与Tian等[1]和 Plapied等[26]的研究报道相一致。Friede等也认为微球颗粒有缓释抗原、减少注射剂量和促进抗原递呈至粘膜组织淋巴细胞的作用[27]。本研究结果证实微球化疫苗具有保护疫苗体内运输稳定性、控制包被抗原缓慢释放、提高局部抗原浓度、延长抗原刺激时间和使抗体滴度维持较高水平的作用,而且还可保护抗原免受外界不良因素 (如有机溶剂、较低或较高pH环境、蛋白酶等) 的影响或破坏[28-29]。
壳聚糖微球具有无毒、生物相容性和可降解性,能够增加肠道淋巴细胞中IgA、IgG水平和激活补体,刺激巨噬细胞活化,增强吞噬能力,促进粘膜中抗原递呈细胞对抗原的摄取等优点[30];Aaharoff等的研究表明,在没有其他佐剂的情况下,壳聚糖水溶液能增强由皮下注射蛋白抗原所产生的体液免疫应答和细胞介导的免疫应答[31];Chirasak等也报道壳聚糖微球能有效递呈抗原至 DC和 MΦ细胞[32]。但由于单纯壳聚糖微球在水中易溶胀,造成荷载药物的突释[33],而且壳聚糖制成的产品冻干后较硬,缺乏弹性[34-35]。来源于蚕丝脱胶后获得的丝素蛋白,是一种天然高分子纤维蛋白。具有优良的生物相容性、力学强度和柔韧性。丝素及其降解产物氨基酸对组织无毒性、无致敏和无刺激作用。丝素中含有丰富的酰胺基和少量羟基,可与壳聚糖形成氢键,破坏壳聚糖链本身之间的氢键,使壳聚糖中的一部分氨基得以自由。将丝素和壳聚糖这两种天然高分子物质共混,就可以克服单一组分的缺点。刘丽萍等以壳聚糖/丝素复合高分子为骨架材料研制了 5-Fu磁微球,研究发现其在药物的缓释和靶向定位方面具有一定的应用价值[36];张幼珠等以消炎痛药物为芯料,通过复凝聚法制备再生丝素蛋白-壳聚糖包药微球、单凝聚法制备壳聚糖包药微球,经比较形貌、粒径、包囊率、释药率等质量指标后发现,丝素-壳聚糖包药微球成囊,包囊率高,药物释放效果更好[33]。张文元等对SF/CS形成的复合材料体外研究发现,SF/CS共混材料具有良好的细胞相容性,对BMSC细胞无毒,是组织工程中很有应用前景的一种材料的研究[37]。本研究将丝素蛋白与壳聚糖共混制备的复合微球DNA疫苗,免疫效果也表现更佳;与前人[37-38]研究结果相吻合。这种功能可能一方面与双层膜微球球壁增厚,以及双层膜间层间所具有的缓冲室功能有关[33];另一方面也与丝素蛋白具有抗肿瘤、免疫刺激等功能有关[39]。
本研究利用了戊二醛和 Na2SO4两种交联剂,尽管都可以形成微球,但从DNA活性检测上发现前者对DNA活性影响很大,这可能与戊二醛交联时与包封的DNA疫苗发生共价结合有关[40];而在适量Na2SO4环境下,阴离子与壳聚糖所荷的正电荷发生乳化-离子交联,制备微球DNA疫苗中,不影响 DNA活性。类似的还有用 TPP[41]等阴离子试剂发生离子交联的原理来制备微球的报道。微球的形成及粒度大小的均匀度与工作条件 (如盐溶液浓度、DNA疫苗浓度、操作温度和搅拌速度) 密切相关;各材质质量配比显著影响微球形态和形成过程,这使得通过可控性调节各种材料浓度、配比以改变微球的显微结构,最终获得达到预期标准的微球成为可能。但这些变量因素也降低了实验的可重复性,实验条件稍微改变就会使微球结构改变,加之制备材料无统一的质量标准,更增加了实验的难度。建立稳定高效的微球疫苗工艺需要更多的细致工作,譬如对不同条件下微球的形态结构、释药速度、累积释放率、保存条件、保存时间和免疫试验途径等尚需进一步研究。总体而言,随着今后安全、靶向、控释、缓释型微球佐剂的研究的不断深入,微球化技术有望在疫苗、药物等领域有更广泛的应用。致谢:感谢浙江省农业科学院畜牧兽医研究所陈柳、倪征老师在动物试验方面给予的大力支持,感谢何丽华、沈卫锋、陈金娥在动物攻毒和淋巴细胞检测中提供的帮助。
[1]Tian J, Yu J, Sun X. Chitosan microspheres as candidate plasmid vaccine carrier for oral immunisation of Japanese flounder (Paralichthys olivaceus). Vet Immunol Immunopathol, 2008,126(3/4): 220–229.
[2]Pachuk CJ, McCallus DE, Weiner DB, et al. DNA vaccines-challenges in delivery. Curr Opin Mol Therapy, 2000, 2(2): 188–198.
[3]Dubensky TW, Liu MA, Ulmer JB. Delivery systems for gene based vaccines. Mol Med, 2000,6(9): 723–732.
[4]Wu XF, Shi HY. Application of biodegradable polymeric microspheres in vaccine research. Chin J Biol, 2007, 20(8): 620–624 (in Chinese).
吴秀芳, 石慧颖. 可生物降解聚合物微球在疫苗研究中的应用. 中国生物制品学杂志, 2007,20(8): 620–624.
[5]Smith DM, Simon JK, Baker JR Jr. Applications of nanotechnology for immunology. Nat Rev Immunol, 2013, 13(8): 592–605.
[6]Gregory AE, Titball R, Williamson D. Vaccine delivery using nanoparticles. Front Cell Infect Microbiol, 2013, 3: 13.
[7]Vijay SY, Sadhana SR. Unprecedented chitin and chitosan: a chemical overview. J Polym Environ,2013, 21(2): 606–614.
[8]Xu HY, Qin ZM, Wang YL, et al. Studies on the preparation and immunity effect of NDV chitosan microsphere. Sci Agri Sin, 2008, 41(2): 576–581(in Chinese).
徐怀英, 秦卓明, 王友令, 等. 鸡新城疫壳聚糖微球疫苗的制备及免疫效果研究. 中国农业科学, 2008, 41(2): 576–581.
[9]Zhai RL, Xu HY, Wang YL, et al. Study on immune efficacy of Newcastle disease chitosan microsphere vaccine. Acta Microbiol Sin, 2007,47(4): 692–696 (in Chinese).
翟荣玲, 徐怀英, 王友令, 等. 新城疫壳聚糖微球疫苗免疫效果的研究. 微生物学报, 2007,47(4): 692–696.
[10]Malaekeh-nikouei B, Sajadi-tabassi SA, Jaafari MR. Preparation, characterization, and mucoadhesive properties of chitosan-coated microspheres encapsulated with cyclosporine A.Drug Dev Ind Pharm, 2008, 34(5): 492–498.
[11]Li JR, Yu L, Huang YW, et al. Study on immunogenicity of plasmid DNA encoding polyprotein (VP2/VP4/VP3) of infectious bursal disease virus formulated with ISCOM. Chin J Virol, 2001, 17(4): 341–348 (in Chinese).
李建荣, 于涟, 黄耀伟, 等. 免疫刺激复合物(ISCOM) 介导的传染性法氏囊病病毒多聚蛋白基因免疫的研究. 病毒学报, 2001, 17(4):341–348.
[12]Mandal BB, Mann JK, Kundu SC. Silk fibroin/gelatin multilayered films as a model system for controlled drug release. Eur J Pharm Sci, 2009, 37(2): 160–171.
[13]Tao W, Li M, Zhao C. Structure and properties of regenerated antheraea pernyi silk fibroin in aqueous solution. Int J Biol Macromol, 2007, 40(5): 472–478.
[14]Lv Q, Cao C, Zhang Y, et al. The preparation of insoluble fibroin films induced by degummed fibroin or fibroin microspheres. J Mater Sci Mater Med, 2004, 15(11): 1193–1197.
[15]Wang X, Wenk E, Matsumoto A, et al. Silk miciropheres for encapsulation and controlled release. J Control Release, 2007, 117(3): 360–370.
[16]Zhang Y, Wang BC, Chi SP, et al. Study on preparation of 5-fluorouracil loaded silk fibroin/chitosan microcapsules. Pharm Biotechnol, 2009,16(6): 545–549 (in Chinese).
张鋆, 王伯初, 迟少萍, 等. 一种 5-氟尿嘧啶的丝素蛋白-壳聚糖微囊的制备. 药物生物技术,2009, 16(6): 545–549.
[17]Rajesh Kumar S, Ishaq Ahmed VP, Parameswaran V, et al. Potential use of chitosan nanparticles for oral delivery of DNA vaccine in Asian sea bass(Latescalcarifer) to protect from vibrio(Listonella) anguillarum. Fish Shellfish Immunol,2008, 25(1/2): 47–56.
[18]Deveci SS, Basal G. Preparation of PCM microcapsules by complex coacervation of silk fibroin and chitosan. Colloid Polym Sci, 2009, 287:1455–1467.
[19]Lee DW, Yun KS, Ban HS, et al. Preparation and characterization of chitosan/polyguluronated nanoparticles for siRNA delivery. J Control Release, 2009, 139(2): 146–152.
[20]Tao CC, Xue BY, Hua GL, et al. Epidemic characteristics and control measures of infectious bursal disease. Poultry Sci, 2009, 7: 26–27 (in Chinese).
陶长城, 薛邦玉, 华桂林, 等. 当前鸡传染性法氏囊病的流行特点和防治措施. 家禽科学, 2009,7: 26–27.
[21]Yu B, Yan ZX, Wang PY. Status and development of chicken infectious bursal Bursal disease vaccine.Chin Animal Health Inspec, 2009, 26(4): 73–75 (in Chinese).
郁斌, 闫志宪, 王培永. 鸡传染性法氏囊病新型疫苗研究现状及发展趋势. 中国动物检疫, 2009,26(4): 73–75.
[22]Xie RH, Wang WJ, Li L, et al. Enhancement of immunogenicity of DNA vaccine against infectious bursal disease virus by co-delivery with oral vaccine encoding chicken interleukin-2. J Zhejiang Univ: Sci B, 2007, 33(3): 237–242 (in Chinese).
谢荣辉, 万旺军, 李龙, 等. 鸡白细胞介素 2 口服免疫佐剂增强传染性法氏囊病病毒DNA 疫苗免疫效果的研究. 浙江大学学报: 农业与生命科学版, 2007, 33(3): 237–242.
[23]Wang WJ, Xie RH, Li L, et al. Enhanced immunogenicity of DNA vaccine encoding infectious bursal disease virus VP2/4/3 and ChIL-2 fusion gene. Chin J Virol, 2006, 22(2): 137–143 (in Chinese).
万旺军, 谢荣辉, 李龙, 等. 传染性法氏囊病病毒 VP2/4/32ChIL22融合基因 DNA 疫苗免疫原性研究. 病毒学报, 2006, 22(2): 137–143.
[24]Lü DM, Weng JF, Yu L. Immunoenhancement on IBDV DNA vaccine by embryo vaccination with plasmid DNA encoding chicken interleukin-18.Chin J Prevent, 2009, 31(2): 150–155 (in Chinese).
吕冬梅, 翁继峰, 于涟. 鸡胚接种鸡白细胞介素18重组质粒对IBDV DNA疫苗免疫增强作用的研究. 中国预防兽医学学报, 2009, 31(2):150–155.
[25]Sun KF, Li X, Jiang JF, et al. Distribution characteristics of DNA vaccine encoded with glycoprotein C from Anatid herpesvirus 1 with chitosan and liposome as deliver carrier in ducks.Virol J, 2013, 10: 89–95.
[26]Plapied L, Vandermeulen G, Vroman B, et al.Bioadhesive nanoparticles of fungal chitosan for oral DNA delivery, Int J Pharm, 2010, 398(1/2):210–218.
[27]Friede M, Aguado MT. Need for new vaccine formulations and potential of particulate antigen and DNA delivery systems. Adv Drug Deliv Rev,2005, 57(3): 325–331.
[28]Liu XX, Gong JS. Application and prospects of microcapsule technology in veterinary biological products. Guide Chin Poul, 2005, 22(13): 16–17 (in Chinese).
刘学贤, 龚建森. 微胶囊技术在兽医生物制品中的应用状况和前景. 中国禽业导刊, 2005, 22(13):16–17.
[29]Gong JS, Lü XJ, Shi ZY, et al. The preparation of fowl cholera microencapsulated vaccine with ethylcellulose by emulsion-solvent diffusion method. Acta Agri Univ Jiangxiensis, 2008, 30(5):874–877 (in Chinese).
龚建森, 吕晓娟, 施祖灏, 等. 乳化-溶剂挥发法制备禽霍乱乙基纤维素微胶囊疫苗. 江西农业大学学报, 2008, 30(5): 874–877.
[30]Raftery R, O'Brien FJ, Cryan SA. Chitosan for gene delivery and orthopedic tissue engineering applications. Molecules, 2013, 18(5): 5611–5647.
[31]Zaharoff DA, Rogers CJ, Hance KW, et al.Chitosan solution enhances both humoral and cell-mediated immune responses to subcutaneous vaccination. Vaccine, 2007, 25(11): 2085–2094.
[32]Chirasak K, Vimolmas L, Nontima V, et al.Spray-dried chitosan microparticles for cellular delivery of an antigenic protein physic-chemical properties and cellular uptake by dendritic cells and macrophages. Pharm Res, 2013, 30(6): 1677–1697.
[33]Zhang YZ, Lei XY, Wang XB, et al. Study on the quality of medicine microcapsule wrapped with regenerated fibroin protein-chitosan. J Donghua Univer Sci, 2003, 29(5): 117–121 (in Chinese).
张幼珠, 雷晓英, 王新波, 等. 再生丝素蛋白-壳聚糖包药微囊的质量研究. 东华大学学报, 2003,29(5): 117–121.
[34]Yang YD, Zhang WY, Fang GJ. Three-dimensional degradable porous scaffolds made by silk fibroin-chitosan composite. J Clin Rehabilit Tiss Eng Res,2009, 13(51): 12–17 (in Chinese).
杨亚东, 张文元, 房国坚. 丝素-壳聚糖符合制作的三维可降解多孔支架. 中国组织工程研究与临床康复, 2009, 13(51): 12–17.
[35]Agapova II, Pustovalova OL, Moisenovich MM, et al. Three-dimensional scaffold made from recombinant spider silk protein for tissue engineering. Dokl Biochem Biophys, 2009, 426:127–130.
[36]Liu LP, Li P, Wu ZZ, et al. Preparation of 5-fluorouracil loaded chitosan/fibroin blend magnetic microspheres and its propertiesin vitro.Chin Pharm J, 2003, 38(10): 774–777 (in Chinese).
刘丽萍, 李苹, 吴泽志, 等. 5-Fu壳聚糖/丝素复合磁微球的制备及体外性质研究. 中国药学杂志, 2003, 38(10): 774–777.
[37]Zhang WY, Yang YD, Fang GJ. Cytotoxicity test of chitosan-silk fibroin scaffold material to BMSCsin vitro. Chin J Health Labor Technol, 2010,20(10): 2395–2397 (in Chinese).
张文元, 杨亚冬, 房国坚. 壳聚糖-丝素支架材料的细胞毒性检测. 中国卫生检验杂志, 2010,20(10): 2395–2397.
[38]Wang XL, Zhang WJ, Liu F, et al. Intranasal immunization with live attenuated influenza vaccine plus chitosan as an adjuvant protects mice against homologous and heterologous virus challenge. Arch Virol, 2012, 157: 1451–1461.
[39]Byun EB, Sung NY, Kim JH, et al. Enhancement of anti-tumor activity of gamma–irradiated silk fibroin via immunomodulatory effects. Chem Biol Interact,2010, 186: 90–95.
[40]Liu SK, Gao S, Zhong Q, et al. Progress of microspheres delivery system loaded with DNA vaccine. Chin Pharm J, 2003, 38(11): 828–831 (in Chinese).
刘善奎, 高申, 钟强, 等. DNA 疫苗微球给药系统的研究进展. 中国药学杂志, 2003, 38(11):828–831.
[41]Ko JA, Park HJ, Park YS, et al. Chitosan microparticle preparation for controlled drug release by response surface methodology. J Microencapsul, 2003, 20(6): 791–797.

