注射用核糖核酸II对消化道肿瘤的临床疗效观察
蔡良真 黄胜波 孙茂本
注射用核糖核酸II对消化道肿瘤的临床疗效观察
蔡良真 黄胜波 孙茂本
目的 观察注射用核糖核酸II(以下简称:核II)对晚期消化道肿瘤患者的疗效和安全性。方法 80例晚期消化道肿瘤患者单盲随机分为核II组和对照组, 对照组采用单纯化疗方案, 核II组于化疗同时静脉滴注核I.200 mg/d, 连续45 d (一个疗程)后检测患者T细胞亚群的变化、外周白细胞变化、毒副不良反应发生率、并通过 Karnofsky评分评价患者的生活质量。结果 ① 核II组化疗后 CD3、CD4、CD56的阳性率明显高于对照组(P<0.05)。②核II组化疗后的白细胞下降程度、不良反应II度发生比例均明显低于对照组(P<0.05)。③核II组化疗后Karnofsky评分升高比例57.5%明显高于对照组42.5%。结论 ①核II可刺激T细胞成熟和分化, 显著提高机体免疫功能。②核II可减少化疗过程中患者白细胞的下降、毒副反应的发生。③化疗联合核II可以有效改善患者生活质量。
注射用核糖核酸II;消化道肿瘤;免疫;生活质量
消化道肿瘤是较为常见的恶性肿瘤, 尤其是胃癌长期位居各癌症之首[1]。肿瘤的发生、转移及复发过程常伴随机体免疫功能的降低, 目前放化疗虽能够抑制肿瘤生长或杀伤瘤细胞[2], 但对于正常细胞也有毒害作用, 比如造血干细胞、胃肠道黏膜上皮细胞, 在临床主要表现为免疫功能指标的破坏、骨髓抑制、毒副不良反应等[3,4]。受患者承受能力限制化疗频率和剂量都成为了治疗的主要障碍。因此, 合理的生物辅助治疗是临床相对认可的重要手段, 通过使用免疫调节剂提高机体免疫力, 减少放化疗带来的毒副作用, 提高患者的抵抗力和生活质量。本研究旨在考察注射用核糖核酸II对于消化道肿瘤患者的免疫功能和化疗毒副作用的改善情况,为合理的免疫治疗奠定基础。
1 资料与方法
1.1 一般资料 本研究80例患者均为本院住院患者, 经病理学检测或穿刺细胞学证实均为晚期消化道肿瘤患者,所有患者随机分为核II组40例和对照组40例, 两组在性别、年龄、病情、病种上差异无统计学意义(P>0.05), 且 Karnofsky评分>60分。入选时经检测至少一个可测肿块,且>2 cm; 预计生存期.3个月。
1.2 治疗方法 对照组患者给与基础化疗:奥沙利铂130 mg/m2, 静脉滴注3 h, 第1天;CF200 mg/m2, 静脉滴注;5 -氟尿嘧啶300 mg/m2, 静脉滴注, 第1~5天.3周为一周期。核II组在基础化疗同时, 静脉滴注用核糖核酸II(吉林敖东药业集团延吉股份有限公司生产).200 mg/次.1次/d。化疗结束后1个月评价疗效。
1.3 疗效评定 ①考察CD3、CD4、CD56、CD4/CD8免疫指标变化;②比较II 度以上白细胞、血色素、血小板毒性及疼痛、恶心、呕吐、发热毒副反应发生率。③按Karnofsky评分评价生活质量改善。治疗后增加>10分者为提高, 减少>10分者为降低, 增加或减少<10分者为稳定。
1.4 统计学方法 所有数据采用 SPSS13.0版软件进行统计学分析, 计量资料经检验符合正态分布, 计量资料用( x-±s)表示, 组间比较采用 t检验, 两组率的比较采用 χ2检验。
2 结果
2.1 免疫功能指标 化疗后核II组的免疫指标改善明显优于实验前和对照组水平, 差异有统计学意义(P<0.05)。而对照组水平实验前后无显著差异, 详见表1。
2.2 毒副不良反应 核II组白细胞、血色素、血小板下降程度明显低于对照组, 见表2, 而疼痛、恶心、呕吐、发热副反应的II度发生比例明显低于对照组, 详见表3。
2.3 生活质量的改善 通过Karnofsky评分, 核II组临床症状和生活质量的改善情况明显优于对照组, 见表4。
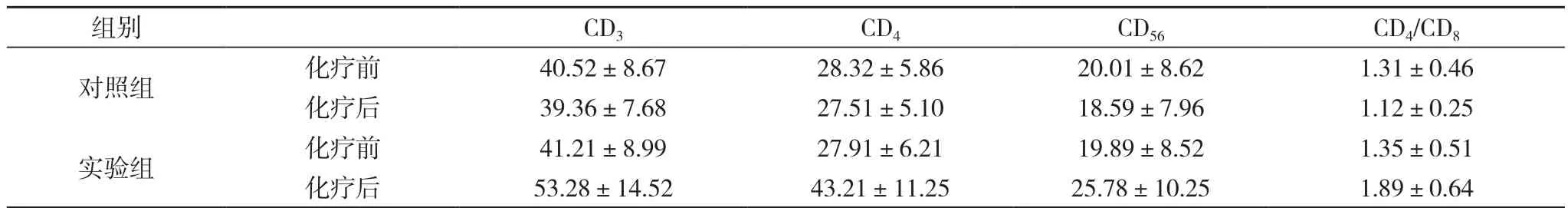
.1 两组治疗前后免役指标变化 ( x-±s, n=40)

.2 两组治疗前后血象变化 ( x-±s, n=40)

.3 两组治疗毒副反应(II度)发生率

.4 两组治疗Karnofsky评分变化
3 讨论
核II作为免疫调节剂可以非特异性刺激T 细胞增殖和分化, 使得CD3, CD4, CD56等得到明显提升, 并分泌多种细胞因子来增强机体免疫功能。核II低分子可进入细胞核内, 干扰瘤细胞DNA复制及相关蛋白质的合成, 使得瘤细胞内部的遗传物质、蛋白质合成受阻, 进而导致瘤细胞的空泡样变性和液化性坏死, 同时通过抑制血管内皮因子的表达来抑制肿瘤新生血管的形成[5]。
同时, 核II是目前唯一可大剂量应用于临床的核糖核酸,每日最大剂量可达300 mg, 保证足量药物可达靶细胞、靶器官,通过直接补充核酸原料刺激造血干细胞分化, 提高机体免疫力, 缓解化疗导致的骨髓抑制及恶心、呕吐等毒副作用[6]。
本研究证明核II对于消化道肿瘤不仅能明显改善患者的免疫力提高临床疗效, 而且能降低化疗毒副作用的发生,提高患者的生活质量, 是临床值得推广的辅助用药。
[1] 陆再英, 钟南山.内科学..7 版.北京:人民卫生出版社.2008.396.
[2] Chen W. Donor T cells can be induced to grow and survive long term in vivo without previous host immunosuppression. Immunol.1994.152 .10) .4767-4774.
[3] 张关亭.消化道肿瘤患者外周血中CD4+CD25+调节性 T 细胞检测的临床意义.现代预防医学.2011.38(2):330-331.
[4] 徐红, 毛一香.晚期消化道肿瘤患者化疗前后T细胞亚群的变化.癌症.2008.27.4) :418.424.
[5] 严冬, 张建军, 初玉萍, 等. BP素联合化疗对60例恶性肿瘤患者的临床观察. 中国肿瘤临床与康复.2001,8(4):71-73.
[6] Vogelstein B, Kinzler K W. Cancer genes and the pathways they control. Nature Med.2004.10(8).789-799.
Observation on the efficacy and safety of RNA II for injection in patients with advanced gastrointestinal cancer
CAI Liang-zhen, HUANG Sheng-bo, SUN Mao-ben.
Dongguan Taiping People’s Hospital, Donggua.523900, China
Objective To observe the efficacy and safety of RNA II for injection in patients with advanced gastrointestinal cancer. Methods 80 patients with advanced gastrointestinal cancer were single-blind randomized into group RNA II and control group. The simple chemotherapy for control group, using RNA I.200 mg/day.45 days (one course) for the group RNAII on the base of chemotherapy, and then detect the of variation of T-cell subsets, the leukocytes, the incidence of adverse side effects and evaluate the life quality of the patients through the Karnofsky score. Results ① The positive rate of CD3, CD4, CD56in group RNAII were higher than the control group (P<0.05). ② The decreased level of WBC and the ratio of adverse events in group RNAII were lower than the control group (P<0.05). ③ The promotion ratio of Karnofsky score in group RNAII(57.5%) was higher than control group(42.5%). Conclusion ① RNA II can stimulate the maturation of T-cell, improve the immune function of the patients. ② RNA II can reduce the decrease of WBC, the side effects of chemotherapy. ③ RNA II combined with chemotherapy can improve the quality of life effectively.
RNA II for injection; Gastrointestinal tumors; Immunity; Quality of life
523900 广东省东莞太平人民医院

