大鼠脑创伤后外周血和创伤区脑组织CD34+细胞的检测*
郭新宾,邓 鑫,张建宁,宋来君#
1)郑州大学第一附属医院介入科 郑州 450052 2)郑州大学第一附属医院神经外科 郑州 450052 3)天津医科大学总医院神经外科;天津市神经病学研究所 天津 300052
大鼠脑创伤后外周血和创伤区脑组织CD34+细胞的检测*
郭新宾1),邓 鑫2),张建宁3),宋来君2)#
1)郑州大学第一附属医院介入科 郑州 450052 2)郑州大学第一附属医院神经外科 郑州 450052 3)天津医科大学总医院神经外科;天津市神经病学研究所 天津 300052
#通讯作者,男,1952年9月生,教授,主任医师,研究方向:神经外科基础与临床,E-mail:laijunSong@126.com
内皮祖细胞;CD34+细胞;脑创伤;大鼠
目的:研究大鼠脑创伤后外周血及创伤区脑组织中CD34+细胞数量变化的规律和意义。方法取雄性Wistar大鼠98只,随机分为创伤组和假手术组,创伤组大鼠制备液压脑创伤模型。每组各抽取7只大鼠,分别于创伤前和创伤后第1、2、3、5和7天取内眦静脉血进行CD34+细胞计数。伤后第0、1、3、7、14和21天,每组各随机抽取7只大鼠处死,在脑损伤节段取材,采用免疫组化SP染色法检测CD34。结果与假手术组比较,伤后第1天创伤组大鼠外周血CD34+细胞计数即显著增加,伤后第2天达到高峰,然后逐渐恢复至正常水平(F组间=14.695,F时间=27.307,F交互=4.779,P<0.001);伤后第1天,创伤区脑组织CD34+细胞增多,伤后第3天显著增加,伤后第7天达到峰值,随后有所下降,但仍维持在较高水平(F组间=561.542,F时间=62.374,F交互=58.222,P<0.001)。结论脑创伤后外周血CD34+细胞明显动员,并可能归巢到创伤区域,参与血管新生。
骨髓起源的CD34+干/祖细胞包含内皮祖细胞、内皮细胞以及造血干细胞。CD34+细胞作为内皮祖细胞和内皮细胞的来源参与了组织损伤的血管新生。移植CD34+细胞可改善缺血性心脏病患者心肌功能并增加心肌血管新生,CD34+细胞也被证明可以归巢到卒中脑组织区域[1],可是CD34+细胞与创伤脑组织修复的关系却暂时未见报道。作者通过观察大鼠脑创伤后外周血及创伤区脑组织CD34+细胞数量的变化,探讨CD34+细胞与脑创伤后再生修复的关系。
1 材料与方法
1.1大鼠脑创伤模型的建立将100 g/L水合氯醛按3.5 mL/kg的剂量经腹腔内注射麻醉大鼠。麻醉满意后将大鼠呈俯卧位头部固定于立体定向打击架上,碘伏消毒皮肤,沿中线切开头皮,暴露颅骨。于前囟后3 mm、矢状线右侧旁开2 mm,用磨钻磨开一直径为4 mm的圆形骨窗,注意保持硬膜完整。连接打击管,掐尾反射出现后开始打击,调整打击摆锤的角度为12°(相当于中度颅脑损伤)。打击后待生命体征平稳后,消毒并缝合头皮,将大鼠放入笼中单独饲养。
1.2实验动物与分组成年雄性Wistar大鼠98只(中国预防医学研究所实验动物中心),体重280~350 g,采用随机数字表法随机分为创伤组和假手术组,每组49只。创伤组按照1.1方法制备大鼠脑创伤模型;假手术组进行同样手术,但不进行液压打击。
1.3外周血CD34+细胞的检测随机从两组中各抽取7只大鼠,分别于创伤前和创伤后第1、2、3、5和7天,取内眦静脉血0.6 mL,利用密度梯度离心法分离单个核细胞,将其与FIFC标记的鼠CD34单抗(Santa Cruz Biotechnology, USA)共育15 min后,上流式细胞仪(FACScan, Becton-Dickinson, USA)进行计数,计算每1×104个单个核细胞中 CD34+细胞数。
1.4创伤区脑组织中CD34+细胞的检测两组均余42只大鼠,分别于创伤后第0、1、3、7、14和21天,各随机取7只处死。用生理盐水经心脏灌注以清除血管内红细胞,灌注后取脑,多聚甲醛固定。在脑损伤节段做冠状位连续切片,厚度为6 μm,每隔50 μm取一张切片,共取5张,采用免疫组化SP染色法检测CD34。一抗为稀释100倍的山羊抗小鼠CD34 单抗 (Santa Cruz Biotechnology, USA),二抗为稀释200倍的生物素标记的二抗。DAB显色。以棕黄色胞体着色的细胞为阳性细胞。每张切片选取5个有代表性的高密度视野,在100倍光镜下计数,计算平均每个视野的CD34+细胞数。
1.5统计学处理采用SPSS 13.0进行统计学分析。两组外周血CD34+细胞计数的比较采用重复测量数据的方差分析,创伤区脑组织CD34+细胞数的比较采用2×6析因设计的方差分析,检验水准α=0.05。
2 结果
2.1两组大鼠外周血CD34+细胞计数的比较见表1。伤后第1天,创伤组大鼠外周血CD34+细胞计数显著增加,伤后第2天达到高峰,并明显高于假手术组,然后逐渐恢复至正常水平。
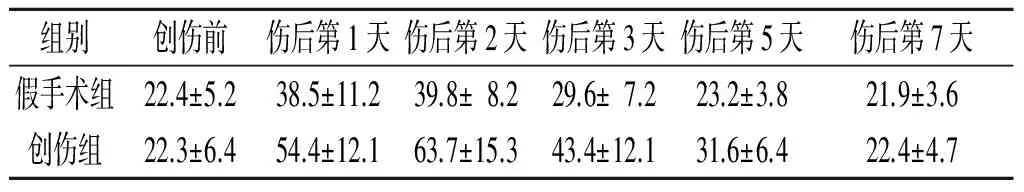
表1 两组外周血CD34+细胞计数的比较(n=7)
F组间=14.695,F时间=27.307,F交互=4.779,P<0.001。
2.2两组脑组织CD34+细胞数的比较伤后第1天,创伤区和同侧海马区CD34+细胞增多,伤后第3天显著增加,并较对侧显著增多;远离创伤区CD34+细胞明显较少。假手术组同期CD34+细胞数变化不明显。两组创伤区脑组织CD34+细胞数的比较见表2。

表2 两组创伤区脑组织CD34+ 细胞数的比较(n=7)
F组间=561.542,F时间=62.374,F交互=58.222,P<0.001。
3 讨论
1997年,Asahara等[2]首次从外周血中成功分离出CD34+血管内皮祖细胞,其在体外具有分化为内皮细胞的能力,不仅参与人胚胎血管生成,也参与血管新生和血管内皮损伤的修复过程[3]。研究[4-5]已证实脑梗死急性期循环血液中CD34+细胞水平和疾病预后相关。CD34+细胞可以分泌多种血管新生因子,同时作为内皮祖细胞的来源细胞,参与血管新生[1,5]。梗死心肌移植骨髓CD34+细胞可明显促进梗死区血管形成, 提高梗死区心肌的血流灌注[6-7]。实验[1,8]证明CD34+细胞可以归巢到卒中脑组织区域。Taguchi等[5]发现脑卒中后循环CD34+细胞数量的变化与局部脑血流和脑组织氧代谢率有关,因此认为循环CD34+细胞的数量与脑血管内皮的修复有关。作者发现,大鼠脑创伤后,外周血CD34+细胞计数迅速升高,在伤后第2天达到峰值,然后逐渐下降,于伤后第7天恢复到正常水平。作者认为脑创伤后外周血CD34+细胞的动员可能对CD34+细胞归巢、血管新生和创伤后组织再生修复起到关键作用。
Krupinski等[9]研究发现,10例存活5~92 d的脑梗死患者缺血脑组织中微血管密度增加,并且增生的微血管密度越大,患者的存活时间越长。Arenillas等[10]报道,对大鼠卒中模型移植血管内皮祖细胞(CD34+细胞亚群)后,移植细胞可归巢到缺血组织周围,参与血管新生,梗死灶周围出现大量的新生毛细血管,卒中大鼠的功能也在一定程度上得以恢复。该研究发现,大鼠脑创伤后,创伤区域CD34+细胞显著增多,于伤后第3天即开始快速增多,于伤后第7天达高峰,其后逐渐下降但仍维持在较高水平。作者认为创伤区脑组织CD34+细胞可能来源于两个方面:第一,外周血CD34+干细胞动员、归巢到创伤区域;第二,创伤区域的CD34+干细胞增殖、移行。创伤后CD34+细胞显著增多应该与创伤区血管新生关系密切,对创伤区域组织再生起到促进作用。
该研究结果提示:脑创伤后急性期会出现CD34+细胞的动员,外周血CD34+干细胞动员、归巢、移行、增殖分化与创伤后血管新生和组织再生密切相关,CD34+细胞可能归巢至创伤区的血管床,参与血管新生。动员内源性CD34+干细胞和移植外源性CD34+干细胞可以为脑创伤修复提供新的治疗途径。
[1]Dunac A,Frelin C,Popolo-Blondeau M,et al.Neurological and functional recovery in human stroke are associated with peripheral blood CD34+cell mobilization[J].J Neurol,2007,254(3):327
[2]Asahara T,Murohara T,Sullivan A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275(5302):964
[3]Yip HK,Chang LT,Chang WN,et al.Level and value of circulating endothelial progenitor cells in patients after acute ischemic stroke[J].Stroke,2008,39(1):69
[4]Fadini GP,Coracina A,Baesso I,et al.Peripheral blood CD34+KDR+endothelial progenitor cells are determinants of subclinical atherosclerosis in a middle-aged general population[J].Stroke,2006,37(9):2277
[5]Taguchi A,Matsuyama T,Nakagomi T,et al.Circulating CD34-positive cells provide a marker of vascular risk associated with cognitive impairment[J].J Cereb Blood Flow Metab,2008,28(3):445
[6]Mariani M,De Servi S,Chianese R,et al.Circulating CD34-positive cell number is related to effective myocardial reperfusion in acute myocardial infarction treated with primary coronary angioplasty[J].J Cardiovasc Med(Hagerstown),2008,9(7):677
[7]Iwasaki H,Kawamoto A,Ishikawa M,et al.Dose-dependent contribution of CD34-positive cell transplantation to concurrent vasculogenesis and cardiomyogenesis for functional regenerative recovery after myocardial infarction[J].Circulation,2006,113(10):1311
[8]Shyu WC,Lin SZ,Chiang MF,et al.Intracerebral peripheral blood stem cell (CD34+) implantation induces neuroplasticity by enhancing beta1 integrin-mediated angiogenesis in chronic stroke rats[J].J Neurosci,2006,26(13):3444
[9]Krupinski J,Kaluza J,Kumar P,et al.Role of angiogenesis in patients with cerebral ischemic stroke[J].Stroke,1994,25(9):1794
[10]Arenillas JF,Sobrino T,Castillo J,et al.The role of angiogenesis in damage and recovery from ischemic stroke[J].Curr Treat Options Cardiovasc Med,2007,9(3):205
(2013-02-26 收稿 责任编辑 王 曼)
etection of CD34+cells in peripheral blood and in posttraumatic brain tissue of rats with traumatic brain injury
GUOXinbin1),DENGXin2),ZHANGJianning3),SONGLaijun2)
1)DepartmentofInterventionalRadiology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 2)DepartmentofNeurosurgery,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 3)DepartmentofNeurosurgery,GeneralHospital,TianjinMedicalUniversity;TianjinNeurologicalInstitute,Tianjin300052
endothelial progenitor cell; CD34+cell; brain injury; rat
Aim: To detect the changes of CD34+cells in peripheral blood and in posttraumatic brain tissue of rats with traumatic brain injury(TBI). Methods: A total of 98 rats were randomly assigned to control and TBI groups,49 rats in each group.Fluid percussion injury was performed over the right parietal lobe in TBI group. Seven in each group were sampled randomly to collect blood samples from retro-orbital venous plexus before TBI, and at the 1st,2nd,3rd, 5th and 7th day after TBI, and CD34+cells in peripheral blood were evaluated by flow cytometry. At the 1st, 3rd, 7th, 14th, and 21st day after TBI, 7 rats from the 2 groups were sampled respectively and sacrificed to detect CD34+cells in brain tissue using immunohistochemistry staining. Results: Compared with those of the control group, the number of CD34+cells in peripheral blood began to increase significantly in TBI group at the 1st day after TBI,reached the peak at the 2nd day after TBI,then decreased to the normal level(Fgroup=14.695,Ftime=27.307,Finteraction=4.779,P<0.001);the number of CD34+cells in the injured brain tissue began to increase at the 1st day after TBI,and reached the peak at the 7th day after TBI,then decreased gradually,but stabilised at a higher level(Fgroup=561.542,Ftime=62.374,Finteraction=58.222,P<0.001).Conclusion: CD34+cells in peripheral blood are mobilized after TBI,and maybe home to the injured tissue and play an important role in angiogenesis.
*国家自然科学基金资助项目 81100928;河南省医学科技攻关项目 2011020010
R651.1
10.3969/j.issn.1671-6825.2014.01.005

