冠状静脉逆行灌注碱性成纤维细胞生长因子对骨髓间充质干细胞向心肌内归巢的影响
李学强 王晓 甄雷 缪黄泰 吴星欣 任红梅 师树田 乔岩 刘新民 阙斌 聂绍平
基础研究
冠状静脉逆行灌注碱性成纤维细胞生长因子对骨髓间充质干细胞向心肌内归巢的影响
李学强 王晓 甄雷 缪黄泰 吴星欣 任红梅 师树田 乔岩 刘新民 阙斌 聂绍平
目的 探讨经冠状静脉逆行灌注碱性成纤维细胞生长因子(bFGF)对骨髓间充质干细胞(MSCs)心肌内归巢的影响。方法 杂种犬12只,体重20~25(22.4±1.8)kg,采用开胸结扎法建立急性心肌梗死模型。1周后将存活犬(n=11)随机分为MSCs组(n=5)和bFGF+MSCs组(n=6)。采用密度梯度离心与贴壁培养法在体外分离、培养MSCs,移植前对MSCs进行4’,6-二脒基-2-苯基吲哚(DAPI)孵育标记。逆行灌注实验后1周,免疫荧光法比较两组梗死心肌内DAPI阳性细胞数,评价逆行灌注bFGF对MSCs归巢的影响。结果 采用密度梯度离心和贴壁培养法成功分离并富集MSCs,77.19%以上的细胞都处于G0/G1期,强表达CD44,阳性率为95.8%;MSCs体外DAPI标记率高,初始标记率达99.6%。免疫荧光显示,bFGF+MSCs组DAPI阳性细胞数明显高于 MSCs组[(325±106)/mm2比(186±67)/mm2,P<0.05],联合组 MSCs分布更为均匀;部分MSCs与心肌细胞共定位。结论 经冠状静脉逆行灌注bFGF能更有效地促进MSCs归巢至梗死心肌;同时,MSCs在心肌内的分布也更为均匀。
细胞移植;碱性成纤维细胞生长因子;骨髓间充质干细胞;冠状静脉逆行灌注;归巢
大量研究显示,心脏细胞移植是修复坏死心肌的有效方法。骨髓间充质干细胞(mesenchymal stem cell,MSCs)具有易分离培养、多系分化增殖、无免疫排斥等优点,成为理想的移植细胞[1,2]。然而,无论采用何种移植途径,MSCs在心肌内归巢和分化的比例均较低[3]。体外研究显示,碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)能促进MSCs迁移和增殖[4,5],但在体环境下是否存在该效应仍不明确。另外,我们前期采用选择性冠状静脉逆行灌注途径建立了冠状静脉血液与梗死心肌之间的bFGF浓度梯度[6,7]。因此,本研究采用犬急性心肌梗死模型,评价冠状动脉逆行灌注bFGF对MSCs归巢的影响。
1 材料与方法
1.1 实验动物 健康成年杂种犬12只,体重20~25(22.4±1.8)kg,犬龄 1~2 岁,购自北京来福实验动物养殖场。实验中对动物的处置符合相关动物伦理学要求。
1.2 MSCs体外分离、培养 选择髂后上棘为穿刺点行骨髓穿刺术,抽取犬骨髓约10 ml。采用密度梯度离心法从骨髓中分离MSCs。细胞分离成功后,加入含10%胎牛血清(FBS,美国Hyclone公司)的低糖DMEM(美国Hyclone公司)完全培养基,37℃、5%CO2的培养箱中培养,进行体外扩增。细胞生长到80%融合时进行1∶3传代。倒置显微镜逐日观察,直至贴壁细胞彼此融合铺满瓶底时,重复上述操作,反复传代扩增。收获细胞后重悬成单细胞,磷酸盐缓冲液(PBS)调节浓度为1×107/ml备用。
1.3 绘制MSCs的生长曲线 取生长状态良好的第1、3、5代细胞,以0.25%胰酶+0.03%EDTA消化,制成细胞悬液。以1×104/皿的密度接种于6孔板内,每天各取2孔进行细胞记数,取均值,剩余细胞每3天换液一次,最后根据细胞计数结果以培养时间为横坐标,细胞数为纵坐标绘制细胞生长曲线。
1.4 检测MSCs的生长周期 取生长状态良好的第2代细胞,0.25%胰酶室温消化后制成细胞悬液,4℃预冷的无水乙醇固定30 min,1200 r/min离心5 min,去除上清,预冷的 PBS漂洗 2次,20 μg/ml RNA酶37℃水浴30 min,加入50 μg/ml的碘化丙啶,4℃避光染色15 min,流式细胞仪检测并分析。
1.5 分析MSCs的细胞表型 取培养第2代末细胞,用0.25%胰蛋白酶消化,含10%FBS的DMEM培养基终止反应,吹打制成细胞悬液;用PBS制成300 μl含有 2.5×106个 MSCs的单细胞悬液;将细胞悬液分装至6只流式管中,分别加入5 μl羊血清封闭30 min;6个流式管中分别加入CD44-异硫氰 酸 荧 光 素 (FITC)、CD14-FITC、CD34-FITC、CD11b-藻红蛋白(PE)、HLA-DR-PE及对照PBS各 5 μl,混匀,反应 30 min;PBS 洗去未标记上的抗体。每管再加入300 μl PBS重新混悬细胞,流式细胞仪检测细胞表面抗原 CD14、CD34、CD44、CD11b和HLA-DR的表达。流式抗体均购自美国eBioscience公司。
1.6 急性心梗模型的建立 静脉全身麻醉(3%戊巴比妥钠,1 ml/kg),术中维持麻醉追加戊巴比妥剂量为首次剂量的20%。建立静脉通路,经口气管内插管,呼吸机辅助通气(呼吸频率15~20次/min,潮气量10 ml/kg),心电监护。犬采用右侧卧位,备皮,常规消毒、铺巾,沿左侧第4~5肋间做切口,切开皮肤、皮下组织,进入胸腔后,切开心包并悬吊,充分暴露左心室,分离左前降支(LAD)中段主要对角支远段1 cm处并结扎。记录结扎前后的心电图。可见结扎部位以下及心尖部心肌颜色变暗,搏动减弱。模型制作成功后,逐层缝合,关胸、鼓肺。待动物自主呼吸完全恢复后拔除气管插管,停用呼吸机,观察心率、血压、呼吸平稳后送回动物房。术后3 d常规应用抗生素,预防感染。
1.7 MSCs体外DAPI标记与检测 体外分离、培养的MSCs,当细胞总数培养扩增至1×107后,在移植前加入4’,6-二脒基-2-苯基吲哚(DAPI,美国Sigma公司)进行体外孵育标记。具体步骤如下:①收获细胞,用1∶1的0.25%的胰蛋白酶和0.03%EDTA混合液消化,用含血清培养基终止,洗涤、离心;②用1 ml含血清的培养基重悬细胞、计数;③取 50 μl的无菌 DAPI溶液(1 μg/μl)加入细胞重悬液中(终浓度为50 μg/ml),混匀;④置37℃孵箱染色 30 min;⑤PBS 离心洗涤(1200 r/min,5 min)6次,以去掉多余的DAPI;⑥收集细胞:平均每只犬心脏大约注入1×107个细胞,用2 ml无血清培养基重悬,冰上保存少于1 h植入心肌。
DAPI标记MSCs的培养瓶用锡纸包裹,避光换液。于标记后当日在荧光镜下观察。计数视野中DAPI阳性细胞,同视野相差镜下计数视野中全部细胞,按标记率=DAPI阳性细胞数/全部细胞数,计算初始标记率。
1.8 冠状静脉逆行灌注 灌注前共11只动物存活,将存活动物进行编号,随机分为MSCs组(n=5)和bFGF+MSCs组(n=6)。根据体外实验结果,选择bFGF灌注液的浓度为200 ng/ml,每只犬MSCs(DAPI标记)细胞总量为1×107。各组灌注液的制备方法具体如下:① MSCs组:生理盐水(NS)和MSCs细胞悬液各20 ml;②bFGF+MSCs组:bFGF灌注液和 MSCs细胞悬液各 20 ml。bFGF购自美国PeproTech公司。
心梗模型制作1周后行冠状静脉逆行灌注实验。考虑到bFGF+MSCs组需要分两步先后灌注bFGF和MSCs(经冠状静脉灌注bFGF后在冠状静脉与心肌组织之间形成bFGF浓度梯度,从而促进随后灌注的MSCs向心肌归巢),为减少组间差异,对MSCs组首先灌注NS,然后灌注MSCs。采用OTW球囊灌注到与LAD平行的前室间静脉,保持球囊充盈10 min。
1.9 MSCs的在体归巢评价 逆行灌注实验后1周处死动物,迅速取出心脏,冷生理盐水冲洗干净,取移植部位心肌组织10块,OCT包裹液氮冷冻,连续冰冻切片(5 μm)。4%多聚甲醛溶液固定10 min,PBS 5 min×3次;羊血清室温封闭10 min;倾去血清,滴加50 μl鼠抗α-sarcomeric antinin单克隆抗体(1∶800稀释,美国Sigma公司),湿盒中4℃过夜(16~24 h);次日拿出湿盒,弃一抗,PBS 5 min×3次;滴加罗丹明标记的山羊抗鼠IgG(1∶50稀释,美国 KPL公司),37℃孵育 30 min;弃二抗,PBS 5 min×3次;荧光封片液封片。
每个组织块选择1张切片,荧光显微镜(400×视野)观察DAPI阳性细胞分布并计数,Image-Pro Plus5.1软件分析。每张切片随机选择5个视野存盘,5个视野的平均数作为每张切片的测值。比较两组梗死心肌内DAPI阳性细胞数,评价bFGF对MSCs归巢的影响。
1.10 统计学方法 采用SPSS 17.0进行统计学分析。计量资料采用±s表示,组间比较采用非配对样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 实验动物临床观察 本实验过程中,有1只犬于心梗模型制作成功后3 d因伤口感染死亡,其它犬存活情况良好。共11只犬接受冠状静脉逆行灌注实验,术中及术后无低血压、心律失常等并发症发生。
2.2 MSCs形态学观察和生长特性
2.2.1 形态学观察 原代细胞刚接种时呈圆形,细胞核位于中央,折光性强,悬浮于培养液中。12 h可见少量贴壁细胞,同时培养液中混有血细胞等非贴壁细胞(图1A);24 h首次换液,贴壁细胞明显增加,开始呈三角形、多角形、梭形,形成3~10个细胞的细胞团。培养2~3 d,细胞呈局部集落式生长,细胞形态伸展为长梭形(图1B);培养5~6 d,原来的单个细胞或细胞集落形成多个细胞克隆,以后相差显微镜观察可见各个细胞克隆进一步扩大,呈旋涡状或水草样;7~9 d后细胞铺满皿底80%~90%,细胞紧密贴附,可以传代(图1C)。

图1 MSCs培养过程的形态学观察和增殖情况
2.2.2 生长曲线 以横轴作为时间,纵轴为细胞增殖量绘制传代细胞(P1、P3、P5)生长曲线(图 2)。生长曲线显示:各代细胞生长曲线大致相同,呈“S”形,潜伏期为1~2 d。体外培养72~96 h后,细胞达对数生长期,6~7 d细胞接近融合,增殖进入平台期。传代细胞与原代细胞差别不明显。
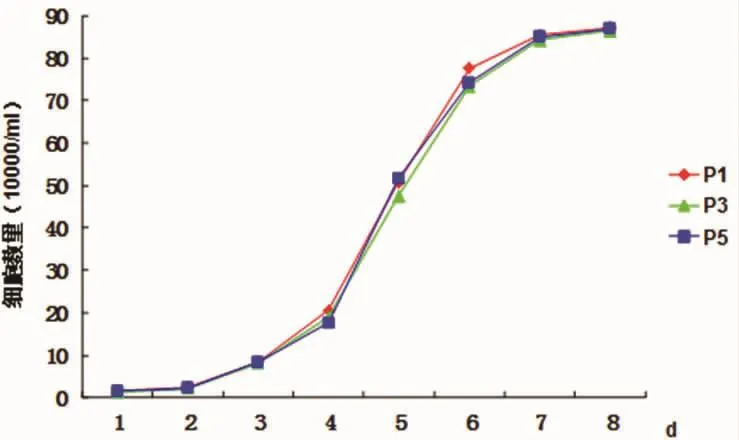
图2 MSCs体外培养生长曲线
2.3 细胞周期及表型鉴定
2.3.1 细胞周期 使用流式细胞仪对第2代末的MSCs进行细胞周期分析,77.19%以上的细胞都处于G0/G1期(图3),说明其大部分保持未分化状态,具有较高增殖潜能。

图3 P2细胞周期检测结果
2.3.2 细胞表型鉴定 流式细胞仪检测MSCs的表面抗原特性。第2代末的细胞不表达CD14(单核/巨噬细胞表面标志)、CD34和CD11b(造血干细胞表面标志),HLA-DR(成纤维细胞表面标志),强表达CD44(黏附分子),阳性率为95.8%,故其纯度较高(图4)。
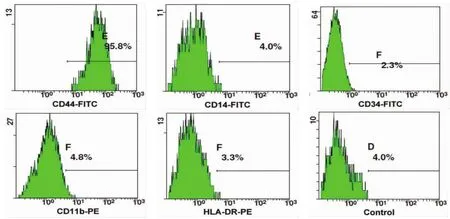
图4 P2细胞表型检测结果
2.4 DAPI标记的MSCs体外初始标记率检测结果荧光显微镜下,DAPI标记的MSCs胞核可见明显蓝色荧光,初始标记率达99.6%(图5)。

图5 MSCs体外DAPI标记图像 A:×40,B:×400
2.5 DAPI标记的MSCs在体归巢评价 35.4%的切片可以看到DAPI标记的MSCs阳性细胞。bFGF+MSCs组DAPI阳性细胞数明显高于 MSCs组[(325±106)/mm2比 (186±67)/mm2,P<0.05](图6)。荧光显像示联合治疗组有更多的细胞归巢到缺血心肌,联合组MSCs分布更为均匀;部分MSCs与心肌细胞共定位(图7)。

图6 两组梗死区DAPI阳性细胞密度(P<0.05)

图7 两组DAPI标记的MSCs在体归巢情况
3 讨论
随着干细胞技术和组织工程学研究的不断深入,骨髓干细胞移植逐渐成为缺血性心脏病及终末期心力衰竭治疗的理想选择。多项实验研究显示,骨髓干细胞分化为心肌样细胞、旁分泌作用以及募集内源性干细胞是其修复坏死心肌及改善心脏功能的主要机制[1,8,9]。MSCs为多能干细胞,具有易分离培养、多系分化增殖、无免疫排斥等优点。在可供移植的干细胞群中,MSCs分化为心肌细胞的可能性最大[1,2],因而理应成为组织工程中理想的种子细胞。然而,在移植途径的选择以及在体归巢和存活等方面还存在许多亟待解决的实际问题。
3.1 细胞移植的途径 MSCs移植的主要途径包括直接心肌内注射(包括心脏直视下注射和经导管介入注射)、经冠状动脉灌注和经静脉注射等。研究显示,静脉注射MSCs后细胞难以归巢到心肌,而归巢到非心脏组织可引起远隔器官无必要的血管新生,导致血管瘤、视网膜血管增生等并发症。冠脉内注射能将移植细胞选择性地注入靶心肌区域。研究显示,该方法能明显提高患者运动能力以及左室射血分数,改善心肌的灌注。经冠脉灌注MSCs后细胞也难以大量归巢到缺血心肌,在冠状动脉完全闭塞时也无法实施,且可导致心肌微梗死灶,存在致动脉粥样硬化的风险[10,11]。心肌内注射尽管可将大量MSCs导入心肌,但由于其分布不均匀,且形成与自身心肌分隔的“小岛(islets)”,移植细胞难以长期存活,不易与自身心肌形成耦联,并可导致心律失常与心肌坏死[12]。近几年的研究显示,冠状静脉逆行灌注有望成为缺血性心脏病细胞移植的新途径[10,13,14]。
初步研究发现,冠状静脉逆行灌注用于细胞移植安全可行。Suzuki等[15]在结扎鼠冠状动脉后,经导管向心左静脉灌注表达β-半乳糖苷酶的骨骼肌前体细胞(skeletal muscle precursor cells)。原位染色显示,左心室游离壁全层均有β-半乳糖苷酶表达。28 d后,在梗死边缘区有大量染色阳性的多核肌管(multinuclear myotubes)。超声心动图研究发现,试验组心功能与心室腔径改善情况均优于假手术盐水灌注对照组。Yokoyama等[16]在猪心肌梗死6 h和2周后分别经AIV灌注骨髓单个核细胞。结果显示,细胞可在梗死心肌全层分布,移植组梗死区血管新生和侧支重构明显。我们前期也证实,采用OTW球囊经冠状静脉逆行灌注MSCs安全可行,靶向性高[7]。理论上,与心肌内注射相比,冠状静脉逆行灌注具有创伤小、安全性高等优点,且干细胞能在缺血心肌全层均匀分布,有利于移植细胞的归巢、分化与长期存活;与冠脉途径相比,冠状静脉逆行灌注途径的靶向性和安全性较高,可长时间或多次灌注,更有利于移植细胞均匀持久地归巢到缺血心肌。
最近,Baklanov等[17]比较了经皮心肌内注射或经冠状静脉逆行灌注“微粒”在心肌内的分布情况。结果两种方式归巢至心肌内的“微粒”数量相当,前者主要分布在心尖部,后者在心室中部和前间隔分布较多。本课题经冠状静脉依次灌注bFGF和MSCs后发现,归巢到梗死区心肌的MSCs明显增多,且分布更为均匀,可能与bFGF浓度梯度更有效地促进MSCs归巢有关。
3.2 在体bFGF浓度梯度对MSCs归巢的影响研究显示,人体存在自身动员机制,能将骨髓干细胞转移至受损心脏,并可能参与心肌自身修复[18]。然而,由于归巢至心肌的干细胞数量较少,其作用也难以持久,因而心脏修复作用十分有限[19]。近年来多项研究显示,将自体骨髓干细胞导入受损心肌后,心脏功能有一定程度的改善[20]。然而,如何将干细胞均匀持续地导入受损心肌还有待进一步探讨。
体外研究显示,MSCs动员及向受损组织归巢依赖于系统和局部的炎症状态[21],许多生长因子都能够调控MSCs的迁移与增殖[22]。利用Boyden chamber体外迁移体系观察bFGF等对MSCs迁移的影响发现,当存在bFGF梯度时,肌丝呈现出与梯度强烈相关的平行排列,bFGF在MSCs的移行中起着吸引和路由作用。随着bFGF浓度增加,MSCs的移行活力也逐渐增强[5]。最近Barkefors等[23]利用微流体趋化小室体系评价bFGF梯度对内皮细胞迁移的影响。结果发现,在0~50 ng/ml的梯度范围内,bFGF对内皮细胞趋化效应最强。在浓度梯度的上限(50 ng/ml),细胞迁移活力明显下降。我们前期首次在在体环境下建立了冠状静脉血液与梗死心肌之间的bFGF浓度梯度[6]。与单纯MSCs移植相比,在bFGF浓度梯度的时间窗内(球囊充盈5~10 min)进一步灌注MSCs能更有效地促进其归巢至坏死心肌;同时,我们选择的冠状静脉逆行灌注途径靶向性更高、作用更持久,利于在局部形成稳定的bFGF浓度梯度,促进MSCs向梗死心肌富集,充分发挥心脏修复作用。
经冠状静脉逆行灌注是MSCs移植的理想途径。采用该途径灌注bFGF所形成的浓度梯度,能更有效地促进MSCs归巢至梗死心肌;同时,MSCs在心肌内的分布也更为均匀。
(本文图片见P287-288页)
[1]Williams AR, Hare JM.Mesenchymal stem cells:Biology,pathophysiology,translational findings,and therapeutic implications for cardiac disease.Circ Res,2011,109:923-940.
[2]Chamberlain G,Fox J,Ashton B,et al.Concise review:Mesenchymal stem cells: Their phenotype,differentiation capacity,immunological features,and potential for homing.Stem Cells,2007,25:2739-2749.
[3]Hou D,Youssef EA,Brinton TJ,et al.Radiolabeled cell distribution after intramyocardial,intracoronary,and interstitial retrograde coronary venous delivery:Implications for current clinical trials.Circulation,2005,112:I150-156.
[4]Ahn HJ, Lee WJ, Kwack K, et al.Fgf2 stimulates the proliferation ofhuman mesenchymalstem cellsthrough the transient activation of jnk signaling.FEBS Lett,2009,583:2922-2926.
[5]Schmidt A,Ladage D,Schinkothe T,et al.Basic fibroblast growth factor controls migration in human mesenchymal stem cells.Stem Cells,2006,24:1750-1758.
[6]甄雷,王晓,缪黄泰,等.冠状静脉逆行灌注碱性成纤维细胞生长因子的体内浓度梯度.中国组织工程研究,2013,17:4473-4480.
[7]甄雷,王晓,缪黄泰,等.采用otw球囊经冠状静脉逆行灌注骨髓间充质干细胞的安全性和有效性.中国心血管病研究,2013,11:451-454.
[8]Ranganath SH,Levy O,Inamdar MS,et al.Harnessing the mesenchymal stem cell secretome for the treatment of cardiovascular disease.Cell Stem Cell,2012,10:244-258.
[9]Hatzistergos KE,Quevedo H,Oskouei BN,et al.Bone marrow mesenchymal stem cells stimulate cardiac stem cell proliferation and differentiation.Circ Res,2010,107:913-922.
[10]Dib N,Menasche P,Bartunek JJ,et al.Recommendations for successful training on methods of delivery of biologics for cardiac regeneration:A report of the international society for cardiovascular translational research.JACC Cardiovasc Interv,2010,3:265-275.
[11]Sanganalmath SK,Bolli R.Cell therapy for heart failure:A comprehensive overview of experimental and clinical studies,current challenges,and future directions.Circ Res,2013,113:810-834.
[12]Grossman PM,Han Z,Palasis M,et al.Incomplete retention after direct myocardial injection.Catheter Cardiovasc Interv,2002,55:392-397.
[13]Wu K,Mo X,Lu S,et al.Retrograde delivery of stem cells:Promising delivery strategy for myocardial regenerative therapy.Clin Transplant,2011,25:830.
[14]Jain AK,Smith EJ,Rothman MT.The coronary venous system:An alternative route of access to the myocardium.J Invasive Cardiol,2006,18:563-568.
[15]Suzuki K,Murtuza B,Fukushima S,et al.Targeted cell delivery into infarcted rat hearts by retrograde intracoronary infusion: Distribution, dynamics, and influence on cardiac function.Circulation,2004,110:II225-230.
[16]Yokoyama S,Fukuda N,Li Y,et al.A strategy of retrograde injection of bone marrow mononuclear cells into the myocardium for the treatment of ischemic heart disease.J Mol Cell Cardiol,2006,40:24-34.
[17]Baklanov DV,Moodie KM,McCarthy FE,et al.Comparison of transendocardial and retrograde coronary venous intramyocardial catheter delivery systems in healthy and infarcted pigs.Catheter Cardiovasc Interv,2006,68:416-423.
[18]Quaini F,Urbanek K,Beltrami AP,et al.Chimerism of the transplanted heart.N Engl J Med,2002,346:5-15.
[19]Schoenhard JA,Hatzopoulos AK.Stem cell therapy:Pieces of the puzzle.J Cardiovasc Transl Res,2010,3:49-60.
[20]Hossne NA,Invitti AL,Buffolo E,et al.Refractory angina cell therapy (react) involving autologous bone marrow cells in patients without left ventricular dysfunction:A possible role for monocytes.Cell Transplant,2009,18:1299-1310.
[21]Ponte AL,Marais E,Gallay N,et al.The in vitro migration capacityofhuman bonemarrow mesenchymalstem cells:Comparison ofchemokine and growth factor chemotactic activities.Stem Cells,2007,25:1737-1745.
[22]Ozaki Y,Nishimura M,Sekiya K,et al.Comprehensive analysis of chemotactic factors for bone marrow mesenchymal stem cells.Stem Cells Dev,2007,16:119-129.
[23]Barkefors I,Le Jan S,Jakobsson L,et al.Endothelial cell migration in stable gradients of vascular endothelial growth factor a and fibroblast growth factor 2:Effects on chemotaxis and chemokinesis.J Biol Chem,2008,283:13905-13912.
Basic fibroblast growth factor improves bone marrow mesenchymal stem cells homing to myocardium byretrograde coronary venous perfusion
LI Xue-qiang*,WANG Xiao,ZHEN Lei,et al.*Emergency&Critical Care Center,Beijing Anzhen Hospital,Capital Medical University,Beijing Institute of Heart,Lung and Blood Vessel Diseases,Beijing 100029,China
NIE Shao-ping,E-mail:spnie@126.com
Objective To evaluate the effects ofbasic fibroblast growth factor(bFGF)on mesenchymal stem cell(MSCs)homing into myocardium byretrograde coronary venous perfusion.MethodsAcute myocardial infarction was induced by ligation of left anterior descending coronary artery in 12 dogs[20-25(22.4±1.8)kg].One week later,the survival dogs(n=11)were randomly divided into MSCs group(n=5) and bFGF+MSCs group(n=6).MSCs were isolated by density gradient centrifugation,expanded in vitro,and labeled with 4’,6-diamidino-2-phenylindole(DAPI)before being injection.One week after perfusion,the number of DAPI-positive cells was compared between the two groups by immunofluorescence method.Results MSCs were successfully isolated and cultured.77.19%of the totals were at G0/G1,and 95.8%was positive for CD44.DAPI labeling rate was 99.6%in vitro.DAPI-positive MSCs were significantly more in the bFGF+MSCs group than in the MSCs group by immunofluorescence imaging[(325±106)/mm2vs(186±67)/mm2,P<0.05].MSCs distributed more homogenous in the com-bination group,some cellscolocalized with host cardiomyocytes.Conclusion Coronary venous retrograde perfusion of basic fibroblast growth factor can improve MSCs homing to myocardium,and MSCs distributed more homogenous in the myocardium.
Cell transplantation; Basic fibroblast growth factor; Bone marrow mesenchymal stem cells;Coronary venous retroperfusion;Homing
国家自然科学基金面上项目(项目编号:81070166和81270284)
100029 北京市,首都医科大学附属北京安贞医院急诊危重症中心,北京市心肺血管疾病研究所(李学强、王晓、甄雷、缪黄泰、吴星欣、任红梅、师树田、阙斌、聂绍平),心内科(乔岩、刘新民);中国航天科工集团七三一医院心内科(李学强)
聂绍平,E-mail:spnie@126.com
10.3969/j.issn.1672-5301.2014.03.019
Q95-33;R542.2
A
1672-5301(2014)03-0253-05
2014-01-06)

