牦牛朊蛋白基因(Prnp)两个位点多态性与疯牛病抗性关系研究
王荔华,席冬梅,李国治,胡建宏
(1.西北农林科技大学 动物科技学院,陕西 杨凌 712100;2.青海省科学技术厅,青海 西宁 810000;3.云南农业大学 动物科学技术学院,云南 昆明650201)
牦牛朊蛋白基因(Prnp)两个位点多态性与疯牛病抗性关系研究
王荔华1,2,席冬梅3,李国治3,胡建宏1*
(1.西北农林科技大学 动物科技学院,陕西 杨凌 712100;2.青海省科学技术厅,青海 西宁 810000;3.云南农业大学 动物科学技术学院,云南 昆明650201)
为探索牦牛Prnp基因多态对疯牛病抗性的影响,收集288头牦牛肝脏DNA样品,利用PCR、酶切和电泳方法鉴定牦牛Prnp基因启动子区域23 bp和第一内含子区域12 bp插入/缺失(+/-)多态。结果表明,牦牛23 bp插入-插入、插入-缺失和缺失-缺失基因型的频率分别为0.027、0.113和0.860,其插入和缺失等位基因的频率分别为0.133和0.867;12 bp插入-插入、插入-缺失和缺失-缺失基因型的频率分别为0.627、0.355和0.018,其插入和缺失等位基因的频率分别为0.804和0.196。试验表明,牦牛12 bp多态位点具有较高的插入频率,而23 bp多态位点具有极低的插入频率;牦牛单倍体以23-12+D23I12为主,频率为0.692;Prnp基因23 bp和12 bp多态显著影响Prnp基因的表达量(P<0.05),而性别、年龄和毛色对Prnp基因的相对表达量无显著差异(P>0.05)。本结果为今后进一步筛选抗疯牛病牦牛奠定了基础。
牦牛;朊蛋白基因;多态性;疯牛病;抗性
疯牛病,即牛脑海绵状病,简称BSE。疯牛病的感染因子为朊蛋白(Prion protein),由朊蛋白基因(Bovine spongiform encephalopathy,Prnp)编码,是一种由牛朊蛋白基因突变或其编码蛋白(Prnp)构象发生改变而引起的神经退行性疾病[1-3]。1986年,该病首次在英国报道后,迅速在全球蔓延,目前已经波及法国、德国、美国、加拿大等26个国家,对各国畜牧业造成了巨大打击,为此各国迅速开展了相应的“斗牛”计划[4]。虽然目前中国还没有类似BSE案例的报道,但毗邻的日本于2001年报道了亚洲首例疯牛病,现已经确认40例[5-6],对我国构成了严重的威严,形势不容乐观。因此,有力开展“斗牛”计划刻不容缓[7]。
目前,国外研究表明Prnp基因启动子区域23 bp和第一内含子区域12 bp插入/缺失多态与疯牛病易感性或拮抗性存在显著关联;12 bp缺失干扰了与SP1转录因子的结合,23 bp缺失干扰了与转录因子阻遏蛋白58(Repressor protein of 58KDa)的结合,进而影响了牛Prnp基因mRNA的表达、修饰或三维结构,从而影响牛对BSE的易感性[8-10]。至今,美国、德国、斯洛伐克、日本、中国、越南、韩国等多个国家已开展了本地牛朊蛋白基因(Prnp)多态性与BSE易感性的研究[11-22]。但是,目前国外研究者只对家养牛(Bos taurus)—德国肉牛和日本黑牛的Prnp基因表达量进行分析验证,在非家养牛(放牧)领域鲜有报道。
牦牛(Bos gruniens)是青藏高原高寒地区的特有牛种,主产中国青藏高原海拔3 000 m以上地区,适应高寒生态条件,饲养方式以放牧为主[23-25]。本研究以牦牛为对象,通过分子克隆技术和酶切技术鉴定牦牛Prnp基因启动子区域23 bp和第一内含子区域12 bp插入/缺失多态,同时对牦牛的Prnp基因表达量进行分析验证,为非家养牛的疯牛病抗病育种提供基础。
1 材料与方法
1.1 材料来源
288头牦牛肝脏组织样品(DNA样品),其中79头(公牛50头,母牛29头)样品对应有延髓组织样品(RNA样品);平均年龄8.2岁。
1.2 引 物
Prnp基因启动子区域23 bp和第一内含子12 bp插入/缺失多态检测的引物,荧光定量PCR扩增
肌动蛋白基因(ACTB)和Prnp基因的引物(表1)。
1.3 PCR扩增
基因DNA提取按照组织DNA提取试剂盒的步骤进行。PCR反应总体积为25 μL:12.5 μL Mix;8.5 μL ddH2O;2 μL DNA模版;1 μL引物F(10 nM);1 μL引物R (10 nM)。PCR反应条件为:95 ℃预变性5 min;94 ℃变性45 s、23 bp为54 ℃,12 bp为53 ℃ 退火30 s、72 ℃延伸50 s,35个循环;72 ℃延伸7 min。反应结束后4 ℃保存备用。电泳检测后每种基因型挑选3个送至中美泰和生物公司测序。将获得的目的序列与GenBank上的序列进行比对和验证。

表1 基因PCR引物及相关信息Table 1 Primers and related information for PCR and real time PCR of target genes
1.4 Prnp基因启动子区域插入/缺失多态鉴定
将PCR扩增产物进行电泳检测。采用3%浓度琼脂糖凝胶进行检测和分析,每个样品取2 μL点样,同时点入2 μL DL2000(DNA Marker),80V,电泳45 min。观察电泳结果,统计Prnp启动子区域23 bp插入/缺失多态。
1.5 Prnp基因第一内含子区域插入/缺失多态鉴定
对12 bp插入/缺失区域的PCR扩增产物进行PCR-RFLP。PCR-RFLP所用的内切酶是SacⅡ内切酶(Fermentas公司)。1酶切反应的总体积12 μL:PCR产物3 μL,无菌水7.5 μL,10×Buffer B 1 μL,内切酶0.5 μL。反应条件:37 ℃水浴16 h。然后再进行1.5%浓度的琼脂糖凝胶电泳,80 V电泳30 min。观察电泳结果,统计Prnp内含子区域12 bp插入/缺失多态。
1.6 序列测定及分析
PCR产物利用DNA凝胶回收盒进行纯化回收,将纯化产物送往中美泰和公司进行序列测定,利用DNAStar和DNAMAN软件进行序列分析。
1.7 荧光定量PCR
提取79头牦牛延髓组织的RNA,反转录成cDNA后进行实时荧光定量PCR反应。反应体系为20 μL:无菌蒸馏水7.2 μL、SYBR Premix Ex Taq10 μL、正反向引物各0.4 μL和cDNA 2 μL。在Bio-RadiCycler荧光定量PCR仪上进行PCR。在57 ℃检测荧光,测定吸光值。扩增完毕后,进行溶解曲线的分析,65 ℃至95 ℃,以0.5 ℃/sec的速度逐渐升温到95 ℃进行溶解曲线的测定,并在此升温过程中进行荧光强度的连续检测。对扩增产物进行琼脂糖凝胶电泳分析特异性。
1.8 数据分析
试验数据均使用SPSS 16.0进行方差分析(One way ANOVA法)、多重比较(Duncan法)和相关性分析(Pearson法),结果表示为“平均值 ± 标准差”。
2 结果与分析
2.1 Prnp基因插入/缺失多态的电泳检测
PCR扩增产物经凝胶电泳分析,条带大小与预期扩增片段基本一致。从图1aPrnp基因启动子区域23bp插入/缺失的电泳检测结果可以看出,23++基因型153 bp处只有一条带,23--基因型在130 bp处只有一条带,而23+-基因型有2条带。图1b第一内含子区域12 bp的插入/缺失的电泳检测结果可知,通过SacII酶切后,12 bp++基因型只有276 bp和150 bp的2条带,12 bp--基因型在414 bp处只有1条带,而杂合子具有明显的3条带。
2.2 Prnp基因插入/缺失基因型的验证
将上述电泳检测结果确定的基因型经过测序(图2)后验证发现上述方法正确可靠,同时在NCBI 进行Blast比对后表明扩增产物为目标产物,可用于下一步分析。
2.3 Prnp基因插入/缺失的基因型频率和基因频率
288头牦牛Prnp基因23 bp插入/插入(+/+)、插入/删除(+/-)、删除/删除(-/-)基因型频率分别为0.027、0.113和0.860,23 bp插入/插入和删除/删除基因频率分别为0.133和0.867;而12 bp插入/插入、插入/删除、删除/删除基因型频率分别为0.627、0.355和0.018,12 bp插入/插入和删除/删除基因频率分别为0.804和0.196。由此可见,牦牛23 bp位点以删除为主,而12 bp位点以插入为主。

图1 牦牛Prnp基因23 bp(a)和12 bp(b)插入/缺失的电泳检测M.分子量;+/+是插入基因型;+/-是插入/删除基因型;-/-是删除基因型Fig.1 Gel electrophoresis of 23 bp insertion-deletion in the promoter (a) and 12 bp insertion-deletion in the first intron of Prnp in yak (b)M.molecular marker;+/+ is the insertation genetype;+/- shows the deletion-insertion genotype;-/- is the deletion genotype
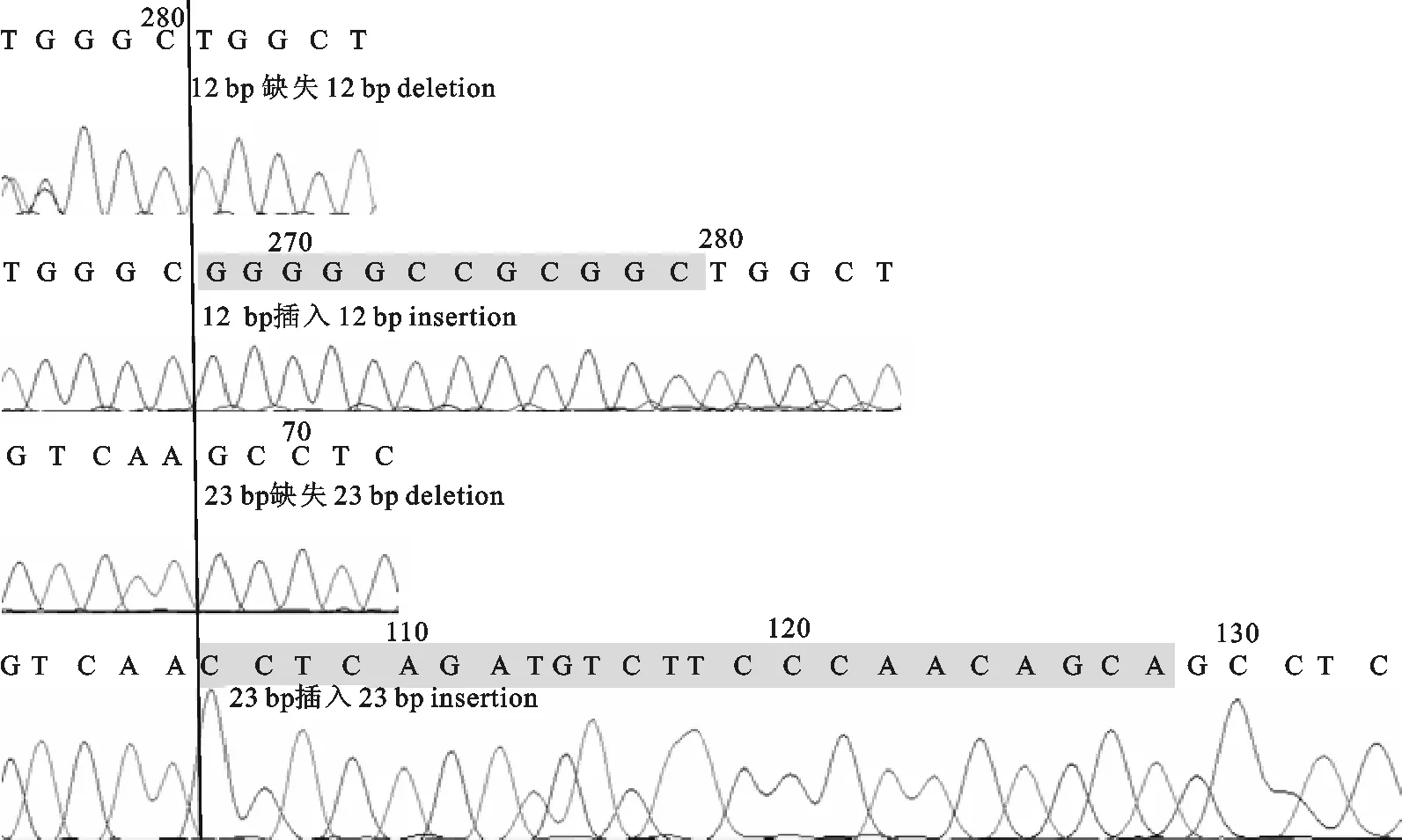
图2 牦牛23 bp和12 bp插入/缺失的序列检测Fig.2 Sequence of 23 bp insertion-deletion in the promoter and 12 bp insertion-deletion in the first intron of Prnp in yak
2.4 Prnp基因插入/缺失的单倍型构建
采用SHEsis软件包(http://www.bio-x.cn/analysisi)对Prnp启动子区域的23 bp和第一内含子区域的12 bp多态位点进行单倍型构建,结果发现单倍型牦牛以23-12+为主,频率为0.692,其他单倍型如23-12-、23+12+和23+12-分别为0.175、0.120和0.013。
2.5 牦牛Prnp基因和ACTB基因PCR扩增
Prnp基因和ACTB基因的PCR扩增产物用2 μL点样,在1%的琼脂糖凝胶,100V电泳30 min左右。从图3可以看出,目的条带分别是Prnp基因128 bp,ACTB基因143 bp,与预期结果相符,可以进新实时荧光定量PCR研究。
2.6 Prnp基因相对表达量分析
经过统计分析发现不同性别、年龄和毛色的牦牛延髓组织中Prnp基因mRNA的相对表达量差异不显著。由图4可知,基因型对牦牛延髓组织中Prnp基因的相对表达量有显著影响。牦牛延髓组织中Prnp基因在各基因型中的表达量高低顺序为:23插入-插入/12插入-插入(++/++)>23插入-插入/12插入-缺失(++/+ -)>23插入-缺失/12插入-插入(+ -/++)>23插入-缺失/12插入-缺失(+ -/+ -)>23缺失-缺失/12插入-插入(--/++)>23缺失-缺失/12插入-缺失(--/+ -)。其中23插入-插入/12插入-插入(++/++)基因型的Prnp基因相对表达量最低,而23缺失-缺失/12插入-缺失(--/+ -)基因型的Prnp基因相对表达量最高。
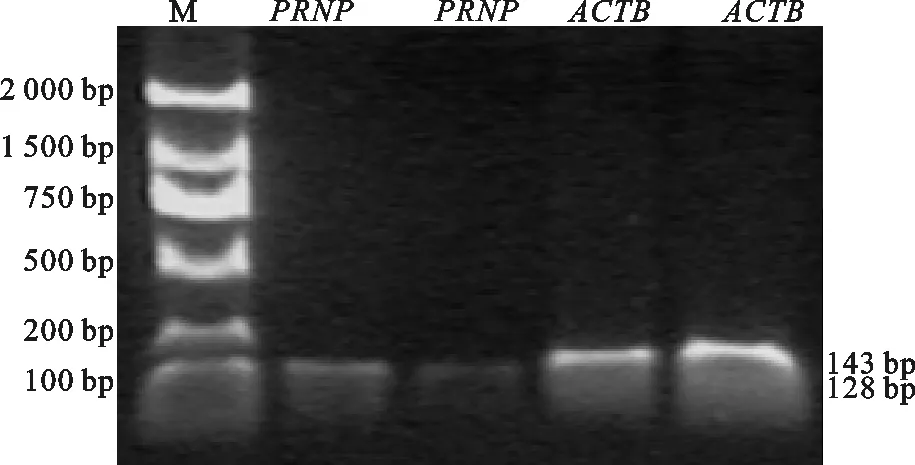
图3Prnp和ACTB基因的PCR扩增产物凝胶电泳图谱
Fig.3 Agarose gel electrophoresis of PCR products for thePrnpgene andACTBgene
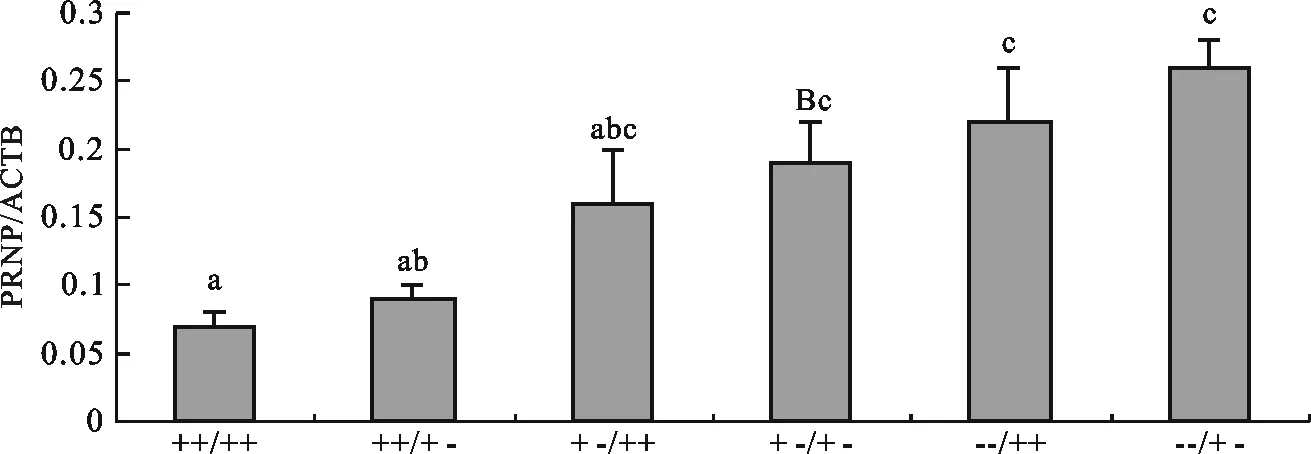
图4 不同基因型牦牛延髓组织中Prnp基因相对表达量比较Fig.4 Comparison of Prnp gene mRNA expressions in different genotype of medulla oblongata
3 讨 论
3.1 Prnp基因插入/缺失的等位基因鉴定
本试验使用两对引物对牦牛Prnp基因23 bp和12 bp插入/缺失等位基因进行了鉴定。其中23 bp插入/缺失采用3%的琼脂糖凝胶进行电泳,高浓度琼脂糖凝胶能很好分离PCR产物(>20 bp的插入/缺失等位基因),且条带清晰,带型单一。而12 bp插入/缺失采用高浓度琼脂糖凝胶鉴定,电泳后条带无法分离。因此,在本试验中采用鉴定家养牛Prnp基因12 bp插入/缺失的方法(PCR-RFLP)进行分析[12,26]。Prnp基因12bp插入/缺失位点中有SacⅡ酶切位点,若12 bp片段插入则SacⅡ的酶切位点起作用,PCR电泳条带带型呈两条带;反之,则为一条带。小片段的插入/缺失也可采用普通聚丙烯酰胺凝胶电泳(PAGE),无需变性,即可鉴定小片段(<20 bp)的插入/缺失等位基因。
3.2 基于Prnp基因插入/缺失多态评估BSE抗性
研究表明,能够通过23 bp和12 bp插入/删除频率对不同牛种BSE的抵抗能力进行评估[8-10]。即在一般情况下,具有较低23 bp和12 bp插入频率的牛种对BSE的抗性较低,而较高23 bp和12 bp插入频率的牛种对BSE具有较高的抗性。本研究结果与国外BSE病牛文献资料在相同位点上进行比较[9,13-15,17-18,26],进一步将本次得到的数据与国内外健康牛Prnp基因23 bp和12 bp位点的插入频率进行系统比较,发现牦牛对BSE的抗性较低。
在本研究中,通过PCR、酶切反应及送样测序确定了288头牦牛Prnp基因23 bp和12 bp插入/缺失多态。同时通过荧光定量PCR反应测定79头牦牛(延髓组织)Prnp基因的相对表达量,进而分析不同基因型、年龄、性别和毛色对Prnp基因相对表达量的影响,从而验证了非家养牛中23 bp和12 bp多态影响疯牛病的易感性,推测非家养牛和家养牛的疯牛病抗病机理类似,该结果为非家养牛的抗病育种提供一定的理论基础。
牦牛为青藏高原特有的畜种,发展牦牛产业对于提高牧区人民的生产生活水平具有重要意义。虽然目前没有发现牦牛感染疯牛病的报道[27-28],但本研究通过分析牦牛与其他牛种PRNP的多态性,发现牦牛对BSE的抵抗能力较低。因此,本研究结果对于后续牦牛育种工作中筛选可能对BSE具有较高抗性的基因型或单倍型,为进一步开展抗BSE类型牦牛的选育具有重要参考价值。
[1]Fischer M,Rulicke T,Raeber A,et al.Prion protein (PrP) with amino-proximal deletions restoring susceptibility of PrP knockout mice to scrapie[J].EMBO J,1996,15(6): 1 255-1 264.
[2]Prusiner S B.Prion diseases and the BSE crisis [J].Science,1998,278 (5336): 245-251.
[3]Goldmann W.PrP genetics in ruminant transmissible spongiform encephalopathies [J].Veterinary Research,2008,39(4): 30-43.
[4]管 峰,潘 磊,石国庆,等.绵羊Prnp遗传多样性与抗病育种研究进展 [J].遗传,2009,31(2):137-141.
[5]Msalya G,Shimogiri T,Okamoto S,et al.Gene and haplotype polymorphisms of the prion gene (Prnp) in Japanese native and Holstein cattle [J].Animal Science Journal,2009,80 (5): 520-527.
[6]Msalya G,Shimogiti T,Nishitani K,et al.Indels within promoter and intron 1 of bovine prion protein gene modulate the gene expression levels in the medulla oblongata of two Japanese cattle breeds [J].Animal Genetics,2010,41(2): 218-221.
[7]王淑娟,王志亮,杨 楠,等.牛群年龄结构与疯牛病发生风险的关系及我国现状[J].中国动物检疫,2009,26(1):43-45.
[8]Sander P,Hamann H,Drogemuller C,et al.Bovine prion protein gene (Prnp) expression and may be responsible for differences in bovine spongiform encephalopathy susceptibility [J].Journal of Biology Chemistry,2005,280 (45): 37 408-37 414.
[9]Juling K,Schwarzenbacher H,Williamsjl,et al.A major genetic component of BSE susceptibility [J].BMC Biology,2006,4:33.
[10]Xue G,Aida Y,Onodera T,et al.The 5' flanking region and intron 1 of the bovine protein gene (Prnp) are responsible for negative feedback regulation of the prion protein [J].PloS ONE,2012,3(7): e32870.
[11]Clawson M L,Heaton M P,Keele J W,et al.Prion gene haplotypes of US cattle [J].BMC Genetics,2006,7: 51.
[12]Brunelle B W,Greenlee J J,Seanury C M,et al.Frequencies of polymorphisms associated with BSE resistance differ significantly between Bos taurus,Bos indicus,and composite cattle [J].BMC Veterinary Research,2008,4: 36.
[13]Sander P,Hamann H,Pfeiffer I.Analysis of sequence variability of the bovine prion protein gene (Prnp) in German cattle breeds [J].Neurogenetics,2004,5 (1): 19-25.
[14]Haase B,Doherr M G,Seuberlich T,et al.Prnppromoter polymorphisms are associated with BSE susceptibility in Swiss and German cattle [J].BMC Genet,2007,8:15.
[15]Murdoch B M,Clawson M L,Yue S,et al.Prnphaplotype associated with classical BSE incidence in European Holstein cattle [J].PLoS ONE,2010,5(9):e12786.
[16]Gurgul A,Sota E.Effect of bovinePrnpgene polymorphisms on BSE susceptibility in cattle [J].Folia Biology (Krakow),2007,55(3-4): 81-86.
[17]Kashkevich K,Humeny A,Ziegler U,et al.Functional relevance of DNA polymorphisms within the promoter region of the prion protein gene and their association to BSE infection [J].FASEB J,2007,21(7):1 547-1 555.
[18]HreskO S,Mojzis M,Tkacikova L.Prion protein gene polymorphism in healthy and BSE-affected Slovak cattle [J].Journal of Applied Genetics,2009,50(4): 371-374.
[19]Xue G,Sakudo A,Kim C,et al.Coordinate regulation of bovine prion protein gene promoter activity by two Sp1 binding site polymorphisms [J].Biochemical and Biophysical Research Communications,2008,372 (4): 530-535.
[20]Qin L H,Zhao Y M,Bao Y H,et al.Polymorphism of the prion protein gene (Prnp) in two Chinese indigenous cattle breeds [J].Molecular Biology Reports,2011,38(6): 4 197-4 204.
[21]Muramatsu Y,Sakemi Y,Horiuchi M,et al.Frequencies ofPrnpgene polymorphisms in Viernamesse dairy cattle for potential association with BSE [J].Zoonoses and Public Health,2008,55(5): 267-273.
[22]Choi S H,Chae S H,Choi H H,et al.Genomic sequence variability of the prion gene (Prnp) in Korean cattle [J].Asian-Australasian Journal of Animal Sicences,2007,20(5): 653-660.
[23]Wiener G,Han J L,Long R J.The Yak[M].2nd Ed.Bangkok Thailand: FAO Regional Office for Asia and the Pacific,2003,2:136-137.
[24]Qiu Q,Zhang G,Ma T,et al.The yak genome and adaptation to life at high altitude [J].Nat Genet,2012,44:946-949.
[25]Xi D M,Wu M,Fan Y Y,et al.Isolation and characteristics of the melanocortin 1 receptor gene (MC1R) in the Chinese yakow (Bos grunniens x Bos taurus) [J].Gene,2012,498:259-263.
[26]Nakamitsu S,Miyazawa T,Horiuchi M,et al.Sequence variation of bovine prion protein gene in Japanese cattle (Holstein and Japanese Black) [J].J Vet Med Sci,2006,68(1):27-33.
[27]席冬梅,刘 情,于虹漫,等.牛羊朊蛋白基因(PRNP)多态性与抗病性的研究进展[J].云南农业大学学报,2011,26(3): 418-425.
[28]刘 情.大额牛朊蛋白基因(PRNP)多态性对疯牛病易感性的影响[D].昆明:云南农业大学,2011.
TheRelatiowshipofTwoLociPolymorphismsofthePrionProteinGeneonResistancetoBovineSpongiformEncephalopathiesinYak
WANG Li-hua1,2,XI Dong-mei3,LI Guo-zhi3,HU Jian-hong1*
(1.CollegeofAnimalScienceandTechnology,NorthwestA&FUniversity,Yangling,Shaanxi712100,China;2.QinghaiProvincialDepartment,XiningofScienceandTechnology,Qinghai810000,China;3.CollegeofAnimalScienceandTechnology,YunnanAgriculturalUniversity,Kunming,Yunnan650201,China)
The prion protein was encoded by the prion protein gene (Prnp) which is the major gene for affectingBovineSpongiformEncephalopathy(BSE) resistance.To investigate the effect of polymorphisms of the prion protein gene (Prnp) on the resistance of BSE in Yak,in the present study,we have collected liver samples from 288 yak (Bosgrunniens) and measured the polymorphisms from the 23 bp indel in promoter and the 12 bp indel in the first intron of thePrnpgene by using PCR,RFLP and electrophoresis methods.The 23bp allele has three genotypes (23+/+,23+/-,23-/-) which frequencies are 0.027,0.113 and 0.860,respectively and the allele frequencies are 0.133(I23) and 0.867 (D23).The 12bp allele also has three genotypes (12+/+,12+/-,12-/-I12/I12,I12/D12,D12/D12) which frequencies are 0.627,0.355 and 0.018,respectively.The allele frequencies are 0.804 (I12) and 0.196 (D12).These results revealed that yak has higher insertion frequency in 12 bp site but not for 23 bp site.The main haplotype is 23+12-23D-12I and the frequency is 0.692.The genotype fromPrnp23 bp and 12 bp has significantly role on the relative expression of thePrnpgene but not for gender,age and coat color.Finally,these results conducted in the present study will provide the molecular basis on the resistance to BSE for yak in future.
Yak;Prion protein gene (Prnp);polymorphism;Bovinespongiformencephalopathy(BSE);resistance
2013-10-16,
2013-12-02
王荔华(1973-),男,陕西大荔人,本科,助理研究员,主要从事科技管理工作。E-mail:wlh1119@163.com
*[通讯作者]胡建宏(1969-),男,陕西白水人,博士,教授,主要从事动物生殖生理调控方面的教学与科研工作。E-mail:hjh19732008@126.com
S811.6
A
1005-5228(2014)02-0015-06
——防控专家访谈录

