isoBu-BTP/[C2mim][NTf2]萃取体系对几种稀土元素的萃取
马声谷,马国龙,袁威津,赵 龙,韦悦周
上海交通大学 核科学与工程学院, 核能化工实验室,上海 200240
isoBu-BTP/[C2mim][NTf2]萃取体系对几种稀土元素的萃取
马声谷,马国龙,袁威津,赵 龙*,韦悦周
上海交通大学 核科学与工程学院, 核能化工实验室,上海 200240
本研究讨论了2,6-bis(5,6-dibutyl-1,2,4-triazin-3-yl)pyridine (isoBu-BTP)作为萃取剂在一种常见的疏水性咪唑类离子液体1-乙基-3-甲基咪唑双三氟甲磺酰亚胺盐([C2mim][NTf2])中对硝酸溶液中几种稀土元素(Y、Nd、Eu、Dy)的萃取行为,其中重点考察对Dy的萃取。研究结果表明:与传统有机溶剂体系相比,离子液体萃取体系在低酸度(0.01~0.1 mol/L)下对稀土元素有良好萃取效果,特别是对Dy显示了良好的选择性,另一方面,利用高酸(>3 mol/L)可以进行反萃;本研究以对Dy的萃取为例,通过双对数法,推算出Dy3+与isoBu-BTP的化学当量比为1∶2.4。由此推测Dy3+的萃取机理可能分为两方面,一方面是多数Dy3+与isoBu-BTP形成摩尔比为1∶3的配合物,另一方面是小部分Dy3+与[C2mim]+进行阳离子交换被离子液体本身萃取,从而证明了该体系中离子液体具有协同萃取的效应。
isoBu-BTP;离子液体;萃取;稀土元素;镝
离子液体因其挥发性低,热稳定性高及其在萃取金属离子方面的优良表现被认为是乏燃料后处理中萃取分离放射性元素的新一代绿色溶剂,有着潜在的应用前景。利用离子液体作为溶剂载体的新型萃取分离体系可以克服传统有机溶剂萃取体系的诸多缺点[1]。近年来,含氮配位子化合物R-BTP(bis-triazine-pyrdine,R为烃基)作为萃取剂开始应用在An(Ⅲ)/Ln(Ⅲ)分离工艺中。这类化合物可以完全焚烧,不会产生二次固体废物,而且对Am(Ⅲ)有很好的选择性,目前受到了国际上的广泛关注和评价[2-3]。R-BTP作为萃取剂的研究主要集中在BTP-有机溶剂体系的针对各种金属元素的萃取行为上,也有一部分研究者将R-BTP灌入多孔质二氧化硅球内进行固相萃取分离研究。从目前的文献来看,尚无R-BTP类萃取剂在离子液体中进行萃取应用的报道[2-4]。
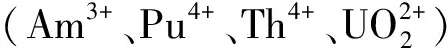
综上所述,离子液体作为新一代绿色溶剂,能够有效地促进几种常见萃取剂对稀土元素和乏燃料中的镧/锕系裂变元素的萃取,并显示了不同于传统有机溶剂体系的萃取机理。三价锕系/镧系元素间的分离是“分离-嬗变”战略中的重要一步,是目前分离化学领域的一项研究热点。含N原子软配体萃取剂是目前较有应用前景的一类萃取剂,而离子液体是一类新兴的溶剂,本工作将二者结合用于稀土元素的萃取,拓宽了该领域的研究范围,具有较强的应用价值。本研究以[C2mim][NTf2]离子液体为溶剂,isoBu-BTP为萃取剂,考察其在HNO3环境下对稀土金属离子的萃取,并研究Dy3+的萃取机理和反萃。研究目的是探讨R-BTP/离子液体体系对几种稀土元素(Y、Nd、Eu、Dy)的萃取,其中以Dy和Eu元素分别模拟乏燃料中的锕系和镧系元素,通过液液萃取模拟该萃取体系在硝酸介质中镧锕分离性能。
1 实验部分
1.1试剂及仪器
isoBu-BTP (2,6-bis(5,6-dibutyl-1,2,4-triazin-3-yl)pyridine,纯度98%),由实验室参照文献[11]合成;离子液体1-乙基-3-甲基咪唑双三氟甲磺酰亚胺盐([C2mim][NTf2],纯度99%),河南林州市科能材料科技有限公司;Y(NO3)3·6H2O、Nd(NO3)3·6H2O、Eu(NO3)3·6H2O、Dy(NO3)3·5H2O均为分析纯,国药集团化学试剂有限公司。其他试剂均为分析纯。isoBu-BTP和离子液体[C2mim][NTf2]的分子式示于图1。
ICPS-7510电感耦合等离子体-原子发射光谱仪,日本SHIMADZU公司;SA-2100E纯水机,电导率为0.2~1 μs/cm,日本EYELA公司;NTS-4000C往复式水浴恒温振荡器,日本EYELA公司。
1.2实验方法
1.2.1萃取实验 在萃取实验之前,先对[C2mim][NTf2]离子液体进行纯化。首先按照相比1∶1在离子液体中加入纯水,漩涡震荡1 min,10 000 r/min离心2 min后去除上层水,重复8次,然后在50 ℃真空干燥24 h后得到纯化的[C2mim][NTf2]离子液体。随后进行萃取实验,取溶有isoBu-BTP的[C2mim][NTf2]为有机相与溶有金属离子和硝酸的水溶液按照相比1∶1混合,在水浴摇床内振荡(120 r/min, 25 ℃)48 h(通过萃取平衡实验确定)后离心分离,取一定量的水相稀释后利用ICPS-7510分析萃取前水相中的金属离子初始浓度(caq,0(M))和萃取后水相中金属离子的浓度(caq(M))。由于本课题检测过反应前后有机相与水相的体积变化,发现有机相体积的变化在2%以内,这也与文献[12]相吻合,因此可以认为本实验中反应前后有机相与水相的体积基本没有变化。所以萃取后有机相中的金属离子浓度(corg(M))可由式(1)求得:
corg(M)=caq,0(M)-caq(M)
(1)
通过反应前后的金属离子的浓度,由式(2—4)可求得分配比D、萃取效率E和分离因数SF。
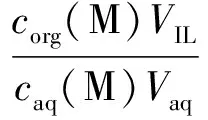
(2)
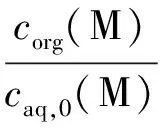
(3)
(4)
式中:VIL代表离子液体体积,mL;Vaq代表水相体积,mL;D(Dy3+)代表Dy的分配比,D(M3+)代表除了Dy以外其他的稀土元素的分配比。
1.2.2反萃实验 萃取实验如上所述,待萃取完成后离心分离出水相和有机相,然后各取1 mL萃后有机相分别与1 mL的H2O、1 mol/L HNO3、3 mol/L HNO3、5 mol/L HNO3、0.01 mol/L DTPA(diethylenetriaminepentacetate acid)、0.5 mol/L 硫脲(thiourea)接触振荡48 h后,离心分离出水相,分别测量萃取前Dy3+离子浓度c0(Dy3+)、萃取后水相Dy3+离子浓度caq,1(Dy3+)以及反萃后的水相Dy3+离子浓度caq,2(Dy3+)。又因为反应前后有机相的体积基本没有变化,那么萃取后的有机相中的Dy3+的浓度corg,1(Dy3+)可由式(5)求得:
corg,1(Dy3+)=c0(Dy3+)-caq,1(Dy3+)
(5)
由于反萃试验是从萃取后的有机相中反萃金属离子至水相,又因为有机相和水相的相比是1∶1,那么反萃后的有机相Dy3+离子浓度corg,2(Dy3+)可由式(6)求得:
corg,2(Dy3+)=corg,1(Dy3+)-caq,2(Dy3+)
(6)
由于本实验中反应前后有机相与水相的体积基本没有变化,因此反萃率(E*)可由式(7)求得:
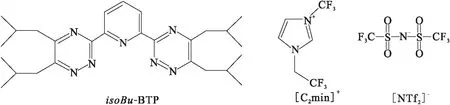
图1 isoBu-BTP及离子液体[C2mim][NTf2]分子结构图Fig.1 Molecular structure of isoBu-BTP and [C2mim][NTf2]
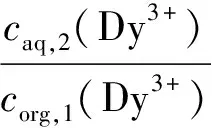
(7)
2 结果及讨论
2.1酸度对稀土元素萃取的影响

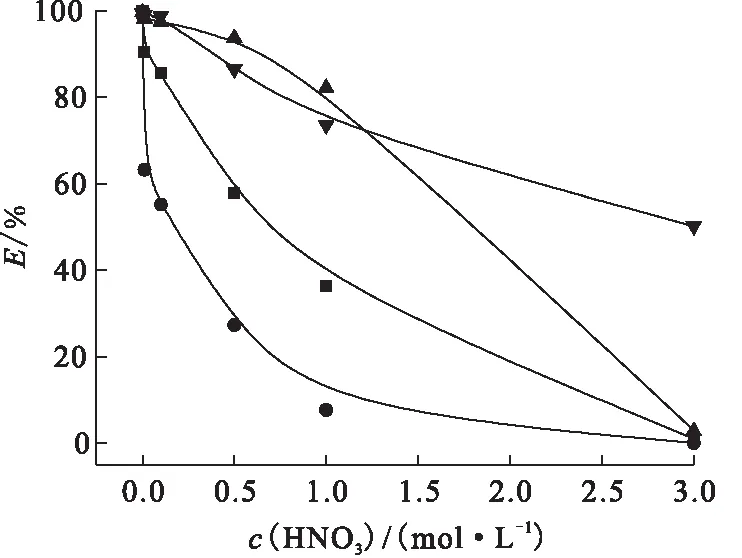
■——Y3+,●——Nd3+,▲——Eu3+,▼——Dy3+
图2同时表明了在酸度为0.01~0.5 mol/L时稀土金属离子的萃取效果很好,此时对Dy3+和Eu3+基本可以达到完全萃取。特别是在0.01 mol/L酸度下,Dy3+针对其他稀土元素的分离因数分别为SF(Dy3+/Nd3+)=60,SF(Dy3+/Y3+)=11,SF(Dy3+/Eu3+)=2,上述数据很好地说明了在此酸度下isoBu-BTP对Dy3+具有良好的选择性,从而可以实现Dy3+与Y3+、Nd3+、Eu3+的有效分离。本实验还对isoBu-BTP在离子液体中的溶解度进行了考察,结果表明,室温下100 g [C2mim][NTf2]可以溶解93.3 gisoBu-BTP,而本工作中BTP浓度远小于溶解度,粘度不大,易于离心分离。
由于isoBu-BTP对Dy3+在低酸度(0.01~0.5 mol/L)下萃取效率达到90%以上,同时对Dy3+也显示了很好的萃取选择性,又因为Dy3+可以在冷态实验中模拟高放废液(HLLW)中的Am3+[16],所以以下研究均围绕Dy展开,重点研究isoBu-BTP/[C2mim][NTf2]体系对Dy的萃取机理。
2.2不同萃取体系下对Dy3+萃取的影响
选择4种常见的BTP有机溶剂:辛醇、正十二烷、环己烷、正己醇,分别考察isoBu-BTP溶于上述有机溶剂后对Dy3+的萃取效果。考虑到离子液体本身也具有萃取效果,因此考察了纯离子液体对Dy3+的萃取效果。在Dy3+初始浓度为2 mmol/L、BTP浓度22.09 mmol/L、温度25 ℃、振荡频率120 r/min、硝酸酸度为0.01 mol/L的条件下,将上述各种萃取体系就Dy3+的萃取效果与isoBu-BTP/离子液体体系进行比较,实验结果列于表1。从表1结果可以看出,在相同的实验条件下,isoBu-BTP/离子液体体系的萃取率高达99.03%,而isoBu-BTP/传统有机溶剂体系的萃取率为0,上述结果也与Kojiro等[7]研究的将TODGA作为萃取剂在不同体系下的实验结果相类似。推测其原因是在离子液体的极性环境下,isoBu-BTP和Dy3+更易于形成配合物。从表1还可以看出,单独离子液体对Dy3+也有4.1%的萃取率,推断离子液体在萃取过程中具有双重作用[10]:一方面离子液体是isoBu-BTP的稀释剂,另一方面离子液体对isoBu-BTP具有协同萃取的作用。
2.3盐析剂浓度对Dy3+萃取的影响

表1 不同萃取体系下Dy3+的萃取性能Table 1 Extraction effect of Dy3+ in different extracting systems


▲——NaNO3,▼——KNO3
2.4isoBu-BTP浓度对Dy3+萃取的影响
本工作重点对Dy3+的萃取进行研究,已知在0.01 mol/L酸度下萃取效率最高,为了探讨低酸度下Dy3+与isoBu-BTP的配位关系,进行了不同isoBu-BTP浓度对Dy3+的萃取影响实验。

[M·BTP3(NO3)3]org
(8)
由此假设isoBu-BTP对Dy3+的萃取反应式可以表达为:
[Dy(BTP)m(NO3)n]org
(9)
该反应的平衡常数可以表达为:

(10)
该反应的分配比表达为:
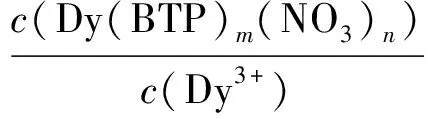
(11)
由(10)、(11)式可以推出:
(12)
通过(12)式可以看出,以lgc(isoBu-BTP)为x轴,lgD为y轴,拟合出来的直线的斜率就是所求的m值。当c(HNO3)=0.01 mol/L、c(Dy3+)=20 mmol/L、温度25 ℃、相比(O/A)为1∶1、振荡频率120 r/min、时间24 h、BTP浓度为20~50 mmol/L时,对Dy3+进行萃取实验,实验结果示于图4。在图4中,拟合出来的直线斜率为2.4,根据斜率分析法可以得出Dy3+与isoBu-BTP的化学当量比(Dy3+/isoBu-BTP)为1∶2.4。由此推测isoBu-BTP参与的阳离子交换萃取了大部分Dy3+,其阳离子交换反应式为式(13)。

图4 isoBu-BTP浓度对Dy3+萃取的影响Fig.4 Effect of concentration of isoBu-BTP on extraction efficiency of Dy3+

[Dy(BTP)3][NTf2]3+3[C2mim]+
(13)
Sascha等[14]研究了CA-BTP和镧系元素的配位比,通过双对数法发现lgD/lgc(BTP)的斜率为2.5,对此Sascha给出了两种解释:一种是CA-BTP与镧系元素形成3∶1配合物,另一种是除了3∶1配合物之外还存在2∶1或者是1∶1的配合物,然而有研究[17-19]表明,通过质谱(MS)和时间分辨激光荧光光谱法(TRLFS)检测发现2∶1和1∶1的聚合物仅占全部聚合物中很少的一部分(<1 mmol/L)。因此认为,在两相交界处,水相中的Dy3+和isoBu-BTP主要形成了1∶3的配合物,该配合物进入有机相,同时有机相中的[C2mim]+进入水相,从而完成一次阳离子交换。根据文献[20]可知,在BTP-辛醇/煤油的萃取体系下,Dy3+与BTP的配位应该是1∶3,而本工作的实验结果为1∶2.4,推测其原因是在离子液体的极性体系里,离子液体本身也萃取了一部分的Dy3+(纯离子液体在0.01 mol/L酸度下对Dy3+有4%的萃取率)。
除了上述的反应,在本体系中还存在其他的反应,有学者对此进行了相关的研究。Sascha等[14]在研究CA-BTP/辛醇体系对Am3+和Eu3+的萃取时发现,H+会争夺与BTP的配位,具体反应式见式(14)。Mark等[21]将冠醚(DCH18C6)溶于[Cnmim][NTf2]中对Na+进行萃取,研究结果发现,H3O+参与阳离子交换,具体反应式见式(15)。
(14)
[Dy(BTP)m(NO3)n]org
(15)
结合以上两式,推测在isoBu-BTP/离子液体体系中,H3O+也参与了阳离子交换,并且和Dy3+竞争与BTP的配位,具体反应式见式(16)。

[H3O·BTP][NTf2]org+[C2mim]+
(16)
2.5反萃实验
根据硝酸酸度对BTP萃取稀土金属离子影响的实验可知:在高酸下(>1 mol/L)BTP对稀土金属基本不萃取,所以可以利用高浓度硝酸反萃Dy3+。本实验选用了几种常见的络合剂,包括0.01 mol/L DTPA、0.5 mol/L硫脲,此外还考察了纯水的反萃效果,结果列于表2。从表2可以看出,用3~5 mol/L HNO3一次即能将Dy3+完全反萃出来,其他的反萃剂基本没有反萃效果。推测其原因是在高酸环境下,离子液体中Dy3+和isoBu-BTP形成的配合物的结构遭到破坏,因此Dy3+得以进入水相从而完成反萃。
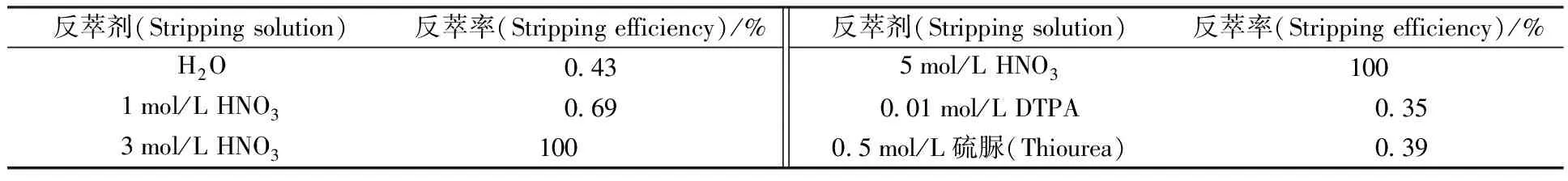
表2 几种反萃剂对Dy3+的反萃效果Table 2 Stripping efficiency of Dy3+ from ILs using various stripping solution
3 结 论
(1)isoBu-BTP/[C2mim][NTf2]体系在0.01~0.5 mol/L酸度下对Y3+、Nd3+、Eu3+、Dy3+具有很好的萃取效率,同时对Dy3+显示了良好的萃取选择性。在本体系中,硝酸浓度的增加不会带来明显的盐析效应,这说明提高硝酸浓度后萃取率的降低是由于H3O+与Dy3+对isoBu-BTP的竞争配位导致。又因为在高酸度下isoBu-BTP不稳定,这也会导致酸度增加其萃取效率的下降。考虑到isoBu-BTP在[C2mim][NTf2]离子液体中具有很大的溶解度,若继续增大BTP在离子液体中的浓度,其金属离子的分配比D还有进一步提升的空间。
(2) 在0.01 mol/L酸度下,isoBu-BTP/离子液体体系对Dy3+的萃取效率远大于isoBu-BTP/常规有机溶剂体系,另外利用3~5 mol/L HNO3就能一次性从离子液体中反萃出Dy3+,因此isoBu-BTP/[C2mim][NTf2]体系具有很好的研究和工艺前景。
(3) 通过双对数法,初步推测isoBu-BTP/[C2mim][NTf2]体系对Dy3+的萃取机理分为两方面,一方面是多数Dy3+与isoBu-BTP形成摩尔比为1∶3配合物,另一方面是小部分Dy3+与[C2mim]+进行阳离子交换被离子液体本身萃取,从而证明了该体系中离子液体具有协同萃取的效应。
参考文献:
[1]Bell T J, Ikeda Y. The application of novel hydrophobic ionic liquids to the extraction of uranium(Ⅵ) from nitric acid medium and a determination of the uranyl complexes formed[J]. Dalton Trans, 2011, 40: 10125.
[2]Panak P J, Geist A. Complexation and extraction of trivalent actinides and lanthanides by triazinylpyridine N-donor ligands[J]. Chem Rev, 2013, 113: 1199.
[3]薛文静,张安运,柴之芳.用于次锕系元素萃取分离的萃取剂研究进展[J].中国科技论文,2012,7(9):657-665.
[4]Hoshi H, Wei Y Z, Kumagai M, et al. Separation of trivalent actinides from lanthanides by using R-BTP resins and stability of R-BTP resin[J]. J Alloys Compd, 2005, 10.1016/j.
[5]沈兴海,徐超,刘新起,等.离子液体在金属离子萃取分离中的应用[J].核化学与放射化学,2006,28(3):129-138.
[6]Visser A E, Rogers R D. Room-temperature ionic liquids: new solvents for f-element separations and associated solution chemistry[J]. J Solid State Chem, 2003, 171: 1-2.
[7]Kojiro S, Kensuke K, Hirochika N. Extraction behavior of lanthanides using a diglycolamide derivative TODGA in ionic liquids[J]. Dalton Trans, 2008, 10.1039/b810277p.
[8]黄磊,黄卫,付海英,等.CMPO-离子液体体系对Ce3+的萃取[J].无机化学学报,2012,28(4):669-673.
[9]Jensen M P, Neuefeind J, Beitz J V. Mechanisms of metal ion transfer into room-temperature ionic liquids: the role of anion exchange[J]. J Am Chem Soc, 2003, 125(50): 15466-15473.
[10]徐超,沈兴海,陈庆德,等.冠醚-离子液体体系对水相中锶离子的萃取研究[J].中国科学,2009,39(11):1402-1408.
[11]Rawat N, Bhattacharyya A, Ghosh S K, et al. Thermodynamics of complexation of lanthanides with 2,6-bis(5,6-diethyl-1,2,4-triazin-3-yl) pyridine[J]. Radiochim Acta, 2011, 99: 705-712.
[12]吴京柯,沈兴海,陈庆德.CMPO-离子液体萃取分离铀(Ⅵ)体系的电化学性质[J].物理化学学报,2013,29(8):1705-1711.
[13]Sang J Y, Jae G L, Hideo T, et al. Extraction of lanthanide ions from aqueous solution by bis(2-ethylhexyl)phosphoric acid with room-temperature ionic liquids[J]. J Ind Eng Chem, 2010, 16: 350-354.
[14]Sascha T, Andreas G, Petra J P, et al. An improved hydrolytically-stable bis-triazinyl-pyridine(BTP) for selective actinide extraction[J]. Solvent Extr Ion Exch, 2011, 29: 213-229.
[15]Hill C, Guillaneux D, Berthon L, et al. Sanex-BTP process development studies[J]. Nucl Sci Technol, 2002(Suppl 3): 309.
[16]Shigekazu U, Yuezhou W, Yuanlai X, et al. Development of a simplified separation process of trivalent minor actinides from fission products using novel R-BTP/SiO2-P adsorbents[J]. J Nucl Sci Technol, 2012, 49(3): 334-342.
[17]Colette S, Amekraz B, Madic C, et al. Use of electrospray mass spectrometry (ESIMS) for the study of europium(Ⅲ) complexation with bis(dialkyltriazinyl)pyridines and its implications in the design of new extracting agents[J]. Inorg Chem, 2002, 41: 7031-7041.
[18]Denecke M A, Panak P J, Burdet F, et al. A comparative spectroscopic study of U(Ⅲ)/Am(Ⅲ) and Ln(Ⅲ) complexed with N-donor ligands[J]. C R Chimie, 2007, 10: 872-882.
[19]Steppert M, Walther C, Geist A, et al. Direct nano ESI time-of-flight mass spectrometric investigations on lanthanide BTP complexes in the extraction-relevant diluent 1-octanol[J]. New J Chem, 2009, 33: 2437-2442.
[20]Kolarik Z, Mullich U, Gassner F. Extraction of Am(Ⅲ) and Eu(Ⅲ) nitrates by 2-6-di-(5,6-dipropyl-1,2,4-triazin-3-yl)pyridines[J]. Solvent Extr Ion Exch, 1999, 17: 1155-1170.
[21]Mark L D, Dominique C S. A ternary mechanism for the facilitated transfer of metal ions into room-temperature ionic liquids (RTILs): implications for the “greenness” of RTILs as extraction solvents[J]. Green Chem, 2005, 10.1039/b508604c.
ExtractionofSeveralRare-EarthMetalIonsUsingisoBu-BTP/[C2mim][NTf2]System
MA Sheng-gu, MA Guo-long, YUAN Wei-jin, ZHAO Long*, WEI Yue-zhou
Nuclear Chemical Engineering Laboratory, School of Nuclear Science and Engineering,Shanghai Jiao Tong University, Shanghai 200240, China
Hydrophobic ionic liquids are promising extraction media in solvent extraction separation of metal ions. In current research, the extraction behavior of several rare-earth metals(Y, Nd, Eu, Dy) from nitric acid solution was studied using a novel extracting system based on hydrophobic ionic liquid. The novel extracting system is made up of 2,6-bis(5,6-dibutyl-1,2,4-triazin-3-yl)pyridine(isoBu-BTP), which acted as extractant, can separate lanthanides and minor actinides effectively in nitric acid solution. 1-ethyl-3-methylimidazolium bis(trifluoromethylsulfonyl)imide ([C2mim][NTf2]), which acted as extraction medium, shows a great solubility againstisoBu-BTP. The influence of the concentration of nitric acid, the concentration of extractant and the stripping condition was investigated in detail. It was found that theisoBu-BTP/[C2mim][NTf2] extracting system is favorable to extract rare-earth metals at low acidity condition (<0.1 mol/L), and back-extract at high acidity condition (>3 mol/L). In addition, Dy was found to be selectively extracted in current extracting system. The extraction mechanism for the extraction of Dy3+was also discussed. A lg-lg plot of theD(Dy) values versusisoBu-BTP concentration gave a straight line with a slope of 2.4. It is suggested that most Dy from aqueous phase was extracted by BTP, which can form a 3∶1 molar complex with Dy3+; while a small quantity of Dy was extracted by ionic liquid itself. The cation exchange and co-extraction, which induced from ionic liquid, functioned to extraction and resulted into such stoichiometry mentioned above.
isoBu-BTP; ionic liquid; extraction; rare-earth metal; dysprosium
2013-11-13;
2013-12-28
国家自然科学基金资助项目(91126006);上海高校特聘教授(东方学者)岗位计划资助项目
马声谷(1990—),男,山东菏泽人,硕士研究生,核科学与工程专业
*通信联系人:赵 龙(1975—),男,陕西西安人,副教授,核化工方向,E-mail: ryuuchou@sjtu.edu.cn
O658.2;O641
A
0253-9950(2014)04-0193-07
10.7538/hhx.YX.2014.2013074

