脱氢表雄酮对卵巢储备低下患者体外受精-胚胎移植的影响
张 平, 赵 静, 王蕴颖, 韩晓艳
(陕西省西安市第四医院 生殖医学科, 陕西 西安, 710004)
卵巢储备即卵巢皮质区卵泡生长、发育,形成可受精卵泡的能力,是女性生育能力的反映。目前,在临床实践中,卵巢储备功能下降(DOR)患者有增多的倾向,占不孕女性的10%以上[1]。DOR患者在体外受精-胚胎移植实践中,对促性腺激素(Gn)不敏感,获卵数低,优质卵泡少,难以形成优质胚胎,且流产率比较高,至今没有一种公认的最有效的方法可以改善DOR患者超促排卵(COH)反应性[2]。近年来,脱氢表雄酮(DHEA)可以改善卵巢储备功能的报道备受关注。本研究针对部分出境方便的DOR患者,建议其自行购买DHEA服用3个月后再行IVF-ET, 现报告如下。
1 资料与方法
1.1 一般资料
2011年1月—2013年10月到本科就诊的21例患者,月经规律,年龄<38岁,体质量指数(BMI)<18~<25。患者经历1次以上体外授精-胚胎移植(IVF-ET)失败,基础卵泡刺激素(FSH)≥10 mIU/mL, 雌二醇(E2)≥8 pg/mL, 双侧窦卵泡数(AFC)≤6, COH周期取卵数≤5。排除卵巢肿瘤、内异症、输卵管积水、子宫内膜病变、生殖器畸形者。
1.2 方法
在患者签署知情同意书后,建议其自行出境购买美国产药物级DHEA(美国GNC健安喜, 25 mg/粒, 90粒/瓶),口服, 25 mg/次, 3次/d, 连服3个月。3个月后再次尝试IVF-ET。所有患者COH周期均采用经典的小剂量GnRHa+FSH/HMG短方案。
1.3 观察指标
比较患者服用DHEA前后各1个IVF-ET周期的相关指标变化情况。
2 结 果
2.1 DHEA服用前后患者基础性激素及AFC的变化
DHEA改善了患者基础性激素及AFC的表现。患者基础FSH由服药前的(13.3±1.2) mIU/mL降至服药后的(8.2±1.5) mIU/mL, 服药前后周期比较,有明显统计学差异(P<0.05)。患者基础E2服药前(143.2±21.0) pg/mL, 服药后(64.5±18.6) pg/mL, 也有明显的下降。同时患者基础AFC明显增多,提示患者卵巢储备能力得到提升。见表1。
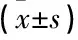
表1 DHEA服用前后患者基础性激素及AFC的变化
2.2 患者服药前后COH周期指标比较
患者服药后对COH的反应性明显提高,表现在Gn天数、Gn数量减少,取卵数、优质卵泡数增加,见表2。
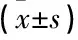
表2 患者服用DHEA前后COH周期指标的比较
2.3 DHEA改善了IVF-ET临床疗效
21例患者在服用DHEA前的1个IVF-ET周期中,10例没有取到卵而取消了周期,8例移植后没有妊娠,5例妊娠后流产。在服药后的IVF-ET周期,所有患者均完成取卵手术。除1例患者因没有可移植胚胎取消移植外,另外20例都移植了至少1个胚胎,平均移植胚胎数为(2.1±0.6)个。移植胚胎的20例患者中, 8例妊娠,临床妊娠率为40.0%, 其中2例发生了流产,流产率为25.0%。
3 讨 论
目前研究认为,年龄、体质量、生活习惯如吸烟等都可导致卵巢储备能力的下降,也有不明原因者,推测可能与生理及非生理等因素均有关[3-4]。DOR患者卵泡对FSH的敏感性下降,卵泡发育受限,颗粒细胞产生抑制素(INH)减少导致早卵泡期FSH水平升高,通过下丘脑-垂体-卵巢的正反馈调节能使促性腺激素释放激素(GnRH)代偿性增高,进一步提高了FSH水平,且大都伴随有FSH/LH升高[5-6]。在自然周期月经第3天, AFC是最好地预测卵巢低反应的指标, AFC<5与AFC>5者获卵数明显不同[7]。DOR患者IVF周期获得的胚胎非整倍体几率高,导致临床妊娠率低下,流产率高。
DHEA是合成雄激素并进一步转化为雌激素的前体物质,由肾上腺、中枢神经系统、卵巢卵泡膜细胞共同分泌[8-10]。DHEA及其硫酸盐(DHEAS)广泛分布于组织器官及循环系统中。随着年龄的增长, DHEA分泌减少,因此一般认为DHEA与人体衰老有关,可作为抗衰老药使用。目前美国FDA批准其作为保健食品使用。有不同作者[11-12]发现,给DOR患者服用DHEA后,患者获卵数增加,胚胎质量提高,周期取消率降低,妊娠率和胚胎移植率显著增高。DHEA是身体产生的天然激素,目前有研究表明,长期小剂量服用(<100 mg/d)未发现明显副作用。
DHEA改善DOR患者COH周期卵巢反应性的机制尚未明了。有研究认为,DHEA升高患者胰岛素样生长因子(IGF-1), 从而改善了卵泡的募集和发育[13-15]。也有研究[16,18-20]根据DHEA降低了胚胎非整倍体概率,降低流产率的表现,认为受损的卵泡不大可能被恢复, DHEA的作用更可能是通过复活卵泡周围老化的环境,从而为卵泡提供更好的发育、成熟场所而发挥作用。如果该假说得到确认,则将颠覆目前主流的卵巢老化即卵子老化、减少学说,并为DOR甚至卵巢早衰(POF)患者带来福音[21-22]。
本研究的临床观察结果证实DHEA 75 mg/d, 连服3个月,能显著改善DOR患者基础内分泌及AFC状态,并在随后的COH周期中表现出来;患者获卵数增加,卵泡质量升高;有更多的可移植胚胎数,且移植周期有不错的妊娠率,患者流产率降低,提示DHEA改善了胚胎质量。DHEA的效应值得临床进一步研究,以使其药品化,使更多DOR及POF患者受益。
[1] 陈士岭. 卵巢储备功能的评价[J]. 国际生殖健康/计划生育杂志, 2009, 28(5): 281.
[2] Kyrou D, Kolibianakis E M, Venetis C A, et al. How to improve the probability of pregnancy in poor responders undergoing in vitro fertilization: a systematic review and meta analysis[J]. Fertil Steril, 2009, 91(3): 749.
[3] 李敏, 俞炽阳, 李玉艳, 等. 体外受精-胚胎移植术后重度卵巢过度刺激综合征、双胎、胎儿畸形引产1例[J]. 第三军医大学学报, 2013, 35(25): 2609.
[4] 梁静, 孙维峰, 周建龙. 复方多囊调经汤治疗多囊卵巢综合征的机制研究[J]. 华南国防医学杂志, 2013, 27(6): 397.
[5] 莫爱萍. 抑制素A和抑制素B对卵巢早衰的诊断价值研究[J]. 海南医学院学报, 2011, 17(9): 1239.
[6] 李跃萍. 人类卵巢组织冻存与移植[J]. 海南医学院学报, 2011, 17(4): 574.
[7] 刘阳, 蔡霞. 卵巢储备功能与辅助生殖技术治疗结局[J]. 国际生殖健康/计划生育杂志, 2009, 28(5): 305.
[8] Burger H G. Androgen production in women[J]. Fertil Steril, 2002, 77(4): S3.
[9] Fusi F M, Ferrario M, Bosisio C, et al. DHEA supplementation positively affects spontaneous pregnancies in women with diminishedovarian function[J]. Gynecol Endocrinol, 2013, 29(10): 940.
[10] Narkwichean A, Maalouf W, Campbell B K, et al. Efficacy of dehydroepiandrosterone to improve ovarian response in women with diminishedovarian reserve: a meta-analysis[J]. Reprod Biol Endocrinol, 2013, 11: 44.
[11] Wiser A, Gonen O, Ghetler Y, et aI. Addition of dehydroepiandrosterone (DHEA) for poor responder patients before and during IVF treatment improves the pregnancy rate: a randomized prospective study[J]. Hum Reprod, 2010, 25(10): 2496.
[12] Gleicher N, Weghfer A, Bared D H. Dchydroepiandmstemne (DHEA) reduces embryo aneuploidy: Direct evidence from preimplantation genetic screening (PGS)[J]. Repmd BiolEndocrinol, 2010, 8: 140.
[13] Yilmaz N, Uygur D, Inal H, et al. Dehydroepiandrosterone supplementation improves predictive markers for diminished ovarianreserve: serum AMH, inhibin B and antral follicle count[J]. Eur J Obstet Gynecol Reprod Biol, 2013, 169(2): 257.
[14] Borman E, Check J H, Mitchell-Williams J, et al. No evidence to support the concept that low serum dehydroepiandrosterone (DHEA) sulfate (s) levels are associated with less oocyte production or lower pregnancy rates[J]. Clin Exp Obstet Gynecol, 2012, 39(4): 429.
[15] Kara M, Aydin T, Aran T, et al. Does dehydroepi and rosterone supplementation really affect IVF-ICSI outcome in women with poorovarian reserve[J]. Eur J Obstet Gynecol Reprod Biol, 2014, 173: 63.
[16] Gleicher N, Weghofer A, Barad D. The perpetually “young” oocyte: ovarian environments for follicular maturation age but not unrecruited, resting primordial follicles/oocytes[J]. Fertil Steril, 2010, 94(4): S139.
[17] Gleicher N, Barad D H. Dehydreepiandrosterune (DHEA) supplementation in diminished ovarian resewe(DOR)[J]. Reprod Biol Endocrinol, 2011, 9: 67.
[18] Hossein R B, Hormoz B, Shahrokh T E, et al. Testosterone and dehydroepiandrosterone sulphate levels and IVF/ICSI results[J]. GynecolEndocrinol, 2009, 25(3): 194.
[19] Yakin K, Urman B. DHEA as a miracle drug in the treatment of poor responders: hype or hope[J]. I Hum Repred, 201l, 26(8): 1941.
[20] Urman B, Yakin K. Does dehydroepiandrosterone have any benefit in fertility treatment[J]. Curr Opin Obstet Gynecol, 2012, 24(3): 132.
[21] Gleicher N, Weghofer A, Barad D H. Improvement in diminished ovarian reserve after dehydroepiandrosterone supplementation[J]. Reprod Biomed Online, 2010, 21(3): 360.
[22] Gleicher N, Ryan E, Weghofer A, et al. Miscarriage rates after dehydroepiandrosterone (DHEA) supplementation in women withdiminished ovarian reserve: a case control study[J]. Reprod Biol Endocrinol, 2009, 7: 108.

