进展期胃癌术后早期肠内营养对免疫功能和肠功能恢复的影响
刁红亮,佟箫兵,吴 鹏,代玉柱,魏 立
(新疆维吾尔自治区克拉玛依市中心医院 急救中心外科,新疆 克拉玛依,834000)
进展期胃癌患者常常伴有营养不良和免疫功能低下,围术期胃癌患者不能正常进食,加之出血、肿瘤消耗、禁食水及手术造成的创伤和应激又进一步加重营养不良,导致机体免疫力进一步下降,肠屏障结构和功能受损[1]。围术期营养被认为可以降低术后并发症的发病率。本研究探讨进展期胃癌患者术后的营养支持方式,现将结果报告如下。
1 资料与方法
1.1 一般资料
选择本科2009年1月—2011年12收治的行胃癌根治性手术的进展期胃癌患者44例。纳入标准: ① 术前均经胃镜、病理、上消化道钡餐、CT、核磁共振等检查确诊进展期胃癌; ② 行根治性胃癌手术者。排除标准: ① 早期胃癌或晚期胃癌; ② 合并有代谢性疾病; ③ 接受过化疗激素或免疫治疗者。将上述患者按入院顺序分为观察组(给予术后早期肠内营养)22例和对照组(给予全肠外营养)20例。观察组中男12例,女10例,年龄46~78岁,平均62.2岁;对照组中男11例,女9例,年龄40~80岁,平均61.8岁。2组患者年龄、性别、肿瘤分期、手术方式、手术时间比较无显著差异(P>0.05),具有可比性。
1.2 方法
观察组胃癌根治术完毕后,术中将华瑞公司生产的空肠营养管放置Treiz韧带下20 cm的空肠内,远端自腹壁戳孔提出腹外固定。术后第1天由营养管先试泵入0.9%的温氯化钠注射液250 mL,无不适后泵入肠内营养剂,制剂选用瑞素(华瑞公司生产),热量为102.5 KJ[24.5 kcal/(kg·d)],氮量为0.16 g/(kg·d)。瑞素1∶1稀释液由肠内营养管滴入,速度为40 mL/h。初始阶段热量与液体量不足,由预置的深静脉插管给予肠外营养补充,观察若患者无不适,逐渐过渡到完全肠内营养。待肠功能恢复后经口进少量流汁、半流汁饮食,增加口服量,逐渐过渡到完全由经口营养支持。
对照组术后行标准全肠外营养支持,热量与肠内营养组基本相同,水溶性维生素用水乐维他,脂溶性维生素用维他利匹特,微量元素用安达美(以上均由华瑞公司生产)。胰岛素及葡萄糖常规按1∶5添加配成3 L袋,经外周静脉深静脉置管(PICC)或锁骨下静脉穿刺中心静脉输入。肠功能恢复后经口进少量流汁、半流汁饮食,增加口服量,逐渐过渡到完全由经口营养支持。
1.3 检测指标
分别于术前和术后第1、8天清晨空腹抽患者外周血,检测免疫球蛋白G、免疫球蛋白A值,用流式细胞仪测定T细胞亚群指标,包括CD4、CD8、CD4/CD8。肠鸣音恢复时间为手术结束时间至可闻及肠鸣音时间差值,患者肛门排气时间为手术结束时间至患者首次排气或排便时间差值。
2 结 果
2组患者术前免疫指标无显著差异(P>0.05)。术后第1天,2组患者免疫球蛋白G、免疫球蛋白A、CD4、CD8、CD4/CD8值均较术前1 d明显下降,差异有统计学意义(P<0.05)。观察组术后第8天免疫球蛋白G、免疫球蛋白A、CD4、CD8、CD4/CD8值均显著高于对照组,差异有统计学意义(P<0.05)。见表1。
观察组肠鸣音恢复时间和肛门排气时间分别为(51.5±8.2) h和(72.3±7.2) h,均显著短于对照组的(63.7±8.6) h和(82.5±7.5) h,差异有统计学意义(P<0.05)。观察组部分患者肠内营养开始时出现恶心、腹痛、腹泻等不适(17%),程度轻微,对症处理后症状消失,耐受性良好。对照组并发症为深静脉导管堵塞、感染、发热和血糖及电解质紊乱等,给予调整或重置深静脉导管,调整胰岛素比例和纠正电解质痊愈。2组患者治疗中未发生死亡或严重并发症,均痊愈出院。
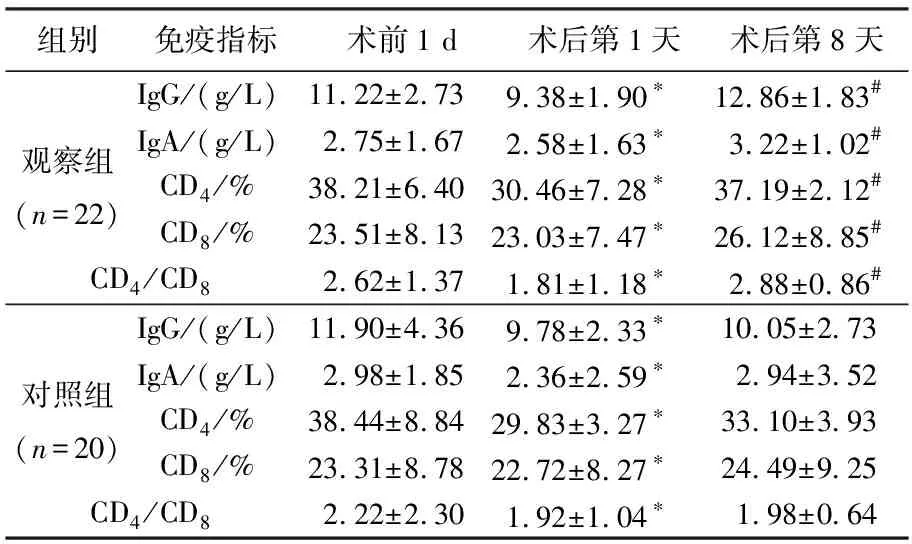
表1 2组免疫指标变化比较
3 讨 论
进展期胃癌患者由于肿瘤消耗、梗阻、出血、摄入不足以及精神压抑等原因,术前已经存在不同程度的营养不良和免疫功能受损,术后机体处于营养摄入不足和高分解代谢状态,免疫功能受损加重,肠功能恢复迟缓,影响患者的术后恢复和预后。
进展期胃癌中快速增长的肿瘤细胞对机体防御能力产生特异性或非特异性免疫抑制,常伴有免疫应答的减弱[2]。有研究[3]显示手术后机体免疫防御机制的损害迅速发生,术后常规的静脉营养支持,不足以满足和刺激机体的细胞免疫和体液免疫应答迅速恢复,不能逆转手术创伤所造成的分解代谢和免疫抑制状态。近年来越来越多的研究[4]表明,长期的PN可导致肠黏膜萎缩,肠道微生态紊乱,肠道功能异常,免疫系统损伤,而肠内营养有利于保持肠黏膜的结构和功能的完整性,从而维持肠黏膜的屏障功能[5]。有研究[6]表明,胃癌术后早期(24 h后),小肠巳恢复蠕动,此时若患者血流动力学稳定,并有适当的肠内输注途径时,早期肠内营养的实施是完全可行的。作者术后第1天由术中预置的空肠营养管给予肠内营养支持,结果显示经过7 d的肠内营养和肠外营养支持后,患者免疫球蛋白G、免疫球蛋白A、CD4、CD8、CD4/CD8值基本恢复到术前水平。观察组术后第8天免疫球蛋白G、免疫球蛋白A、CD4、CD8、CD4/CD8值均显著高于对照组,差异有统计学意义(P<0.05)。说明术后通过早期肠内营养和肠外营养,机体的免疫功能均得到不同程度的恢复,但早期肠内营养改善机体的免疫功能效果更明显。
本研究结果还显示,通过术中放置的空肠营养管,术后早期肠内营养支持可以促进术后肠功能的早期恢复。观察组患者术后肛门恢复排气、排便时间较对照组明显缩短,究其原因为: ① 早期肠内营养保护了肠道的屏障功能,能够减少胆汁流失,肠内营养含有静脉营养没有的纤维素,能刺激肠蠕动,还能刺激结肠中水、电解质的重吸收,促进肠功能恢复[7]; ② 胃癌手术后早期给予肠内营养,可以保护肠黏膜的结构和功能,刺激胃肠激素分泌,降低高分解代谢,提高机体免疫功能[8]。
[1]Correia M I,Aiaffa W T,Da Silva A L,et al,Risk factor of malnutrition in patients undergoing gastroenterological andhernia surgeryl an analysis of 374 patients[J].Nutr Hosp,2001,16: 59.
[2]S.H.Choi,Eun Joo Chung,Dae Yong Whang,et al.Alteration of signal-transducing molecules in tumor-infiltrating lymphocytes and peripheral blood T lymphocytes from human colorectal carcinoma patients[J].CancerImmunology,1998,45(6): 299.
[3]Brags M,Gianotti L,Vignali A,et a1.Immunonutrition in gastric cancer surgical patients[J].Nutrition,1998,14(11/12): 831.
[4]Hermsen JL,Sano Y,Kudsk KA.Food fight! Parenteral nutrition,enteral stimulation and gut-derived mucosal immunity [J].Langenbecks Arch Surg,2009,394(1): 17.
[5]D.Radrizzani,G.Bertolini,R.Facchini,et al.Early enteral immunonutrition vs.parenteral nutrition in critically ill patients without severe sepsis: arandomized clinical trial[J],Intensive Care Medicine,2006,32(8):1191.
[6]秦环龙,吴肇汉.肠内营养在外科临床中的应用[J].肠外营养与肠内营养,2000,7(2): 119.
[7]吴河水.肝功能不良的病人手术后早期肠道内营养疗效及安全性研究[J].中国实用外科杂志,2000,20(1): 51.
[8]Heslin M J,Latkany L,Leung D,et al.A prospective randomized trial of early feeding after resection of upper gastrointestinal malignancy[J].Ann Surg,1997,226(4): 567.

