TLR4与NF-κB蛋白在非小细胞肺癌组织中的表达及临床意义
高胜利,徐亮亮,庞作良
(新疆医科大学附属肿瘤医院 胸外科,新疆 乌鲁木齐,830011)
目前,肺癌已成为全世界发病率和死亡率最高的恶性肿瘤,而肺部的不正常炎性过程可能与肺癌的发生及发展具有一定相关性。Toll样受体4(TLR4)是与炎症、肿瘤关系最为密切的TLR家族成员之一,也是参与非特异性免疫(天然免疫)的一类重要蛋白质分子,是连接非特异性免疫和特异性免疫的桥梁[1]。TLR为单个高度保守Ⅰ型跨膜非催化性蛋白质,当微生物突破机体皮肤、黏膜等物理屏障时,其可识别微生物本身所具有的保守性微结构,并激活机体产生免疫细胞应答。TLR诱导炎症反应和肿瘤主要是通过MyD88的依赖性途径及核因子κB信号途径来启动细胞活化进程,调控树突状细胞(DC)的成熟和免疫正向调节分子的表达[2]。由于肿瘤在发生发展过程中可产生一些能被TLR识别的内源性配体,因此TLR在肿瘤免疫监视中可能发挥了一定作用。
核因子-κB(NF-κB)是具有多向性调节作用的核转录因子,可调控多种基因(免疫、炎症反应、病毒和原癌基因)的转录表达。而激活的NF-κB参与癌症的启动、发生及发展过程,在炎症性相关肿瘤的发生发展中呈高表达,且在炎症与癌变间起桥梁作用[3]。本研究采用免疫组化SP法分析非小细胞肺癌(NSCLC)组织中TLR4与NF-κB蛋白水平的表达,并探讨其在NSCLC发生发展过程中的可能机制及与NSCLC临床病理特征的关系。
1 资料与方法
1.1 一般资料
收集2007年1月—2010年12月在本院行完全性手术切除并经病理证实的NSCLC标本58例,所有患者术前均未接受放疗或化疗,癌旁组织距离癌组织边缘5 cm以上,且病理证实为正常肺组织。其中男47例,女11例;年龄45~76岁,中位年龄66.5岁;吸烟指数>400支/年36例,<400支/年22例;淋巴结转移42例,无淋巴结转移16例。术后病理分期按2007年世界卫生组织(WHO)国际抗癌联盟制定的肺癌TNM分期标准,并参考《外科诊断病理学》进行命名及分类,其中腺癌31例,鳞癌26例,腺鳞癌1例;高分化癌15例,中分化癌31例,低分化癌和未分化癌12例。根据2009年国际肺癌研究学会(IASLC)第7版肺癌TNM分期标准: Ⅰ期15例,Ⅱ期22例,Ⅲ期21例。
1.2 方法
1.2.1 主要试剂:兔抗人TLR4多克隆抗体购自上海研卉生物科技有限公司,兔抗人NF-κB多克隆抗体购自天津津脉公司,SP免疫组化试剂盒购自北京中杉公司。
1.2.2 试验方法:采用免疫组化SP法,染色程序严格按试剂盒说明书进行操作。用已知TLR4和NF-κB阳性切片作阳性对照,用磷酸盐缓冲液(PBS)代替一抗作空白对照。经DAB显色、复染、脱水,中性树胶封片后编号,常规脱蜡、水化的组织切片按WHO诊断标准由病理科同一组医师进行诊断和病理分级。
1.3 评定标准
TLR4在NSCLC癌组织和癌旁组织中均以细胞质和(或)细胞膜呈棕黄色或棕褐色为阳性。NF-κB在NSCLC癌组织和癌旁组织中的表达主要表现为胞浆或细胞核中有棕褐色或棕黄色颗粒沉淀。染色强度分为(-)级:着色区内无棕黄色颗粒或呈均匀一致淡黄色,与背景一致; (+)级:着色区内可见少量淡黄色颗粒,明显高于背景或细胞质内,可见较多深棕色颗粒; (2+)级:着色区内可见大量深棕色颗粒。
2 结 果
2.1 NSCLC组织和癌旁组织中TLR4及NF-κB蛋白表达
TLR4和NF-κB蛋白在NSCLC组织中的阳性表达率(60.3%和67.2%)明显高于癌旁正常肺组织中的阳性表达率(15.5%和8.6%),差异有统计学意义(P<0.01),见表1。

表1 TLR4和NF-κB蛋白在NSCLC组织和癌旁正常肺组织中的表达[n(%)]
2.2 NSCLC组织中TLR4和NF-κB蛋白表达与临床病理特征之间的关系
在NSCLC低、中、高分化组织中TLR4蛋白阳性表达率分别为83.3%、67.7%和26.7%,两两比较差异均有统计学意义(P<0.01)。NSCLC不同组织学类型中NF-κB蛋白阳性表达率比较差异有统计学意义(P<0.05),且在腺癌中的阳性率(80.6%)明显高于鳞癌(51.9%)。见表2、图1。
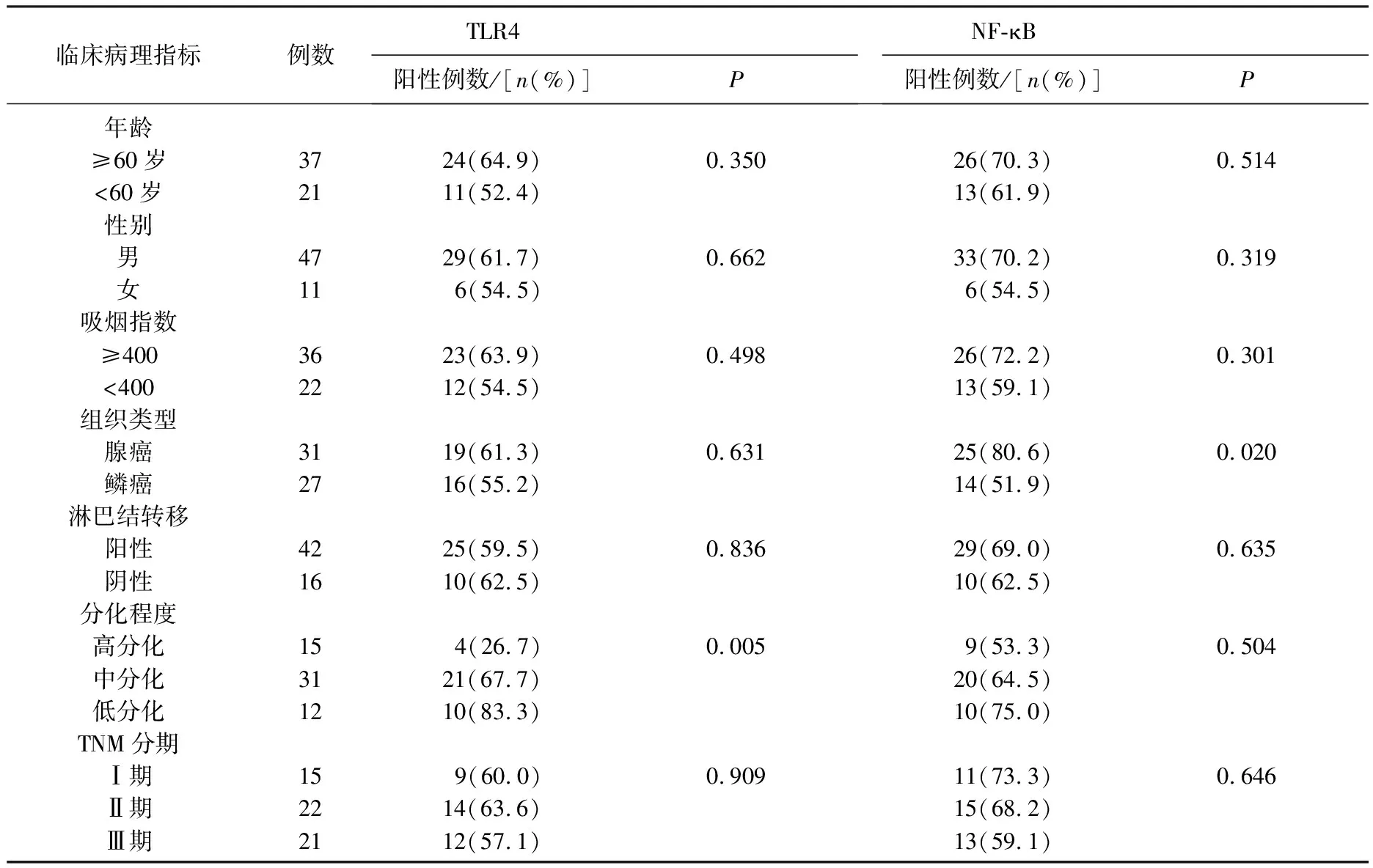
表2 NSCLC组织中TLR4和NF-κB蛋白表达与临床病理特征的关系
图1 NF-κB蛋白在NSCLC组织中的表达 400倍
2.3 NSCLC组织中TLR4和NF-κB蛋白表达相关性分析
39例NF-κB表达阳性的NSCLC标本中有30例TLR4表达阳性。TLR4与NF-κB的相关系数r=0.486,提示NSCLC组织中TLR4与NF-κB蛋白表达密切相关,见表3。
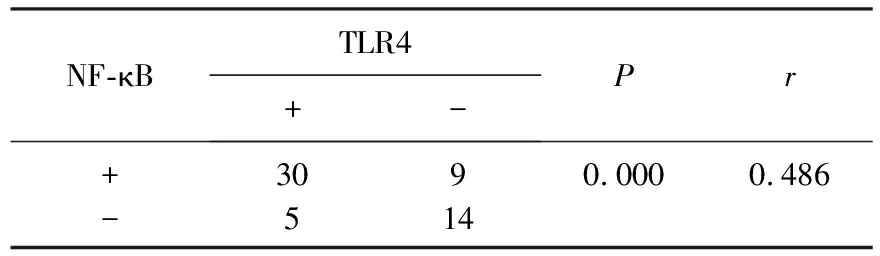
表3 NSCLC组织中TLR4和NF-κB蛋白表达相关性分析
3 讨 论
Medzhitov等[4]于1997年首次证明人类细胞表面存在TLR蛋白。目前,TLR4广泛存在于人类细胞表面,且在多种免疫细胞表面表达。有证明[5]研究,TLR4蛋白在多种肿瘤细胞表面表达。病原体的某些特异性成分与周围分布的炎症细胞(包括巨噬细胞、树突状细胞、中性粒细胞等)表面特异性模式识别受体相结合而发挥作用,即所谓的病原体相关分子模式(PAMPs),通过产生大量细胞因子,可分泌炎症因子,引起微环境改变,从而促使肿瘤发生和发展。
研究[6-8]发现,TLR4诱导的信号通路在肿瘤形成过程中具有重要作用,并与多种恶性肿瘤的发生、发展密切相关。Inoue等[9]研究证实,机体在受到外来细菌或病毒感染时,TLRs开启NF-κB信号通路,促使细胞因子产生,组建成肿瘤生长所需要的微环境,进一步促使肿瘤启动、繁殖。Chen等[10]也证明,TLR4作为一个信号通路启动子,能激活NF-κB,刺激产生促炎症反应环境的形成,从而导致肿瘤生长和对化疗药物的耐药性。Takahashi等[11]证实,因长期肺组织损伤而诱发的炎症可促进肺癌的发生,提示应用抗感染治疗可预防或减缓肺癌的发病进程。可见,与炎症相关的肺癌可能发病机制之一为肿瘤微环境中炎症免疫被削弱和肿瘤免疫逃逸[12-13]。Fu等研究[14]发现,NSCLC中TLR4表达明显升高,与正常肺组织相比,TLR4表达与肿瘤分化程度密切相关。本研究结果显示,TLR4和NF-κB在NSCLC组织中的阳性表达率分别为60.3%和67.2%,显著高于癌旁正常肺组织(15.5%和8.6%),提示NSCLC组织中通过TLR4信号转导过程的异常表达而引起NF-κB表达增高,可能在NSCLC肿瘤逃逸和进展中发挥作用。此外,在NSCLC低、中、高分化组织中TLR4蛋白阳性表达率分别为83.3%、67.7%和26.7%,两两比较差异有统计学意义,提示TLR4蛋白表达越高,NSCLC分化程度越低,TLR4表达增强者,癌组织分化程度越差,恶性程度越高,这与何凤莲等[15]结果一致。
Bltimore于1986年发现核转录因子NF-κB,其存在于细胞核内。研究[16]表明,被活化的NF-κB进入细胞核内,而其充当转录因子的作用是通过含κB序列结合位点且与多种基因启动子区结合而发挥作用,多种决定细胞分化或凋亡的细胞因子被活化并发生基因转录,从而调控细胞生长,调节多种黏附、侵袭转移相关因子的转录而参与肿瘤侵袭转移。本研究结果显示,NSCLC组织中TLR4蛋白表达与NF-κB蛋白表达密切相关,说明通过TLR4激活NF-κB信号通路机制可能在NSCLC的发生发展过程中起重要作用。此外,NF-κB在腺癌中的表达明显高于鳞癌,提示NF-κB表达的高低对判定肿瘤的病理类型具有一定价值。
总之,NSCLC组织中TLR4和NF-κB蛋白表达异常增高,明显上调,且两者表达具有明显相关性,提示通过TLR4/NF-κB信号通路可能诱导细胞因子产生,从而使肺癌细胞逃避免疫监视,促进肿瘤细胞增长。
[1]Garlanda C,Riva F,Bonavita E,et al.Decoys and Regulatory “Receptors” of the IL-1/Toll-Like Receptor Superfamily[J].Front Immunol,2013,9(4): 180.
[2]Zhang Y B,He F L,Fang M,et al.Increased expression of Toll like receptors 4 and 9 in human lung cancer[J].MolBiol Rep,2009,36(6): 1475.
[3]Sfikas A,Batsi C,Tselikou E,et al.The canonical NF-κB pathway differentially protects normal and human tumor cells from ROS-induced DNA damage[J].Cell Signal,2012,24(11): 2007.
[4]Medzhitov R,Preston-Hurlburt P,Janeway C A Jr.A human homologue of the Drosophila Toll protein signals activation of adaptive immunity[J].Nature,1997,388( 6640): 394.
[5]Huang B,Zhao J,Li H,et al.Toll-like receptors on tumor cells facilitate evasion of immune surveillance[J].Cancer Res,2005,65(12): 5009.
[6]Schmausser B,Andrulis M,Endrich S,et al.Toll-like receptors TLR4,TLR5 and TLR9 on gastric carcinoma cells: an implication for interaction with Helicobacter pylori[J].Med Microbiol,2005,295(3): 179.
[7]Coussens L M,Werb Z.Inflammation and cancer[J].Nature,2002,420(6917): 860.
[8]李响,龚志勇,李虹,等.卡介苗诱导膀胱癌T24细胞表达钟声蛋白样受体和产生细胞因子的研究[J].中华外科杂志,2004,42(3): 177.
[9]Inoue J,Gohda J,Akiyama T,et al.NF-κB activation in development and progression of cancer[J].Cancer Sci,2007,98(3): 268.
[10]Chen R,Alvero A B,Silasi D A,et al.Inflammation,cancer and chemoresistance: taking advantage of the toll-like receptor signaling pathway[J].Am J Reprod Immunol,2007,57(2): 93.
[11]Takahashi H,Ogata H,Nishigaki R,et al.Tobacco Smoke Promotes Lung Tumorigenesis by Triggering IKKβ- and JNK1-Dependent Inflammation[J].Cancer Cell,2010,17(1): 89.
[12]Kusmartsev S,Gabrilovich D I.Immature myeloid cells and cancer-associated immune suppression[J].Cancer Immunol Immunother,2002,51(6): 293.
[13]Vakkila J,Lotze M T.Inflammation and necrosis promote tumour growth[J].Nat Rev Immunol,2004,4(8): 64.
[14]Fu H Y,Li C,Yang W.FOXP3 and TLR4 protein expression are correlated in non-small cell lung cancer: implications for tumor progression and escape[J].Acta Histochem,2013,115(2): 151.
[15]何凤莲,张志红,张妍蓓,等.TLR4与TLR9在非小细胞肺癌组织中的表达及临床意义[J].肿瘤,2006,26(12): 1098.
[16]Nagai S,Washiyama K,Kwrimoto M,et al.Aberrant nuclear factor -kappa B activity and its participation in the growth of human malignant astrocytoma[J].J Neurosurg,2002,96(5): 909.

