血管紧张素Ⅱ对小鼠骨髓间充质干细胞中ERK1/2和NF-κB信号途径介导的炎症反应的影响*
武俊芳,牛 杰,李晓鹏,张芬熙,范文艳,李颖虹,郭志刚
1)新乡医学院形态学实验室 新乡 453003 2)新乡医学院第三附属医院眼科 新乡 453003 3)新乡医学院三全学院解剖学教研室 新乡 453003 4) 新乡医学院干细胞与生物治疗研究中心 新乡 453003
血管紧张素Ⅱ对小鼠骨髓间充质干细胞中ERK1/2和NF-κB信号途径介导的炎症反应的影响*
武俊芳1),牛 杰1),李晓鹏2),张芬熙3,4)#,范文艳1),李颖虹1),郭志刚1)
1)新乡医学院形态学实验室 新乡 453003 2)新乡医学院第三附属医院眼科 新乡 453003 3)新乡医学院三全学院解剖学教研室 新乡 453003 4) 新乡医学院干细胞与生物治疗研究中心 新乡 453003
#通讯作者,女,1978年8月生,硕士,讲师,研究方向:干细胞,E-mail:fxzhang0824@gmail.com
血管紧张素Ⅱ;骨髓间充质干细胞;ERK1/2;NF-κB;炎症反应;小鼠
目的:研究血管紧张素Ⅱ(Ang Ⅱ)对小鼠骨髓间充质干细胞(bmMSC)炎症反应的影响。方法分别采用0、10-8、10-7、10-6和10-5mol/L Ang Ⅱ体外诱导培养bmMSC 12 h,然后应用ELISA法检测细胞TNF-α和IL-6的分泌水平,RT-PCR法检测细胞TNF-α和IL-6 mRNA的表达水平, Western blot法检测细胞中ERK1/2和NF-κB-P65蛋白磷酸化程度。结果5组bmMSC TNF-α和IL-6分泌水平、mRNA表达水平,ERK1、ERK2和NF-κB-P65蛋白磷酸化程度差异均有统计学意义(F=34.562、53.940、24.622、30.208、96.129、106.293和24.752,P<0.001)。与0 mol/L Ang Ⅱ组比较,10-8、10-7、10-6和10-5mol/L Ang Ⅱ组细胞TNF-α和IL-6分泌水平升高(P<0.05),TNF-α和IL-6 mRNA表达水平升高(P<0.05),ERK1/2和NF-κB-P65磷酸化程度升高(P<0.05),并且表现出一定的剂量依赖性(P<0.05)。结论Ang Ⅱ可通过活化ERK1/2和NF-κB信号途径介导bmMSC的炎症反应。
骨髓间充质干细胞(bone marrow mesenchymal stem cell, bmMSC)是一类具有多向分化潜能的成体干细胞,在特定的环境下可向脂肪、成骨、软骨、心肌和神经等多种功能细胞分化[1]。相关实验[2-4]已经证明,bmMSC在体内外特定环境下均可向心肌细胞分化;bmMSC移植可改善心肌缺血再灌注后心脏的功能,减少瘢痕面积。通常,在移植前bmMSC须经生物或化学诱导剂诱导培养后才能确保有一定数量的细胞向心肌细胞分化,如血管紧张素Ⅱ(angiotensin Ⅱ, Ang Ⅱ)和5-氮杂胞嘧啶核苷(5-AZA)等[5-6],其中AngⅡ为常用诱导剂之一。但是,AngⅡ是肾素-血管紧张素-醛固酮系统(RAS)重要的功能性成分,可通过激活其特异性受体1(AT1R)和2(AT2R)活化RAS,在一系列生理和病理过程中发挥重要作用[5]。体内和体外实验均证实AngⅡ可诱发炎症反应[7]。Ang Ⅱ可增强NADPH氧化酶的活性,提高细胞内活性氧的含量,而活性氧可介导内皮细胞和心肌成纤维细胞等多种细胞的炎症反应[7-8]。因此,AngⅡ对bmMSC的致炎反应值得关注。作者观察了不同剂量Ang Ⅱ作用下小鼠bmMSC的炎症反应情况,并对相关机制进行了探讨。
1 材料与方法
1.1主要试剂和仪器总蛋白提取试剂盒购于普莱基因技术(北京)有限公司。Ang Ⅱ和2×PCR反应液购于美国Sigma公司。TNF-α和IL-6 ELISA检测试剂盒购于美国R&D公司。DNase Ⅰ试剂盒、RNase试剂盒、SuperScript Ⅱ试剂盒和ProlongH Gold抗荧光淬灭剂购于美国Invitrogen公司。兔抗小鼠磷酸化ERK1/2(p-ERK1/2)、ERK1/2、p-NF-κB-P65(p-P65)和NF-κB-P65(P65)一抗购于美国Cell Signaling公司。辣根过氧化物酶(HRP)标记的山羊抗兔二抗、FITC-CD90和PE-CD44等抗体均购于美国Abcam公司。SDS-PAGE凝胶试剂盒和PVDF购于郑州宝生物科技有限公司。
1.2小鼠bmMSC的分离、培养及鉴定小鼠bmMSC的分离培养参考文献[9]进行。采用常规免疫荧光染色技术检测间充质干细胞特异性标记分子CD44和CD90的表达,染色时PE-CD44抗体和FITC-CD90抗体用胎牛血清稀释200倍,用含DAPI的ProlongH Gold抗荧光淬灭剂封片,荧光显微镜下观察。
1.3实验分组收集第3代bmMSC接种到12孔板(5×105个/孔)中常规培养12 h,再分别用含0、10-8、10-7、10-6和10-5mol/L Ang Ⅱ的培养基再培养12 h,然后进行相关指标的测定。 每组4个复孔。
1.4测定指标
1.4.1 bmMSC TNF-α和IL-6的分泌水平 收集各组细胞培养基,采用TNF-α和IL-6 ELISA检测试剂盒检测培养基中TNF-α和IL-6水平,具体操作按试剂盒说明进行。
1.4.2 bmMSC TNF-α和IL-6 mRNA的表达水平 收集各组细胞,应用RNase试剂盒提取总RNA,应用DNase Ⅰ试剂盒处理总RNA 10 min以消除DNA污染;应用SuperScript Ⅱ试剂盒对RNA进行反转录得cDNA,具体操作按各试剂盒说明进行。以cDNA为模板进行常规PCR。TNF-α引物序列:上游5’-CCGATGGGTTGTACCTTGTC-3’,下游5’-GGGCTGGGTAGAGAATGGAT-3’。 IL-6引物序列:上游5’-GAT GCTACCAAACTGGATATAATC-3’,下游5’-GGTCCT TAGCCACTCCTTCTGTG-3’。 内参β-actin引物序列:上游5’-TTCTTTGCAGCTCCTTCGTTGCCG-3’,下游5’-TGGATGGCTACGTACATGGCTGGG-3’。反应体系20 μL,包括2×PCR反应液10 μL,引物各0.3 μmol/L。反应条件:94 ℃ 5 min;94 ℃ 30 s, 52 ℃ 30 s,72 ℃(TNF-α)或48 ℃(IL-6)或52 ℃(β-actin)30 s,34或37或32个循环;72 ℃延伸5 min;产物于4 ℃保存。产物经15 g/L琼脂糖凝胶电泳分离,EB染色,用Bio-Rad凝胶成像仪(上海伯乐生命仪器公司)紫外光下记录图像,用Image J 图像分析系统分析,计算各产物条带的灰度值,以目的条带与图像背景灰度值之差表示目的条带的绝对表达水平,以目的条带与内参β-actin绝对表达水平之比表示目的基因mRNA的相对表达水平。
1.4.3 bmMSC ERK1/2和P65蛋白的磷酸化程度收集各组细胞,提取总蛋白,经12 g/L SDS-PAGE凝胶电泳分离,将蛋白转到PVDF膜上,用体积分数5%胎牛血清室温下封闭1 h,分别加入兔抗小鼠p-ERK1/2、ERK1/2、p-P65和P65一抗(均用TBST缓冲液稀释1 000倍),4 ℃摇床上过夜孵育,TBST缓冲液洗膜3次后加入HRP标记的山羊抗兔二抗(用TBST缓冲液稀释10 000倍),室温摇床上孵育1 h,再用TBST缓冲液洗膜3次。ECL发光液发光并曝光底物。在Bio-Rad凝胶成像仪普通光源下记录图像,图像处理同1.4.2。以磷酸化与非磷酸化蛋白表达水平的比值表示蛋白的磷酸化程度。
1.5统计学处理采用SPSS 11.5进行分析,应用单因素方差分析比较5组细胞TNF-α和IL-6的分泌水平和mRNA表达水平,以及ERK1/2、P65蛋白磷酸化程度,检验水准α=0.05。
2 结果
2.1bmMSC的鉴定第3代分离所得的细胞呈典型的梭形或长梭形成纤维细胞形态,免疫荧光染色显示细胞表达CD44和CD90(图1),提示分离所得的细胞为bmMSC。
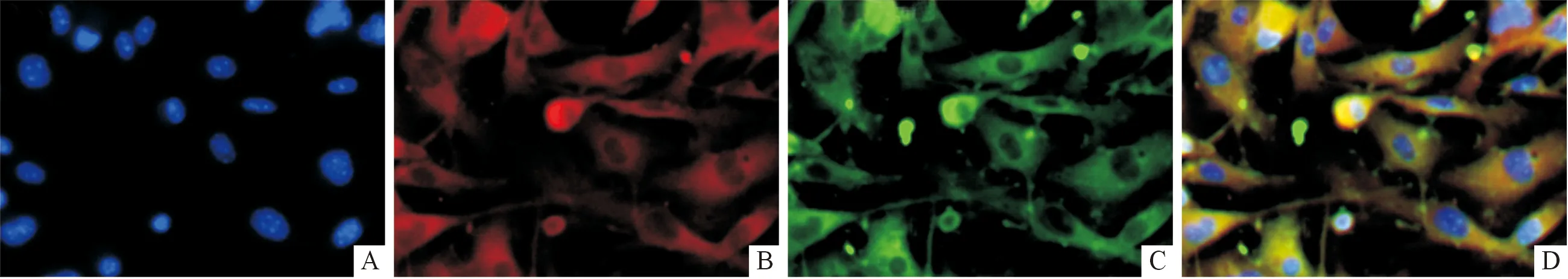
图1 小鼠bmMSC的鉴定
2.2 5组细胞TNF-α和IL-6分泌水平和mRNA表达水平的比较见表1、图2和表2。与0 mol/L AngⅡ组比较,其他剂量AngⅡ组bmMSC的TNF-α和IL-6分泌水平和mRNA表达水平均显著增加,且具有一定的剂量效应。
表1 5组细胞TNF-α和IL-6分泌水平的比较ng/L

组别nρ(TNF⁃α)ρ(IL⁃6)0mol/LAngⅡ组41425.823±110.014188.743±27.05910-8mol/LAngⅡ组41713.563±158.954257.633±46.26610-7mol/LAngⅡ组42115.373±363.179346.832±44.76110-6mol/LAngⅡ组42774.055±284.732622.865±76.59610-5mol/LAngⅡ组43472.180±382.332806.750±120.636F34.56253.940P<0.001<0.001
每个指标5组间两两比较,P均<0.05。
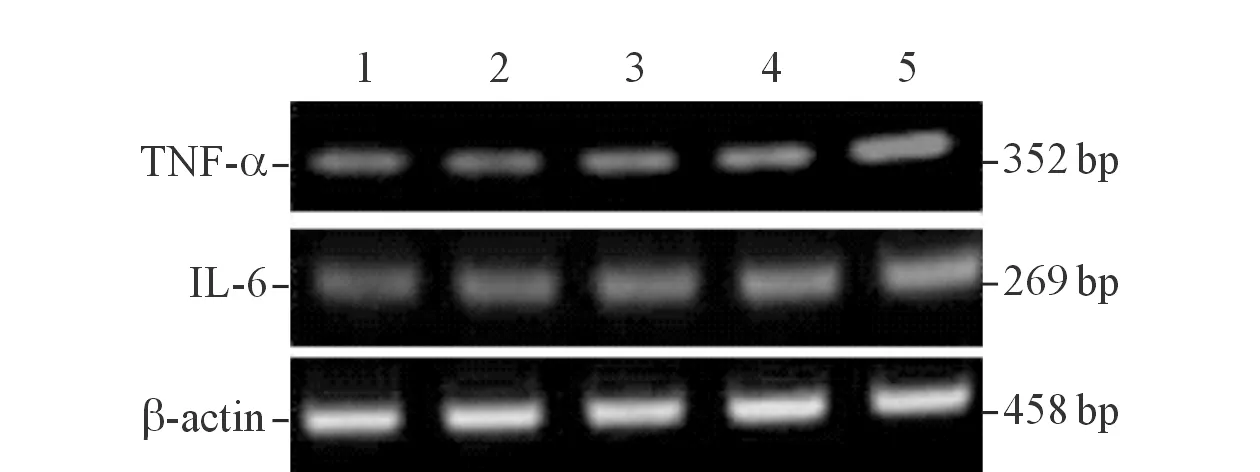
图2 RT-PCR结果
1:0 mol/L AngⅡ组;2:10-8mol/L AngⅡ组;3:10-7mol/L AngⅡ组;4:10-6mol/L AngⅡ组;5:10-5mol/L AngⅡ组。

表2 5组细胞TNF-α和IL-6 mRNA表达水平的比较 %
每个指标5组间两两比较,P均<0.05。
2.3 5组细胞ERK1/2和P65蛋白磷酸化程度的比较Western blot检测结果见图3和表3。可以看出, Ang Ⅱ处理后bmMSC中ERK1/2和P65蛋白磷酸化程度均显著增高,且具有一定的剂量效应。

图3 Western blot结果
1:0 mol/L AngⅡ组;2:10-8mol/L AngⅡ组;3:10-7mol/L AngⅡ组;4:10-6mol/L AngⅡ组;5:10-5mol/L AngⅡ组。
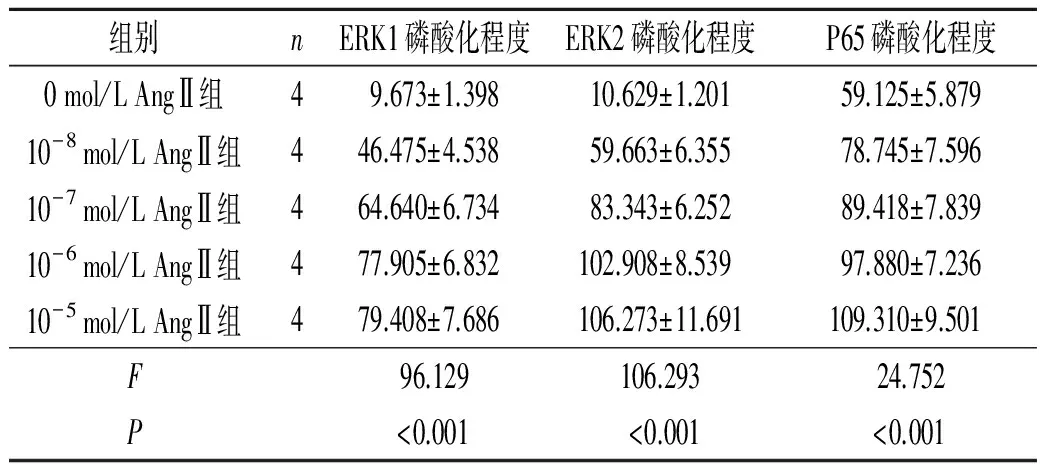
表3 5组细胞ERK1/2和P65蛋白磷酸化程度的比较
每个指标5组间两两比较,P均<0.05。
3 讨论
间充质干细胞移植是目前临床治疗心肌梗死的重要手段之一。相关动物实验研究[3]显示,bmMSC移植可增强心肌梗死后小鼠心脏收缩功能,提高组织供血量,减轻心肌组织的纤维化。以往研究[5-6,10]显示,经某些生物或化学诱导剂(如AngⅡ、5-AZA和转化生长因子-β等)诱导培养后,bmMSC向心肌细胞转化的效率可大大提高。其中,Ang Ⅱ为常用诱导剂之一,其可单独应用,也可与其他诱导剂(如5-AZA)联合应用诱导bmMSC向心肌细胞的分化[5,11]。但AngⅡ可在多种组织和细胞中诱发炎症反应[7,12]。该研究作者也发现AngⅡ确实可诱发bmMSC的炎症反应,表现为炎症因子TNF-α和IL-6分泌水平和mRNA表达水平均明显升高。而炎症反应是影响间充质干细胞移植疗效的重要因素,炎症反应将降低间充质干细胞在宿主体内的存活率[13]。因此,在应用Ang Ⅱ诱导bmMSC向心肌细胞分化的过程中,其致炎作用应引起重视。
ERK1/2是细胞内重要的信号转导系统, 其在生长、发育、分裂、分化和凋亡等多种细胞功能中发挥重要作用[14]。已有研究[14]显示,ERK信号活化可促进多种炎症细胞因子(包括MCP-1、TNF-α、IL-6、IL-8等)的表达。NF-κB为一个核转录因子家族,包括多个亚单位(如P65和P50等),其通过磷酸化而获得活化,进一步参与炎症反应的调节[15]。此外,NF-κB也是ERK1信号途径下游的分子,其活性受ERK1/2的调控;ERK1/2的活化可通过进一步激活NF-κB而促进炎症反应的发生。该研究中,作者观察到Ang Ⅱ诱导的小鼠bmMSC炎症反应与ERK1/2和NF-κB信号途径的活化有一定关系。
总之,该研究显示AngⅡ可诱发小鼠bmMSC产生炎症反应,这与ERK1/2和NF-κB信号途径活化有关。在Ang Ⅱ单独应用或与其他诱导剂联合应用诱导小鼠bmMSC向心肌细胞分化过程中,应当注意其致炎作用。
[1]Rostovskaya M,Anastassiadis K.Differential expression of surface markers in mouse bone marrow mesenchymal stromal cell subpopulations with distinct lineage commitment[J].PLoS One,2012,7(12):e51221
[2]贾敏,曾秋棠,王永奎,等.骨髓间质干细胞分离培养及向心肌细胞的转化[J].郑州大学学报:医学版,2006,41(1):119
[3]郝崇伟,杨云华,李双杰.骨髓间充质干细胞移植改善心功能机制的研究进展[J].中国心血管病研究杂志,2007,5(11):845
[4]陈沅.骨髓间充质干细胞分化为心肌细胞的分子机制及其微环境[J].实用儿科临床杂志,2008,23(1):4
[5]Xing Y,Lv A,Wang L,et al.The combination of angiotensin Ⅱ and 5-azacytidine promotes cardiomyocyte differentiation of rat bone marrow mesenchymal stem cells[J].Mol Cell Biochem,2012,360(1/2):279
[6]Li TS,Komota T,Ohshima M,et al.TGF-beta induces the differentiation of bone marrow stem cells into immature cardiomyocytes[J].Biochem Biophys Res Commun,2008,366(4):1074
[7]Wang X,Phillips MI,Mehta JL.LOX-1 and angiotensin receptors, and their interplay[J].Cardiovasc Drugs Ther,2011,25(5):401
[8]黄文新,谭宁,林化,等.NADPH氧化酶2在AngⅡ促进高血压炎症因子IL-1β分泌中的意义[J].山东医药,2010,50(44):53
[9]Zhang F,Wang C,Wang H,et al.Ox-LDL promotes migration and adhesion of bone marrow-derived mesenchymal stem cells via regulation of MCP-1 expression[J].Mediators Inflamm,2013,2013:691023
[10]吕洋,王海萍,刘博,等.转化生长因子β1诱导骨髓间充质干细胞分化为心肌样细胞的作用[J].解剖学报,2013,44(1):49
[11]Liu BW,Lü AL,Hou J,et al.Electrophysiological characteristics of cardiomyocyte-like cells from rat bone marrow derived mesenchymal stem cells by four inducers[J].Chin Med J (Engl),2013,126(18):3528
[12]Wang X,Khaidakov M,Ding Z,et al.Cross-talk between inflammation and angiotensin Ⅱ: studies based on direct transfection of cardiomyocytes with AT1R and AT2R cDNA[J].Exp Biol Med (Maywood),2012,237(12):1394
[13]Coyne TM,Marcus AJ,Woodbury D,et al.Marrow stromal cells transplanted to the adult brain are rejected by an inflammatory response and transfer donor labels to host neurons and glia[J].Stem Cells,2006,24(11):2483
[14]姜勇,龚小卫.MAPK信号转导通路对炎症反应的调控[J].生理学报,2000,52(4):267
[15]王文举,李鸿钧,孙茂盛.NF-κB与持久炎症及肿瘤发生关系[J].生命的化学,2007,27(3):197
(2013-11-07收稿 责任编辑王 曼)
Effect of angiotensin Ⅱ on inflammatory responses of mouse bone marrow mesenchymal stem cell mediated by ERK1/2 and NF-κB pathways
WUJunfang1),NIUJie1),LIXiaopeng2),ZHANGFenxi3,4),FANWenyan1),LIYinghong1),GUOZhigang1)
1)LaboratoryofMorphology,XinxiangMedicalUniversity,Xinxiang453003 2)DepartmentofOphthalmology,theThirdAffiliatedHospital,XinxiangMedicalUniversity,Xinxiang453003 3)DepartmentofAnatomy,SanquanCollege,XinxiangMedicalUniversity,Xinxiang453003 4)StemCellandBiotheraphyTechnologyResearchCenter,XinxiangMedicalUniversity,Xinxiang453003
angiotensin Ⅱ;bone marrow mesenchymal stem cell;ERK1/2;NF-κB;inflammatory response;mouse
Aim: To study the effect of angiotensin Ⅱ(Ang Ⅱ) on inflammatory responses of mouse bone marrow mesenchymal stem cell(bmMSC). Methods: bmMSCs were treated with 0,10-8,10-7,10-6and 10-5mol/L Ang Ⅱ in vitro for 12 h. The secretion levels of TNF-α and IL-6 of these cells were measured using ELISA method. The expressions of TNF-α and IL-6 mRNA were measured by RT-PCR. The phosphorylated degree of ERK1/2 and NF-κB-P65 protein were measured by Western blot. Results: The differences in TNF-α and IL-6 secretion levels, TNF-α and IL-6 mRNA expressions, and the phosphorylated degree of ERK1/2 and NF-κB-P65 protein were significant among the five groups(F=34.562,53.940,24.622,30.208,96.129,106.293 and 24.752,P<0.001).Compared with those of the 0 mol/L Ang Ⅱ group, the secretion levels and mRNA expression of TNF-α and IL-6, and the phosphorylated degree of ERK1/2, NF-κB-P65 protein increased with the concentration of Ang Ⅱ increasing(P<0.05). Conclusion: Ang Ⅱ could mediate inflammatory responses in bmMSCs via activation of ERK1/2 and NF-κB pathways.
10.13705/j.issn.1671-6825.2014.04.006
*河南省教育厅自然科学基金资助项目 2010A310006
R331

