1-苄基-2-(2-氯代烯丙基)-3-哌啶酮的简便合成*
张雅聪,李成义,张 建
(1.甘肃奇正实业集团有限公司,甘肃 兰州 730010;2.甘肃中医学院 药学院,甘肃 兰州 730000)
·制药技术·
1-苄基-2-(2-氯代烯丙基)-3-哌啶酮的简便合成*
张雅聪1,李成义2,张 建2
(1.甘肃奇正实业集团有限公司,甘肃 兰州 730010;2.甘肃中医学院 药学院,甘肃 兰州 730000)
以苄基哌啶酮为原料,采用2,3-二氯丙烯与NaI原位生成烯丙基碘代物的方法,通过Stevens重排反应高效合成了天然生物碱常山碱的重要中间体——1-苄基-2-(2-氯代烯丙基)-3-哌啶酮,其结构经1H NMR,13C NMR,IR和HR-ESI-MS确证。
常山碱;Stevens重排;氮杂环系;生物碱;合成
氮叶立德的Stevens重排可以有效构建诸多生物碱的骨架[1-3],在一些天然生物碱的合成中也有广泛应用[4]。该反应一般分为两个过程:首先是胺基化合物和卤代物先成盐,然后再在碱性条件下发生重排,从而构建相应的氮杂环系。分步反应存在成盐过程时间长,成盐不完全以及原料剩余等缺点。
张建等[5]在构建天然生物碱Stenine和Aspidospermidine的氮杂环系骨架时,应用了Stevens重排反应引入烯丙基。首先胺基化合物和烯丙基溴在DMSO中成盐,然后在叔丁醇钾条件下发生[2,3]σ重排得烯丙基化合物,该方法耗时且原料反应不完全。在后续研究中我们发现,胺基化合物和烯丙基溴在乙腈溶剂中,碳酸钾的弱碱性条件下回流,可简单高效一步合成烯丙基取代的氮杂环系烯丙基化合物,该方法反应时间短,原料反应完全且收率高。
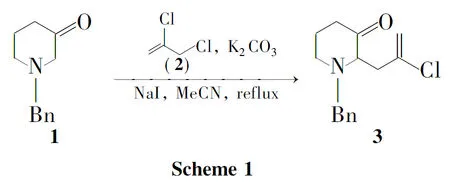
在前述研究的基础上,本文以1-苄基-3-哌啶酮(1)为原料,采用2,3-二氯丙烯(2)与NaI原位生成烯丙基碘代物的方法,通过Stevens重排反应实现了天然生物碱常山碱的重要中间体——1-苄基-2-(2-氯代烯丙基)-3-哌啶酮(3,Scheme 1)的高效合成,其结构经1H NMR,13C NMR,IR和HR-ESI-MS确证。采用巴豆基氯(4)与1的反应对反应机理进行了验证,并对反应进行了优化。
1 实验部分
1.1 仪器与试剂
Bruker AM-400MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet NEXUS 670FT-IR型红外光谱仪(KBr压片或涂膜);Bruker Daltonics APEXⅡ47e FT-ICR型高分辨质谱仪。
所用试剂均为分析纯;溶剂使用前经蒸馏或无水处理。
1.23的合成
在圆底烧瓶中加入118.995g(100.5mmol),无水碳酸钾15.3g(110.55mmol)及无水NaI 16.69g(110.55mmol)。N2保护;搅拌下依次加入乙腈144mL和216.73g(150.75mmol),回流(90℃)反应13h[TLC检测,展开剂:A=V(PE)∶V(EA)=3∶1]。冷却至室温,加水(60mL)淬灭反应,减压蒸除乙腈,水相用乙酸乙酯(3×60mL)萃取,合并有机相,依次用水(2×30mL)和饱和食盐水洗涤,无水硫酸钠干燥,浓缩得红褐色黏稠液体,经硅胶柱层析(洗脱剂:A=6∶1)纯化得淡黄色油状液体321.98g,收率83%,Rf=0.6(展开剂:A=3∶1);1H NMRδ:1.97~2.04(m,2H),2.38~2.43(m,1H),2.45~2.57(m,1H),2.61~2.67(m,1H),2.84~2.86(m,2H),2.90~2.95(m,1H),3.52(t,J=6.4Hz,1H),3.62(d,J=13.4Hz,1H),3.80(d,J=13.4Hz,1H),5.23(s,1H),5.24(s,1H),7.15~7.31(m,5H);13C NMRδ:24.0,36.7,38.1,46.3,56.5,68.4,114.7,127.1,128.2,128.5,138.3,139.0,209.2;IRν: 2951,1716,1635,1454,1136,885cm-1;HR-ESI-MSm/z:Calcd for C15H19NOCl{[M+H]+}264.1145,found 264.1148。
2 结果与讨论
2.1 反应条件优化
鉴于胺基化合物和烯丙基卤化物在碳酸钾/乙腈条件下可高效转化为相应的烯丙基化合物。本文研究并发展了在氮杂环系中引入氯代烯丙基的方法,并对反应条件进行优化。11mol,其余反应条件同1.2,考察2的用量,NaI和反应时间对Stevens重排反应的影响,结果见表1。由表1可见,22.0mol时,在碳酸钾/乙腈条件下,几乎不反应,这是由于在2-位氯原子的存在下,使得在成盐步骤中3-位氯原子很难离去,因此无Stevens重排产物生成;加入NaI后,首先2和碘化钠原位生成2-氯-3-碘丙烯,由于碘原子更易离去,所以促进了成盐步骤的发生,进而大大提高了反应速率和收率。实验还发现,以2-氯-3-溴丙烯(2.0mol)代替2反应时,虽然可以发生重排,但反应时间长,只有少量重排产物生成,收率很低(10%,No.8)。
综上所述,Stevens重排反应的最佳反应条件为:11mmol,K2CO31.1mol,21.5mol,NaI 1.1mol,于90℃反应13h,收率83%(No.7)。该反应条件下,收率较高、反应时间较短、反应经济性最好。

表1 Stevens重排反应条件优化*Table1 Process optimization of Stevens rearrangement reaction conditions
*11.0mol,其余反应条件同1.2
2.2 反应机理
采用4和1对反应机理进行了验证。实验结果表明,1与4在1.2反应条件下顺利生成重排产物淡黄色油状液体5(Scheme 2)[dr=1.3/1,Rf=0.7(展开剂:A=3∶1);1H NMRδ:0.89(d,J=6.0Hz,3H,α-H),1.11(d,J=6.0Hz,3H,β-H),1.94~2.03(m,2H,α,β-H),2.23~2.39(m,4H,α,β-H),2.46~2.55(m,2H,α,β-H),2.55~2.84(m,5H,α,β-H),3.18~3.23(m,2H,α,β-H),3.67~3.77(m,3H,α,β-H),4.91~5.08(m,4H,α,β-H),5.50~5.56(m,1H,β-H),5.79~5.82(m,1H,α-H),7.23~7.30(m,6H,α,β-H);13C NMRδ:17.2,17.7,25.3,25.3,36.8,38.1,38.7,38.8,44.5,44.7,56.9,57.7,75.2,75.3,114.1,114.9,127.1,127.2,128.2,128.3,128.7,128.8,138.8,140.1,141.5,212.9,213.1],而非简单的烷基化产物。

3 结论
本文建立的Stevens重排反应条件,以碳酸钾为碱,烯丙基卤代物和碘化钠原位生成烯丙基碘代物,使得Stevens重排反应成盐过程快速且反应收率高,通过“一锅法”即可得重排产物,并对反应机理进行了验证。
该方法操作简单、条件温和,在某些天然生物碱分子的合成中,将具有广泛的应用价值。
[1] Liu,J P,Cheng C Y.Total synthesis of (±)-desoxycodeine-d:A novel route to the morphine skeleton[J].Tetrahedron Lett,2000,41(6):915-918.
[2] Beall L S,Padwa A.An approach to the cephalotaxine ring skeleton using an ammonium ylide/Stevens[1,2]-rearrangement[J].Tetrahedron Lett,1998,39(24):4159-4162.
[3] Padwa A,Beall L S,Eidell C K,etal.An approach toward isoindolobenzazepines using the ammonium ylide/stevens[1,2]-rearrangement sequence[J].J Org Chem,2001,66(7):2414-2421.
[4] LiW D Z,Wang Y Q.A novel and efficient total synthesis of cephalotaxine[J].Org Lett,2003,5(16):2931-2934.
[5] Zhang J,Wang Y Q,Wang X W,etal.Transannular reductive rearrangement ofα-amino ketones: Construction of aza-tricyclic frameworks of several alkaloids[J].J Org Chem,2013,78(12):6154-6162.
FacileSynthesisofAllyl-substitutedAza-heterocyclicCompounds
ZHANG Ya-cong1, LI Cheng-yi2, ZHANG Jian2
(1.Gansu Chee Zheng Industrial Group Co.,Ltd.,Lanzhou 730010,China;2.School of Pharmacy,Gansu University of Traditional Chinese Medicine,Lanzhou 730000,China)
A key intermediate of Dichroine,allyl-substituted benzyl-piperidone,was synthesized by Stevens rearrangement reaction of 1-benzyl-3-piperidone with allyl iodine which was obtained in-situ.The structure was confirmed by1H NMR,13C NMR,IR and HR-ESI-MS.
Dichroine;Stevens rearrangement;aza-heterocyclic;alkaloid;synthesis
2014-04-22
张雅聪(1967-),女,汉族,甘肃西峰人,主要从事中药与藏药的合成与应用研究。
李成义,教授,硕士生导师,E-mail: lcy@gxzy.edu.cn;张建,副教授,E-mail: zhangjian@gszy.edu.cn
O626.3;R914.5
A
1005-1511(2014)05-0706-03

