丁二酸二(二乙二醇单甲醚)酯的制备及其应用*
张 舒,马先果,彭祖铃,邓正华,潘中来
(中国科学院 成都有机化学研究所,四川 成都 610041)
·研究简报·
丁二酸二(二乙二醇单甲醚)酯的制备及其应用*
张 舒,马先果,彭祖铃,邓正华,潘中来
(中国科学院 成都有机化学研究所,四川 成都 610041)
以二乙二醇单甲醚和丁二酸酐为原料,对甲苯磺酸为催化剂,在二甲苯中经开环反应合成了丁二酸二(二乙二醇单甲醚)酯(1),其结构经1H NMR和IR确证。采用恒电流充电法、循环伏安扫描和充放电性能测试了电解质溶液[1.2mol·L-1双三氟甲基磺酰亚胺锂(LiTFSI)/V(1)∶V(EC)∶V(DEC)=3∶3∶4]在锂离子电池中的电化学性能。结果表明:1与石墨负极有较好的相容性,在0V~2V,0.1C下充放电20次后放电比容量为346.2mAh·g-1,容量保持率为111.10%。
锂离子电池;丁二酸二(二乙二醇单甲醚)酯;制备;应用;电化学性能
碳酸酯类、醚类和羧酸酯类[1]等有机溶剂广泛应用于锂离子电池电解液中。单一溶剂很难达到锂离子电池的要求,目前商业化的锂离子电池电解液都采用混合电解液体系。通常会将介电常数高与粘度低、液态范围宽的溶剂混合使用。介电常数高的溶剂对锂盐的离解十分有利,其中碳酸乙烯酯(EC)和聚碳酸酯(PC)具有较高的介电常数。PC不能与石墨电极表面形成优异的固态电解质界面膜(SEI),放电时PC会与锂离子共嵌入石墨层间发生反应,造成大量不可逆容量[2];而EC在石墨层表面能够形成致密的SEI膜,并具有良好的性能[3-4],以EC为主配置的电解液,如EC/碳酸二乙酯(DEC),EC/DMC(碳酸二甲酯)[5-6],EC/DMC/DEC,EC/DEC/EMC(碳酸甲乙酯)等[7-10]是常用的电解液溶剂。一般来说有机溶剂的电化学活性越高,越能在较高的电位下形成SEI。醚类化合物的电化学活性普遍规律为链状醚>环状醚>链状碳酸酯>环状碳酸酯。常用于电解质锂盐中,LiClO4因具有强氧化性,安全性能差而遭弃用;LiPF6热稳定性能差[11],70℃左右就会开始分解产生腐蚀性的HF。F Kita等[12]发现双三氟甲烷黄酰亚胺锂(LiTFSI)参与SEI膜的形成,使得电池具有很好的循环性能。
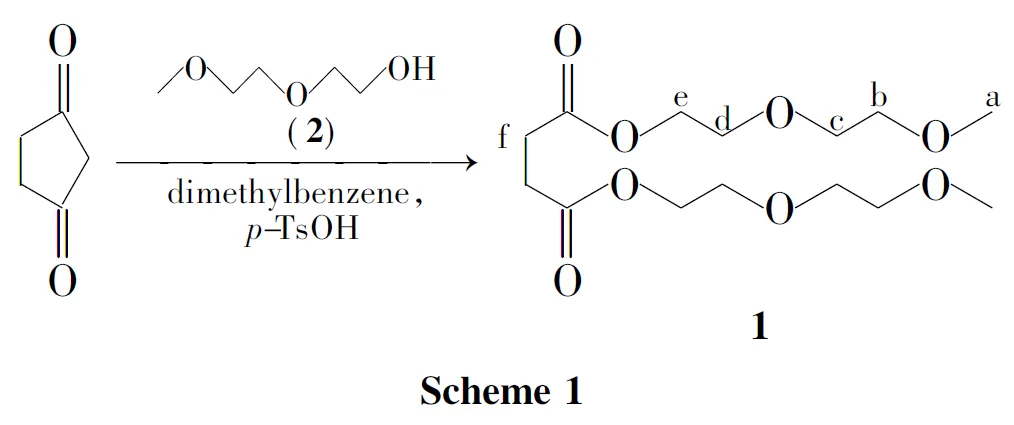
本文以二乙二醇单甲醚(2)和丁二酸酐为原料,对甲苯磺酸(p-TsOH)为催化剂,在二甲苯中经开环反应合成了丁二酸二(二乙二醇单甲醚)酯(1,Scheme 1),其结构经1H NMR和IR确证。并采用恒电流充电法、循环伏安扫描和充放电性能测试了电解质溶液[1.2mol·L-1双三氟甲基磺酰亚胺锂(LiTFSI)/V(1)∶V(EC)∶V(DEC)=3∶3∶4]在锂离子电池中的电化学性能。
1 实验部分
1.1 仪器与试剂
Bruker-300MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);MX-1E型红外光谱仪(KBr压片);BTS型电池检测仪;Arbin-001MITS Pro 3.0-BT2000型测试仪。
LiTFSI,东京化成工业株式会社;EC,宙邦化工;DEC,天津市化学试剂研究所,蒸馏提纯一次;丁二酸酐,天津博迪化工;2,广东化学试剂研发中心;LiCoO2极片,中科来方公司;石墨,辽宁宏光CGP-6;隔膜,美国Celgard2400PP膜。
1.2 1的合成
在三口圆底烧瓶中依次加入丁二酸酐25g(250mmol),263.08g(525mmol),p-TsOH·H2O 0.88g(4.63mmol)和二甲苯26mL,搅拌下于130℃~140℃反应12h得亮黄色溶液。冷却,旋蒸除去二甲苯,氮气保护下减压(110Pa)蒸馏,收集184℃馏分得无色液体1,收率75%;1H NMRδ: 4.21~4.18(m,4H,e-H),3.65~3.60(m,4H,d-H),3.57~3.55(m,4H,c-H),3.50~3.47(m,4H,b-H),3.32(s,6H,a-H),2.60(s,6H,f-H);IRν:2925,2880,2825,1736,1454,1411,1380cm-1。
1.3 电解液的配制与电池组装
在充满氩气的密闭手套箱中(H2O含量低于1μg·mL-1)配制电解液[1.2mol·L-1LiTFSI/V(1)∶V(EC)∶V(DEC)=3∶3∶4],组装Li/LiCoO2半电池进行电化学窗口测试;组装Li/石墨半电池进行充放电性能测试以及循环伏安测试。
2 结果与讨论
2.1 表征
1的IR分析表明,2925cm-1,2880cm-1和2825cm-1处吸收峰为甲基、亚甲基的一系列伸缩振动吸收峰;在1736cm-1处出现一极强、尖锐的单峰,表明有酯基的生成;在1454cm-1处吸收峰为甲基或亚甲基的C-H面内弯曲振动峰;在1411cm-1处为甲基的C-H面内弯曲振动特征峰,甲基的特征吸收峰一般在1380cm-1附近。由于1中甲基与电负性强的O相连,其诱导效应使甲基特征峰向高波数位移。
2.2 电化学性能测试
(1)1的电化学窗口测试
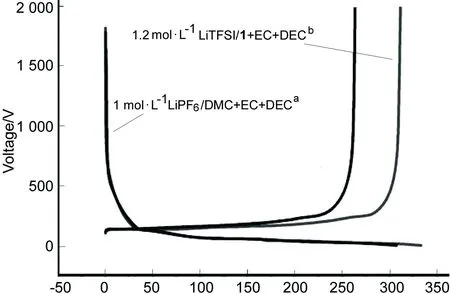
电化学窗口指电解质能够稳定正常工作的电压范围,作为电解液溶剂,其电化学窗口至少应大于4.5V。图1为Li/LiCoO2半电池的恒流充电曲线。从图1可以看出,在4.1V开始曲线凹下去,对应LiCoO2脱锂的过程;在4.6V曲线又有一个凹点,是1开始发生分解的电压,即电化学窗口,此时比容量质量接近于LiCoO2的理论容量274mAh·g-1;电压超过4.6V时,1开始分解,1的分解提供了额外的容量。
(2)石墨电极的循环伏安曲线
图2为石墨电极的循环伏安曲线。由图2可见,首次循环伏安曲线在0.7V左右有一个还原峰,为EC的分解峰,在此电位下,EC分解的产物覆盖在石墨表层形成了SEI,在第二周时,曲线上该峰消失,说明电解液在石墨表面有较好的成膜性能,阻止了电解液的进一步分解。
(3)Li/石墨半电池的充放电性能
图3为Li/石墨半电池在不同电解液0.1C电流密度下充放电的首次充放电曲线图,其中1.0mol·L-1LiPF6/V(DMC)∶V(EC)∶V(DEC)=1∶1∶1是最广泛使用的商业化锂离子电池电解液。两种电池,在电池的首次放电过程中,放电开始,电位迅速下降至1.0V以下,并在0.7V附近出现了生成SEI的短电位平台,这是EC在石墨电极表面分解成SEI的结果。在0.2V~0V出现了一个长而平缓的平台,这是锂离子嵌入石墨层间的反应。
从图3可知,含有1电解液Li/石墨半电池首次充电容量、放电容量均明显高于常规电解液,其中含1电解液半电池首次充电容量、放电容量分别为311.6mAh·g-1和333.4mAh·g-1,首次充放电效率为93.46%。常规电解液半电池的Li/石墨半电池首次充电容量、放电容量分别为265.1mAh·g-1和307.3mAh·g-1,首次充放电效率仅为86.27%。

比容量/mAh·g-1

Voltage /V
Specific capacity/mAh·g-1

Specific capacity/mAh·g-1
(4)Li/石墨半电池的循环性能
图4为Li/石墨半电池的循环性能。由图4可知,含1电解液Li/石墨半电池放电容量明显高于常规电解液半电池的放电容量,含1电解液的半电池循环20次后容量达到346.2mAh·g-1,容量保持率高达111.10%,而常规电解液半电池循环20次后容量仅为325.4mAh·g-1,容量保持率为104.43%。可能是因为1与具有亲油基团,能很好的吸附在石墨表层进行锂离子的传输,降低了极化,从而延长了放电平台,提升了容量。
3 结论
以二乙二醇单甲醚和丁二酸酐为原料,对甲苯磺酸为催化剂,在二甲苯中经开环反应合成了丁二酸二(二乙二醇单甲醚)酯(1)。1具有醚氧基团,能在较高的电位下形成SEI,且1有亲油基团,能很好的吸附在石墨表层进行锂离子的传输。
采用恒电流充电法、循环伏安扫描和充放电性能测试了电解质溶液[1.2mol·L-1LiTFSI/V(1)∶V(EC)∶V(DEC)=3∶3∶4]在锂离子电池中的电化学性能。研究表明:1的电化学窗口为4.6V,满足锂离子电池电解液的要求;1与石墨负极有较好的相容性,在0V~2V,0.1C下充放电20次后放电比容量为346.2mAh·g-1,容量保持率为111.10%,均明显高于商业化的常规电解液[1.0mol·L-1LiPF6/V(DMC)∶V(EC)∶V(DEC)=1∶1∶1]。
溶剂1可以作为锂离子电池共溶剂使用,其其他性质还需进一步研究。
[1] Kang Xu.Nonaqueous liquid electrolytes for lithium-based rechargeable batteries[J].Chemical reviews,2004,104:4304-4417.
[2] Selim R,Bro P.Some observations on rechargeable lithium electrodes in a propylene carbonate electrolyte[J].Journal of the Electrochemical Society,1974,121(11):1457-1459.
[3] Tobishima S,Arakawa M,Hirai T,etal.Ethylene carbonate-based electrolytes for rechargeable lithium batteries[J].Journal of Power Sources,1989,26(3-4):449-454.
[4] Mcmillan R S,Juzkow M W.A report on the development of a rechargeable lithium cell for application in autofocus cameras[J].Journal of the Electrochemical Society,1991,138(6):1566-1569.
[5] Guyomard D,Tarascon J M.Rechargeable Li1+xMn2O4/Carbon cells with a new electrolyte-composition=potentiostatic studies and application to practical cells[J].Journal of the Electrochemical Society,1993,140(11):3071-3081.
[6] Tarascon J M,Guyomard D.New electrolyte compositions stable over the 0-vto 5-V voltage and compatible with the Li1+xMn2O4Carbon Li-ion cells[J].Solid State Ionics,1994,69(3-4):293-305.
[7] Koetschau I,Richard M N,Dahn J R,etal.Orthorhombic LiMnO2as high-capacity cathode for Li-ion cells[J].Journal of the Electrochemical Society,1995,142(9):2906-2910.
[8] Eineli Y,Thomas S R,Koch V,etal.Ethylmethylcarbonate as a promising solvent for Li-ion rechargeable batteries[J].Journal of the Electrochemical Society,1996,142(12):L273-L277.
[9] Xu K,Ding M S,Jow T R.Quaternary onium salts as nonaqueous electrolytes for electrochemical capacitors[J].Journal of the Electrochemical Society,2001,148(3):A267-274.
[10] Aurbach D,Eineli Y,Markovsky B,etal.The study of electrolyte-solutions based on ethylene and diethyl carbonates for rechargeable Li batteries[J].Journal of the Electrochemical Society,1995,142(9):2882-2890.
[11] Vos R,Lux M,Xu K,etal.Removal of submicro-meter particles from silicon wafer surfaces using HF-based cleaning mixtures[J].Journal of the Electrochemical Society,2001,148(12):G683-G691.
[12] Kita F,Sakata H,Kawakami A,etal.Characteristics of the electrolyte with fluoro organic lithium salts[J].Journal of Power Sources,2000,90(1):27-32.
PreparationandApplicationofSuccinicAcidBis(diethyleneglycolmonomethylether)Ester
ZHANG Shu, MA Xian-guo, PENG Zu-ling, DENG Zheng-hua, PAN Zhong-lai
(Chengdu Institute of Organic Chemistry,Chinese Academy of Sciences,Chengdu 610041,China)
Succinic acid bis(diethylene glycol monomethyl ether)ester(1)was prepared by ring-opening reaction of diethylene glycol monomethyl ether with succinic anhydride usingp-toluenesulfonic acid as the catalyst.The structure was confirmed by1H NMR and IR.The electrochemical performance of 1.2mol·L-1lithium bis(trifluoromethane sulfonimide)in the mixed solvent[V(1)∶V(EC)∶V(DEC)=3∶3∶4] were investigated by constant current charging method,cyclic voltammogram and charge/discharge performance test.The results showed that at a current density of 0.1C under 0V~2V,the electrolyte can bring a discharge capacity of 346.2mAh·g-1and a capacity retention rate of 111.10% after 20cycles.
lithium-ion battery;succinic acid bis(diethylene glycol monomethyl ether)ester;preparation;application;electrochemical performance
2014-04-08
张舒(1988-),男,汉族,湖北宜昌人,主要从事锂离子电池电解液的研究。E-mail: zhangshu7788@126.com
邓正华,研究员,E-mail: zhdeng@cioc.ac.cn
O614.111
A
1005-1511(2014)05-0683-04

