L-苯丙氨酸脲类化合物的合成工艺改进*
高玉华,乐文俊,程贺龙,陆鸿飞
(江苏科技大学 生物与化学工程学院,江苏 镇江 212003)
·研究简报·
L-苯丙氨酸脲类化合物的合成工艺改进*
高玉华,乐文俊,程贺龙,陆鸿飞
(江苏科技大学 生物与化学工程学院,江苏 镇江 212003)
以L-苯丙氨酸为原料,经甲酯化反应制得中间体丙谷胺酸甲酯盐酸盐(1);以三乙胺为缚酸剂,1经固体光气活化制得苯丙氨酸异氰酸酯后,再分别与伯胺反应合成了4个苯丙氨酸脲类化合物(3a~3d),收率90.7%~94.2%,其结构经1H NMR,MS和X-衍射确证。
L-苯丙氨酸;脲类化合物;合成;工艺改进
非对称取代脲是一类在医药、化工及农业上具有广泛应用的化合物[1-2]。脲化合物氮上的两个氢均具有酸性,可与底物有效地形成双氢键,降低底物不饱和双键的电子云密度,使其更容易接受亲核试剂的进攻,从而催化C-C和C-杂原子的成键反应[3]。因此,近年来设计并合成包含脲基的手性小分子催化剂备受关注[4]。
氨基酸是廉价易得的天然手性源,可衍生出多种手性催化剂,并应用于不对称合成反应中,如氨基酸酰胺衍生物[5-6]、氨基酸酰肼衍生物[7]和氨基醇衍生物[8-9]等。苯胺异氰酸酯与L-苯丙氨酸合成手性双取代不对称脲的方法已有文献报道[10-12],该方法适用于异氰酸酯稳定的胺类化合物。而对于其中两个为氨基取代的吡啶化合物,往往只能得到副产物对称脲。
为解决这一问题,本文对其进行工艺改进,选用L-苯丙氨酸为原料,经甲酯化反应制得中间体丙谷胺酸甲酯盐酸盐(1);以三乙胺为缚酸剂,1经固体光气活化制得苯丙氨酸异氰酸酯(2);2再分别与伯胺(3a~3d)反应合成了苯丙氨酸脲类化合物(4a~4d,Scheme 1),其结构经1H NMR,MS和X-衍射确证。
1 实验部分
1.1 仪器与试剂
Yansco RY-51型显微熔点仪(温度未校正);Bruker-Avance DPX 400MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Agilent-6110型质谱仪;Smart APEX II型X-射线衍射仪。
所用试剂均为分析纯。
1.2 合成
(1)1的合成
在单口瓶中加入L-苯丙氨酸4.0g(24mmol)和无水甲醇25mL,冰浴冷却,搅拌下缓慢滴加二氯亚砜加2mL,滴毕(反应液由悬浊逐渐变为澄清透明),反应15min;于室温反应12h;于50℃反应2h。减压除溶,干燥得白色固体1。
(2)2的合成
在单口瓶中加入13.235g(15mmol)和二氧六环20mL,冰盐浴冷却,搅拌下依次缓慢滴加三乙胺1.5mL和三光气2.968g(10mmol)的二氧六环(20mL)溶液,滴毕,回流(101℃)反应3h。冷却至室温,过滤,滤液减压除溶得棕红色油状液体2。
(3)4a~4d的合成(以4a为例)
在单口瓶中加入邻氯苯胺3a255mg(2mmol)和CH2Cl210mL,搅拌下于室温缓慢滴加2410mg(2mmol)的二氯甲烷(5mL)溶液,滴毕,反应12h(TLC检测)。减压除溶,残余物用乙酸乙酯溶解,饱和氯化钠溶液(3×15mL)洗涤,无水硫酸钠干燥,旋蒸脱溶后经硅胶柱层析[洗脱剂:V(石油醚)∶V(乙酸乙酯)=3∶1]纯化得白色固体4a0.626g。
用类似的方法合成白色固体4b~4d。
4a:收率94.2%,m.p.142℃~143℃;1H NMRδ:7.97(dd,J=8.2Hz,1.2Hz,1H),7.33~7.25(m,3H),7.15(ddd,J=12.8Hz,11.2Hz,6.9Hz,4H),6.95(dd,J=11.0Hz,4.4Hz,1H),6.79(s,1H),5.39(d,J=7.3Hz,1H),4.84(d,J=7.2Hz,1H),3.73(s,3H),3.12(dd,J=13.0Hz,5.8Hz,2H)。
4b: 收率91.5%,m.p.92℃~93℃;1H NMRδ:7.27(dd,J=8.6Hz,2.0Hz,2H),7.23(dd,J=6.8Hz,4.3Hz,3H),7.19(dd,J=8.6Hz,1.3Hz,2H),7.13~7.08(m,2H),7.08~7.02(m,1H),6.82(s,1H),5.51(d,J=7.9Hz,1H),4.84(dt,J=7.9Hz,6.0Hz,1H),3.72(s,3H),3.09(ddd,J=41.1Hz,13.8Hz,6.0Hz,2H)。
4c: 收率93.2%,m.p.101℃~102℃;1H NMRδ:9.95(s,1H),9.47(s,1H),8.05(d,J=4.9Hz,1H),7.59~7.47(m,1H),7.35~7.16(m,5H),6.84(dd,J=10.9Hz,6.1Hz,2H),4.91(q,J=6.4Hz,1H),3.72(s,3H),3.21(d,J=6.2Hz,2H)。
4d: 收率90.7%,m.p.111℃~112℃;1H NMRδ:10.00(s,1H),8.52(s,1H),7.95(d,J=5.3Hz,1H),7.35~7.29(m,2H),7.28~7.22(m,3H),6.77~6.53(m,2H),4.91(dd,J=13.7Hz,6.3Hz,1H),3.74(s,3H),3.21(s,2H),2.31(s,3H)。
(4)5a的合成
在单口瓶中加入4a333mg(1.0mmol),NaBH4151mg(4.0mmol)和THF 8mL,冰盐浴冷却,搅拌15min后缓慢滴加H2O 2mL,滴毕,反应12h(TLC跟踪)。加水10mL,减压除去THF,用DCM萃取,饱和氯化钠溶液(3×15mL)洗涤,无水硫酸钠干燥,旋蒸除溶后用乙醇重结晶得白色针状晶体5a,产率87%,m.p.108℃~109℃;1H NMRδ:7.84(dd,J=8.2Hz,1.2Hz,1H),7.67~7.07(m,9H),6.95(td,J=7.9Hz,1.3Hz,1H),4.13~3.96(m,1H),3.64(ddd,J=16.6Hz,11.0Hz,4.5Hz,2H),2.86(d,J=7.2Hz,2H)。
2 结果与讨论
2.1 合成
中间体2的合成是整个合成路线中的关键,本文以三光气代替剧毒的光气,反应更安全。4a在THF和水的混合溶剂中被NaBH4快速且温和的还原为相应的醇5a,反应单一,产物不消旋,无需柱层析纯化。
2.2 表征
(1)1H NMR
对比4a与5a的1H NMR谱图(图略),发现3.73处的三重质子峰消失,而在2.86处多出两重质子峰,表明甲酯基团被还原为醇基。
(2)X-ray
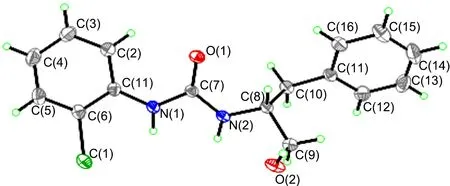
图 1 5a的X-ray谱图Figure 1 X-ray pattern of 5a
为进一步明确5a的构型,对其进行X-ray分析,结果见图1。由图1可见,NaBH4选择性还原4a的甲酯基团,对脲骨架不产生影响。
[1] 牟其明,赵志刚,杨祖幸,等.新型手性不对称脲分子钳受体的设计合成[J].有机化学,2005,25(9):1084-1088
[2] Lin T C,He G S,Prasad P N,etal.Synthesis of aromatic urea herbicides by the selenium-assisted carbonylation using carbon monoxide with sulfur[J].Synth Commun,2000,30(9):1675-1688
[3] 李楠,刘伟军,龚流柱.手性有机小分子催化最新进展[J].化学进展,2010,22(7):1362-1379
[4] Yang T,Ferrali A,Sladojevich F,etal.Brφnsted base/lewis acid cooperative catalysis in the enantioselective conia-ene reaction [J].J Am Chem Soc,2009,131(26):9140-9141
[5] Ahlford K,Adolfsson H.Amino acid derived amides and hydroxamic acids as ligands for asymmetric transfer hydrogenation in aqueous media[J].Catal Commun,2011,12:1118-1121
[6] Hatano M,Miyamoto T,Ishihara K.Highly active chiral phosphoramide-Zn(I)complexes as conjugate acid-base catalysts for enatioselective organozinc additon to ketones[J].Org Let,2007,9:4535-4538
[7] Ahlford K,EkströM J,Zaitsev A B,etal.Asymmetric transfer hydrogenation of ketones catalyzed by amino acid derived rhodium complexes:On the origin of enantioselectivity and enantioswitchability[J].Chem Eur J,2009,15(42):11197-11209
[8] 翁文,周宏英,傅宏祥,等.手性氨基醇在不对称催化中的应用及新进展[J].有机化学,1998,18(6):509-520
[9] Mao,J.C.,Wan,B.S.,Wu,F.,et al.First example of asymmetric transfer hydrogenation in water induced by a chiral amino alcohol hydrochloride[J].Tetrahedron Letter,2005,46:7341-7344
[10] 牟其明,薛翠花,向明礼,等.一锅法合成手性双取代不对称脲[J].四川大学学报(自然科学版),2003,40(1):178-180
[11] 杨学军,钟熠,谭炯,等.手性不对称脲氨基醇的合成[J].合成化学,2007,15(3):312-315
[12] 王旭,张爱琴,陈学明,等.手性氨基醇衍生物催化苯基锂与亚胺的不对称加成反应研究[J].化学研究与应用,2012,24(7):1147-1150.
ProcessImprovementonSynthesisofL-phenylalanineDerivatives
GAO Yu-hua,LE Wen-jun,CHENG He-long,LU Hong-fei
(School of Biological and Chemical Engineering,Jiangsu University of Science and Technology,Zhenjiang 212003,China)
An intermediate,1-methoxy-1-oxo-3-phenylpropan-2-aminium chloride(1),was prepared by methyl-esterification of L-phenylalanine.Four L-phenylalanine Derivatives in yield of 90.7%~94.2were synthesized by activation of1via triphosgene,using triethylamine as the acid acceptor,and then reacted with primary amine.The structures were confirmed by1H NMR,MS and X-ray diffraction.
L-phenylalanine;urea derivative;synthesis;process improvement
2014-04-22
国家自然科学基金资助项目(21201087)
高玉华(1963-),男,汉族,江苏阜宁人,高级工程师,主要从事有机合成与电化学功能材料的研究。E-mail: gaoyuhua1964@163.com
O623.73;O621.3
A
1005-1511(2014)06-0807-03

