逆流等温尿素合成的热力学分析(续一)
(中国化工学会化肥专业委员会,上海 200062)
1 研究本课题的目的和意义
逆流等温尿素合成塔是UTI热循环工艺开发出的众多创新成果中最引人注目的科研成果。
该成果使尿素合成转化率从传统法的65%提高到75%,经济效益不言而喻。
因为逆流等温合成塔是从传统合成塔发展创新而来的,合成塔的工艺条件——压力、温度、NH3/CO2、H2O/CO2,与传统法相近,因而特别受我国目前运行着的众多传统法尿素装置青睐。仅此一项成果(尿素合成转化率提高),即能使传统法尿素装置吨尿蒸汽消耗降至1.2~1.1 t。同时该项成果还是节能与增产兼顾的先进技术,故而也是扩产改造的首选技术,增产能力在40%~50%(即130 kt/a扩产到190 kt/a)时,合成转化率仍能保持在70%以上。
本课题首先考察传统工业尿素合成存在哪些问题,指出传统尿素合成运行效率低的原因,哪些因素影响转化率的提高。嗣后,对UTI新颖的逆流等温合成法所采取的技改措施开展热力学分析,揭示其高效运行的成功之道及技术关键。
2 传统工业尿素合成存在的的问题
2.1 传统工业尿素合成过程分析[1,2]
通常,工业上传统尿素合成的运行方式如下:三股物流(原料CO2、预热的液氨、以及返回的循环甲铵液)全部从底部进入尿塔,如图1所示。经过理想混合后,原料CO2全部生成甲铵。由于进入的NH3与CO2生成液态甲铵的反应是快速强放热反应,放出的大量反应热会加热混合物料,使物料温度急剧升高,导致底部过热,其结果是使液相物系平衡压迅速升高。若平衡压超过外压时,甲铵反应热还有多余,则生成的液态甲铵将分解为NH3与CO2气体,直到多余的热量全部用完,达到新的气液相平衡。
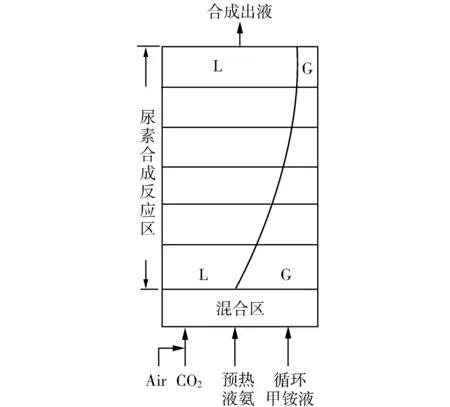
图1 传统尿塔示意图
底部进料尿塔的过热现象是工业尿素合成物系甲铵生成反应化学平衡与相平衡、焓平衡三者综合的结果。如果甲铵生成热不移走,即在绝热条件下,此现象是不可避免的。其结果是,使底部物料形成气液两相流。
底部进料的尿塔出现气液两相流是普遍的。除了传统法之外,日本改良C法,CO2汽提法,NH3汽提法,以及ACES等塔底都是呈相平衡的气液两股物流。
对于传统法尿塔,当合成工艺条件为p20 MPa,t188~190 ℃,NH3/CO24.0~4.1,H2O/CO20.65时,由计算可知,占20%~25%的原料CO2在塔底尚未生成液态甲铵,或液态甲铵重又分解为NH3与CO2气体,在塔底混合区输出达气液平衡的两股物流,温度为178~180 ℃。之后,进入反应区,进行复合的尿素合成反应。由热力学分析可知,此过程也是在化学平衡(这里是气液相甲铵生成反应和液相中甲铵脱水生成尿素的两个反应)、相平衡和焓平衡条件下进行的。简述如下。
当气体与液体呈平衡的混合物沿合成塔上升,随着时间的推移,液相中甲铵进行转化为尿素的脱水反应,使液相中水和尿素浓度增加,这两种物质都是高沸点,因此物系沸点升高,进入液相区,溶液呈溶解吸收状态,气相中的NH3与CO2再一次反应生成液态甲铵,并放出反应热,作为甲铵脱水反应所需之热量。同时甲铵反应热还加热液态物料,使其达沸点。进入新的气液平衡状态的两股物流继续上移,随着时间的推移,进行新一轮的甲铵脱水转化为尿素的反应,……如此不断循环。随着物流上移,尿素转化率增加,溶液中尿素和水浓度增加。物流上移过程中,气相物流量减少,液相物料量增加,物流温度逐渐升高。到达塔顶,近乎达化学平衡和相平衡的气液物流一起排出塔外。由此可见,物料从底部慢慢上行进行的尿素合成之复合反应,均是在气液两相流的氛围中进行的,直到塔顶。
2.2 存在的问题[3]
传统尿素合成从塔底到塔顶始终是气相(包括惰性气体N2,O2,H2等以及有效气体CO2,NH3,H2O)和含有甲铵过剩NH3,H2O和尿素的液相两股物流,见图2。由图可知,底部气相体积分率最大,超过50%,顶部最小,约22%。气相物流的存在是导致尿素转化率降低的主要原因。可从以下两方面来分析。
(1)物料在塔内停留时间缩短
因为塔内物流是气液混合物,导致流过全塔物流之密度降低,原来认为尿塔全为液相的观点应改变。密度的降低导致物料在塔内停留时间减少。计算得传统水溶液全循环法的实际停留时间为30 min(若为全液相,名义停留时间为45~50 min)。随着停留时间的缩短,液相脱水反应时间亦随之减少,最终导致尿素转化率下降。

图2 塔高与气液体积图
(2)晚生成之甲铵停留时间严重不足
由于底部存在过热现象,塔底液态甲铵要再分解为气态CO2和NH3,这部分CO2随着物料上移而逐渐冷凝为液态甲铵,属于“晚生成之甲铵”。
上述的全程停留时间(30 min)并非物系中所有甲铵都享有,只有塔底未分解之液态甲铵才享有如此长的甲铵脱水转化为尿素的反应时间。
底部气相物流中的CO2,都属于晚生成之甲铵。这些CO2虽然会在上升过程中逐渐冷凝为液态甲铵,但其脱水转化为尿素的时间则逐渐递减,都低于30 min。
以传统法为例,图3中只有塔底85%~87%的甲铵享有30 min脱水转化时间,位于中部(H1)晚生成之甲铵,脱水反应时间τ1降为20 min,上部(H2)晚生成之甲铵,τ2=10 min。

图3 塔高与物流停留时间图
由动力学模型计算可知,只有塔底的甲铵可望其尿素转化率达到平衡转化率的95%~98%。上中部晚生成之甲铵终因转化时间不足致使尿素转化率大大低于平衡转化率。这些晚生成之甲铵终因停留时间严重不足而排出尿塔,导致总的尿素转化率偏低。
2.3 工业实际的验证
(1)实际停留时间τ实
物料在尿塔中的实际停留时间(τ实),对于尿塔的操作运行,塔实际体积的设计,以及模拟计算等,都是十分重要的基础数据。为此,本文以工业装置提供的数据为基础,计算了传统法和汽提法流程尿塔的τ实,见表1。

表1 工业装置尿塔内物料停留时间
表中还列出了假设物料全为液相状态时的名义停留时间τ名义,这是虚拟值,工业装置中并不存在。
另外,还计算了尿塔物系在合成温度条件下达到化学平衡状态所需的时间,τ平[4,5]。可见,工业装置在设计的生产强度下,实际停留时间基本满足要求。严格讲是底部液态甲铵的停留时间满足要求。当然,随着生产强度的提高,τ实就不够了,转化率随之降低。
(2)实际尿素转化率的瓶颈现象[3]
底部进料的传统尿塔产生两相流导致尿素转化率下降已被工业装置实际数据所证实。并且工业装置的转化率出现瓶颈现象,x实<70%。这一现象从我国传统水溶液全循环法和日本改良C法的实际尿素转化率数据得到证实,见表2。
表2中传统1是传统法工业化初期的尿素转化率数据(尿塔为空塔或安装简易塔板),强烈的液相返混和气相沟流,使实际尿素转化率x实只有63%~65%,大大低于平衡转化率x平。

表2 传统法尿素工业装置的平衡转化率和实际转化率
表2还列出了另一传统水溶液全循环法——日本改良C法的尿素转化率数据。该数据是由日本改良C法提供的物料平衡表中合成出口液数据计算求得的。应该说明的是,计算得到的xCO2不是真实的尿素转化率,因为进入尿塔的循环液中含有大量尿素。若将甲铵液中循环的尿素扣除,则x实下降为69.40%(表2中括号内数字),故而真实尿素转化率亦低于70%,x实与x平之差值Δx约为5%。
表2中传统2为在尿塔内安装了高效塔盘的尿素转化率x实,为67%~68%,与x平之差值Δx约为5%。
工业实际数据产生瓶颈现象的主要原因还是两相流,因为塔盘只能加速物流质量、热量的交换,使之趋于平衡,降低液相返混和气相沟流,使物流处于理想的气液活塞流状态,并不能增加甲铵脱水转化为尿素的反应时间,因为塔盘的效率再高也不会改变上中部晚生成的液态甲铵脱水转化为尿素的时间。所以再高效的塔盘或安装再多的塔盘,x实也难以超越70%。
3 技改思路与方法
3.1 技改思路
通常,实验室测试尿素平衡转化率是按合成原始配料,在高压釜中保持一定温度,使物料处于全液相状态下测定的。因此,若工业实际尿塔物料也能像实验室一样,处于全液相状态下进行甲铵脱水转化为尿素的反应,是最为理想的。这样,工业实际转化率x实就避免了气相物流的干扰,其值易于接近平衡转化率x平。
但是,尿素合成反应是由两个反应组合而成的。第一个反应,甲铵生成反应,是飞速反应;第二个反应,甲铵脱水反应,是速度较慢的反应。两个反应速度的巨大差异,使工业装置上两者的热量转移遇到困难,并导致在底部进料混合区,第一反应完成时第二反应尚未开始或第二反应刚刚开始,最终出现物流过热及两相流现象。如何将甲铵瞬间放出的热量,不用于甲铵再分解,而逐渐转移作为甲铵脱水热,避免气相物流的产生,使甲铵脱水反应在全液相的状态下进行,是提高尿素装置工业实际转化率的关键。
设想的方案有两个:第一为熔融液显热转移法;第二为逆流换热法。
3.2 熔融液显热转移法
3.2.1原理
如果将甲铵放出的热量以生成的氨-甲铵熔融液为受热载体,将热能以显热形式贮存,随着甲铵脱水反应的缓慢进行,将热量逐渐消化。为了保持液态,氨-甲铵熔融液的温度将急剧升高。然而,在传统水溶液全循环法尿塔压力20 MPa下,物系沸点温度太低,为170~175 ℃,见图4中c1点,故而物系中甲铵发生分解,产生气相。只有提高压力,才能将氨-甲铵熔融液之沸点温度提高,以使物系保持液态。

图4 介稳态超临界NH3―CO2似二元物系t―p―NH3/CO2关系曲线
由液相焓模型:

可计算出熔融液温度升至210 ℃以上。
3.2.2流程(图5)
显热法全液相尿塔的工艺条件如下:
压力p>40 MPa,温度t底210 ℃,t顶188~190 ℃,NH3/CO24.0~4.1,H2O/CO20.65。
流程说明 压力为40 MPa的三股物料(原料液氨,原料CO2,返回的甲铵液)从底部进入尿塔,充分混合后,原料CO2与NH3生成甲铵。该反应是一个几乎在瞬间(速度极快)完成的强放热反应,也即CO2近于100%地反应生成液态甲铵,并与剩余NH3和循环甲铵返回液一起形成熔融态的氨-甲铵合成液。该熔融液被甲铵反应放出的热量加热。在绝热状态下,甲铵反应热将被熔融液全部吸收,温度迅速升高,由于压力高达40 MPa,则熔融液温度可升至210 ℃仍保持液态而不发生汽化或甲铵分解现象。这样将反应热以显热形态贮存于熔融液中。
之后,随着时间的推移,在自下而上的移动过程中,高温液态物料中的甲铵脱水转化为尿素,即进行尿素合成第二反应。该反应是一个弱吸热且速度较慢的反应,在氨-甲铵熔融液缓慢上移过程中,溶液中的显热作为甲铵脱水生成尿素所需之热量,塔温随之下降。此过程一直进行到塔顶,近于达化学平衡,温度下降至188~190 ℃。
由此可知,显热全液相合成的塔温出现倒置现象(图5),即下部温度最高,上部温度最低。

图5 显热法全液相尿塔示意图
3.2.3评议
显热全液相法的操作温度高达210 ℃,压力高达40 MPa。在如此超高温高压条件下,设备的材质,制造费用以及高压运行费用,都是极为昂贵的。因而,虽然尿塔内物流呈全液相流状态,但受经济性限制无法应用。
3.3 逆流换热全液相法
与前一种显热贮存热量法不同,本法设想靠盘管换热来转移热量,基本思路如下。
在尿塔内设置一个盘管,作为发热部件,在盘管内进行甲铵放热反应,并且将甲铵快速放热反应限制在盘管内,放热盘管放置于塔内受热溶液流经的路径上,盘管外尿塔内氨-甲铵熔融液为受热部件,尿塔内熔融液进行甲铵脱水吸热反应。盘管与尿塔溶液隔开,两者通过管壁温差传递热量。这样就解决了尿素合成两个反应之间因速度差而产生的矛盾。
如果盘管设计合理,应能输出全为液态而不含气态CO2的氨-甲铵熔融液,然后送到尿塔内再进行甲铵脱水转化为尿素的反应。
图6(a)为本法示意图。
经上述热量转移处理,本法就演变成了静态实验室测定尿素平衡转化率的装置[图6(b)]。
两者比较,图6(b)的发热部件为电热丝,相当于图6(a)的盘管;图6(b)高压釜内配料为全液态的氨-甲铵液混合物,相当于尿塔内盘管输出全为液态的熔融液。

图6 全液相法尿素合成装置示意图
由上讨论可见,本法最终目的是为了实现尿塔内动态的实际转化率x实与静态测定的平衡转化率一致。
以上即是UTI逆流等温尿素合成塔的设计思路。
上述思路要工业实施还有一些热力学问题需解决。
第一,盘管内高温的创建。由热力学第二定律可知,热量传递必须从高温端向低温端,故而欲将盘管内放出的热量向尿塔溶液传递,则盘管内的甲铵反应必须在高于尿液温度的条件下进行。第二,盘管内物流温度分布。因尿塔温度为顺置分布,下低上高。故盘管内温度分布也应配置成上高下低,且上端温度最高,以实现两者的热传递。下文详细展开。
4 UTI逆流等温尿素合成工艺参数及流程
4.1 UTI典型的合成工艺条件[6]
压力p21.38 MPa,温度 192 ℃
NH3/CO24.2(摩尔比),H2O/CO20.85
典型的合成塔温度分布
顶部进入盘管混合器Lin187 ℃
盘管入口L0196 ℃
盘管L0-L1194 ℃
与氨混合后(合成底部)L2180 ℃
合成塔出口溶液L3192 ℃
x实73%
4.2 流程(图7)

图7 UTI逆流等温尿塔示意图
物流说明
(1)顶部进入盘管混合器的物料Lin
由三股物料组成:F1——返回的中压甲铵液(115 ℃);F2——CO2原料气(60%);F3——70%的进料液氨(105 ℃)。此三股物流一起进入尿塔顶部混合器(t187 ℃),理想混合后,将物料均匀分配至十字盘管,进入各支配管,支配管是由多股支盘管组成的换热盘管。降低顶部物料的NH3/CO2,使混合物创建高温条件,在21.38 MPa高压状态下,L0的温度会升高到196 ℃左右。该温度高于合成出塔液温度192 ℃,为两者之间的正常换热创造了条件。
(2)盘管内物流L0-L1
盘管内物流由上而下流动。当十字盘管内的高温物流与管外冷液流(即尿塔内合成熔融液)逆向接触,基于管壁两边存在温度差,盘管内的气态CO2与NH3会发生甲铵生成反应,而溶解于氨-甲铵熔融液中,反应放出的热量通过管壁源源不断地传递给管外,作为甲铵脱水转化为尿素所需的热量。盘管内温度则由最高点196 ℃逐渐降低,至L1点194 ℃左右。
(3)盘管外尿塔内物流L2
盘管内的混合物到达合成塔底部时(L1),从盘管开口端排出,与从合成塔底部进入的约30%的预热液NH3(温度约105 ℃)混合,温度降为180 ℃左右。混合后成为L2,即尿塔底部的氨-甲铵熔融液,尿素含量近于零。L2基本为全液相。
L2向上缓慢流动。随着时间的推移,溶液中的甲铵发生脱水反应,生成尿素和水。反应所需热量来自于盘管内气态CO2生成甲铵而放出的热量。随着尿素转化率的升高,溶液中高沸点物质尿素和水的浓度逐渐升高,溶液的沸点亦逐渐升高,故而上行之尿素合成溶液的温度也随之升高,此过程一直持续到塔顶,几乎达化学平衡。温度由塔底的180 ℃升至192 ℃。
下面将用热力学分析法来考察UTI提供的各温度点的性质和特点,并讨论尿塔内的全液相流、盘管设置要求等等,供参考。
5 UTI逆流等温尿素合成的热力学分析
高压条件下尿素物系的热力学、动力学模型是解读UTI工艺合成反应过程参数的钥匙。
为此,本文构筑了UTI尿素合成条件下的相图,用来讨论逆流等温尿素合成反应过程。
图8(a)由三个t-NH3/CO2相图组成。
p22 MPa条件下NH3-CO2(H2O/CO20.85)似二元相图,介稳态,无尿素,见B1Z1C1。B1Z1C1阴影包络部分为液相区,之外是气液共存区或气相区[示于图8(b)]。
p17 MPa条件下NH3-CO2(H2O/CO20.85)似二元相图,稳态,见B2Z2C2。B2Z2C2阴影包络部分为液相区,之外是气液共存区或气相区。
p22 MPa条件下NH3-CO2(H2O/CO20.85)似二元相图,稳态,见B3Z3C3。B3Z3C3阴影包络部分为液相区,之外是气液共存区或气相区。
有了上述三个相图,就可以分析UTI尿素合成反应过程。p22 MPa亚稳态相图可以用来描述入塔三物料之混合过程及之后在盘管内物料的化学反应复合化工过程。
p17 MPa稳态相图可以用来分析盘管之外尿塔内物系的合成反应复合化工过程。

图8 压力p 22 MPa条件下NH3-CO2(H2O/CO2 0.85)似二元介稳态和稳态相图
图8(a)中第一个相图——p22 MPa介稳态相图,即B1Z1C1是不完全相图,图中只绘出了液相线。因此,该图难以描述气液共存状态下物系的变化规律。而图8(b)是其完全相图,绘有平衡态气相线,可以详细分析物系在气液共存状态下的变化规律。
下面用图8对UTI逆流等温尿素合成的反应过程作剖析。
5.1 顶部物料NH3/CO2的热力学分析
为了创建顶部高温,首先必须确定合理的NH3/CO2。由亚稳态相图可知,物系在共沸点(NH3/CO23.0~3.1)Z1溶液沸点温度t3约198 ℃,是相图最高点。共沸点两边的溶液沸点均下降。在合成工艺条件NH3/CO2为4.2时,沸点降为180 ℃左右。因此,为了创建顶部高温,必须调整物料的NH3/CO2。
考虑到操作波动性,共沸点NH3/CO23.0~3.1并不适宜。将NH3/CO2选择在4.2~3.1之间偏共沸点的优惠值最为合理。由物料衡算可知,UTI选择的顶部物料NH3/CO2之值为3.4。此时计算得顶部加入的原料液氨为70%,底部加入30%。由此可在亚稳态相图上作出合成顶部物料操作线E-E′。
5.2 混合过程的热力学分析
进入合成塔顶部的物料有三股:返回的中压甲铵液(液态);原料CO2气(超临界态),60%;原料液氨(亚临界态),70%。顶部物料的操作线为E-E′,其混合过程系统性质的变化可用EE′线说明。
在理想状态下,其混合过程可以描述如下。
(1)超临界态CO2(g)和亚临界态液氨(l1),经气液主体[液相主体为返回的甲铵液(l2)]的气膜层、液膜层扩散转移至液相主体,并溶入主体流,放出热量Q1。
(2)液相主体流中的液NH3(l2)与液CO2(l2)反应生成液态甲铵并放出强热量Q2,化学反应式如下:

(3)在绝热条件下,放出的热量使混合物温度升高,图8(a)、(b)中的操作线EE′可用来描述物系在升温过程中的相平衡变化规律。
由相图性质可知,EE′液态(氨-甲铵熔融态)物系的沸点E2为194 ℃。在194 ℃以下物系保持液态,物系压力小于外压(即操作压力)p22 MPa。温度大于194 ℃时,EE′物系在外压下呈气液共存状态。
甲铵生成反应是强放热反应。在绝热状态下,放出的热量Q2将促使100 ℃左右的EE′物料之温度急剧升高,经过E1187 ℃,继续升高,直到E2,194 ℃沸点状态,此时物系压力p物=p外。若此时热量仍有多余,将使液态甲铵分解为CO2和NH3气体,物系温度亦将继续升高,在外压下物系成为气液共存状态(平衡态)。当物系到达E3时ΔQ=0,由相图[图8(a)、(b)]得t196 ℃,液相为x1,气相为y1。
由此可见,UTI低NH3/CO2的顶部进料,仍存在过热现象,即发生液态甲铵再分解为CO2和NH3的现象。但是这一现象是在高温下(194~196 ℃)进行,并且据分析是在进入盘管后发生的。创建的高温为之后盘管的甲铵生成热向尿塔溶液传递创造了条件。
另外,值得关注的是相图上液相状态点E1,187 ℃,其对应于流程图(图7)为混合器入口点Lin,说明进入混合器的物系为液相,无气相。
混合器兼具分配器功能。混合器输出的液态物流,为溶液均匀分布到各支盘管提供了有力保障。若为气液混合,则均匀分配到支盘管是困难的。
本文已用热力学分析法考察了流程图(图7)上各关键温度点,详见表3。

表3 UTI流程图各温度点的位置及性质
5.3 盘管内物系的热力学分析
UTI设置十字盘管的目的为,将盘管内的气相CO2和NH3冷凝,生成甲铵液,并将甲铵反应热传递至盘管外面的尿素合成液,以作为溶液中甲铵脱水转化为尿素所需之热。
由热力学第二定律知,热量传递转移的条件是高温物料之热量向低温物料转移。若盘管内物料的温度低于盘管外的温度,那么必然会进行相反的过程,即盘管外热量向盘管内传递,这样,盘管内物料的放热反应也就不可能进行,具体来讲,盘管内甲铵生成反应也就不可能进行。由此可见,调节塔顶物料配比使之呈高温状态是实现热量传递的重要条件。
UTI将顶部物料的NH3/CO2设置为3.4,由相图E-E′线可得在绝热状态下,温度可升高到196 ℃。为实现盘管内热量向盘管外转移创造了条件。
若NH3不作顶底两部分分配,而全部从塔顶加入,也即物系NH3/CO2不加调整,为原始进料值4.2,则在相图(图7)B1Z1C1上可得其组成线为F-F′。可以分析,在p22 MPa下其终态气液共存平衡物系的温度将定格在184 ℃。在如此低的温度下,当然不可能将盘管内的热量向管外转移,气相中的NH3与CO2也就不可能冷凝生成甲铵了。这样盘管等于白设了。
接下来考察UTI设置的盘管在正常状态下发生的热力学过程。
UTI盘管内的热力学过程有二:第一步为热物流形成阶段;第二步为主体部分,热物流中的热量从高温向低温转移。
(1)盘管初始段,Lin→L0
冷物流转变为热物流过程。
前已述,以UTI提供的温度数据为基础,用热力学分析法,可知从混合器输出至各支盘管的物料是过热态熔融液。热熔融液在各支盘管内均匀分配并释放热量,使物系温度升高达到沸点194 ℃,继而发生部分液态甲铵分解为气态CO2和NH3的现象。这时原为纯液态的物系转化为高温呈平衡态的气液两相物系L0。
各支盘管内的终态物料L0,在相图(图8)上对应点为E3,温度196 ℃,为气液共存平衡状态。
经过上述过程入盘管的冷物流已转化为热物流,其过程的热力学分析前已述。本过程各节点的温度变化示于图9。

图9 UTI尿塔物料温度变化示意图
从Lin到L0是一段变化极快,但物料向下移动距离很短的一段,估计约0.5 m,占盘管的很小一部分。但本过程十分重要,为后续盘管向管外溶液传递热量创造了条件。
(2)盘管主体传输热量段,L0→L1
当盘管内气液两相共存物料L0往下流动时,接触盘管外冷物料尿素合成液L3,t192 ℃,由于盘管内的温度(196 ℃)高于管壁外的温度(192 ℃),导致L0中热量向管壁外溶液L3传递,L0温度下降,物系由气液平衡态变成液态,因而在气液之间存在传质推动力,气相中的CO2与NH3冷凝为液态甲铵,化学反应式为:

放出的甲铵反应热QAM输送给盘管外的尿素合成液,作为甲铵脱水热QU,反应式如下:

这样盘管内热物料L0在往下流动过程中,气态CO2与NH3不断冷凝,放出的甲铵反应热源源不断传递给管外,供作尿素生成热。此过程一直持续到L1。
上述的热力学过程用相图来说明更为清晰:图8(b)中的E3对应于L0物料,E3物系是一气液共存物系,平衡态时液相为x1,气量为y1,t196 ℃。
由于E3物系向外界输出热量,E3温度下降,液相量增加x2,气相量降低y2。在理想状态下,最终物系到达E2,194 ℃,沸点状态,物系中气相CO2和NH3全部冷凝进入液相。以全液相的物流输出。
盘管内温度变化见图9,从塔顶以下1 m处的L0(196 ℃)气液物料共同往下流,温度微降,直到塔底,成为全液相物流L1,温度194 ℃。
(未完待续)

