结缔组织病相关肺高压70例临床分析
董佳慧 孙耕耘 尤青海
肺高压(pulmonary hypertension, PH)在结缔组织病(connective tissue disease, CTD)患者中并不少见,是影响CTD患者预后的重要因素[1-2]。近年来,随着对其重视程度的提高以及更多治疗手段的应用,结缔组织病相关肺高压(CTD-PH)患者的临床症状及预后得到了改善[3]。但CTD-PH起病隐匿,临床症状缺乏特异性,往往难以早期诊断。本研究通过回顾性研究CTD-PH患者的临床资料,探讨其临床特点及相关危险因素,以提高对该病的认识。
资料与方法
一、研究资料
随机选取2013年1月至6月入住我院风湿免疫科行超声心动图检查检出肺高压的CTD患者70例,并随机选取同期住院行超声心动图检查未检出肺高压的CTD患者69例作为对照组,收集其临床资料。全部患者均符合美国风湿病协会制订的各类CTD的诊断标准(1987年类风湿关节炎诊断标准、1997年系统性红斑狼疮诊断标准、2002年修订的原发性干燥综合征国际分类标准和1980年系统性硬化病分类诊断标准等) 和1975年Bohan/Peter炎症性肌病诊断标准。肺高压(PH)的诊断标准为海平面状态下、静息时、彩色多普勒超声心动图(UCG)示肺动脉平均压>3.3 kPa (1 kPa=7.5 mmHg)或肺动脉收缩压>4.0 kPa[4]。
二、研究方法
根据超声心动图检查结果有无肺高压,将139例CTD患者分为CTD-PH组(70例)和对照组(69例)。将两组患者的临床表现和辅助检查资料进行比较。
三、统计学分析
应用SPSS 13.0统计学软件进行数据分析。计量资料采用均数±标准差(正态分布)或中位数及四分位数间距(非正态分布)描述,组间比较采用t检验(正态分布)或秩和检验(非正态分布);计数资料采用构成比和率描述,组间比较采用卡方检验;变量间的相关分析采用Pearson积矩相关分析(正态分布)或秩相关(非正态分布);P<0.05表示差异有统计学意义。
结 果
一、一般资料
139例CTD患者中系统性红斑狼疮(systemic lupus erythematosus, SLE)患者55例,类风湿关节炎(rheumatoid arthritis, RA)49例,炎症性肌病(PM/DM)13例,系统性硬化病(sjögren sclerosis, SSc)6例,干燥综合征(sicca syndrome, SS)5例,血管炎病3例(其中,ANCA相关性血管炎2例,贝赫切特病1例),未分化的结缔组织病8例。CTD-PH组包括SLE 28例,RA 25例,PM/DM 7例,SSc 4例,SS 2例,血管炎1例,未定型的结缔组织病3例。
CTD-PH组与对照组在性别、年龄、病程和有无药物过敏史上无显著差异。
二、临床表现及辅助检查结果
1.临床表现:CTD-PH组有呼吸系统症状者30例,占42.86%。其中2例患者以呼吸系统症状为首发症状。活动后胸闷/气短17例(24.29%)、干咳13例(18.57%)、咳痰7例(10%)、痰血1例(1.43%)、胸痛1例(1.43%)。无呼吸系统症状者40例,占57.14%。对照组有呼吸系统症状者29例,与CTD-PH组无统计学差异。雷诺现象发生率在两组之间亦没有统计学差异,见表1。
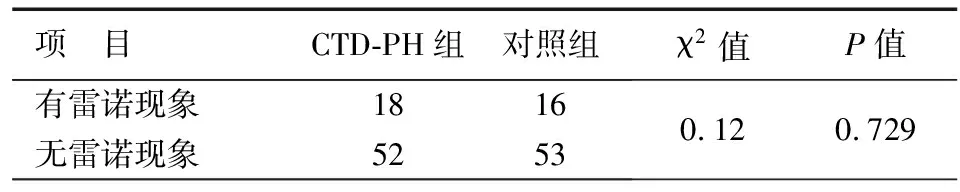
表1 CTD-PH组与对照组雷诺现象的比较
本研究共纳入合并存在间质性肺疾病(interstitial lung disease, ILD)的患者28例,其中有呼吸系统症状者21例;无ILD的患者111例,其中38例存在呼吸系统症状;二者具有统计学差异(χ2值15.211,P=0.000)。
2.自身抗体:各自身抗体(抗核抗体、抗组蛋白抗体、抗核小体抗体、抗着丝点B蛋白抗体、抗双链DNA抗体、抗JO-1抗体、抗La/SS-B抗体、抗核糖体P蛋白抗体、抗SS-A(52)抗体、抗SS-B(60)抗体、抗SCL-70抗体、抗SmD1抗体、抗核糖核蛋白抗体及抗心磷脂抗体)的阳性率在两组间的差异无统计学意义。
3.超声心动图检查:全部患者均行超声心动图检查,测量肺动脉压 (PAP),CTD-PH组PAP为34(33~38)mmHg,对照组PAP为27(25~29)mmHg。CTD-PH组射血分数(ejection fraction, EF)为0.67(0.63~0.70);对照组EF值为0.66(0.63~0.70);两组之间无统计学差异(P=0.423)。
4.其他实验室检查: 血尿酸水平与PAP成正相关,见表2。
(1)尿酸水平:两组资料比较显示CTD-PH组尿酸水平为(306.67±112.98)μmol/L,高于对照组(249.58±95.74)μmol/L,其差异有统计学意义(P=0.002);血尿酸水平与PAP成正相关(r=0.235,P=0.008),见图1。
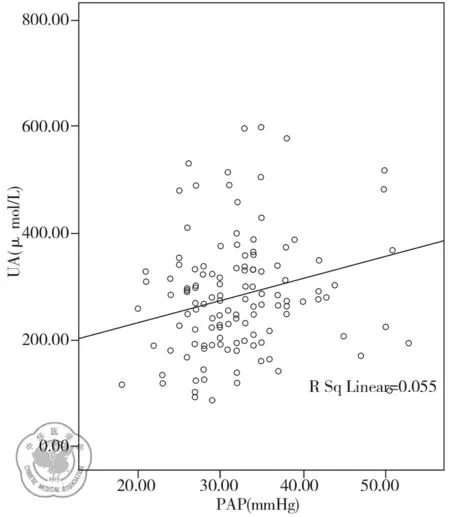
图1 血尿酸水平与PAP成正相关(r=0.235,P=0.008)
(2)白蛋白:CTD-PH组白蛋白水平为(34.77±7.56)g/L,低于对照组(37.92±6.55)g/L,其差异有统计学意义(P=0.010);白蛋白水平与PAP成负相关(r=-0.228,P=0.016),见图2。
(3)炎症指标: 两组资料比较显示CTD-PH组血沉水平为(58.35±33.43)mm/h,高于对照组 (47.41±27.48)mm/h;其差异有统计学意义(P=0.041)。血沉水平与PAP成正相关(r=0.248,P=0.005);纳入白蛋白水平对血沉的影响后分析得出(r=0.187,P=0.038),该结果仍具有统计学意义。C反应蛋白在两组间无统计学差异。

图2 白蛋白水平与PAP成负相关(r=-0.228,P=0.016)
(4)24 h尿蛋白定量:24 h尿蛋白定量测定水平在两组间无统计学差异(P=0.490),但尿蛋白水平与白蛋白水平呈负相关(r=-0.352,P=0.000)。
(5)止凝血系列:CTD-PH组纤维蛋白降解产物(fibrin degradation products, FDPs)水平为5.78(2.70~9.95)μg/ml,高于对照组3.30(1.75~6.65)μg/ml,差异有统计学意义(P=0.016)。FDPs水平与PAP呈正相关(r=0.211,P=0.03)。CTD-PH组血浆凝血酶时间(thrombin time, TT)为(18.29±1.52)s,高于对照组(17.54±1.47)s,差异有统计学意义(P=0.005)。凝血酶原时间、纤维蛋白原及D-二聚体等在两组之间无统计学差异。
讨 论
据报道,在各种结缔组织病中,系统性硬化病、混合性结缔组织病和系统性红斑狼疮患者肺高压较为常见,其患病率分别为7.5%~12%、23%~50%、0.5%~14%。多发性肌炎/皮肌炎、类风湿性关节炎、未分化结缔组织病及干燥综合征中肺高压患病率相对较低[1-2]。诊断肺高压的金标准是右心导管检查,但其有创性影响了临床推广应用。无创检查中首选超声心动图,其敏感度为79%~100%,特异度为60%~98%[5-6];提示肺高压的征象有:三尖瓣反流(tricuspid regurgitation, TR)速度>2.8 m/s,右心室及心房扩大等。因而,结合临床实际,本研究选用超声心动图测量PAP。
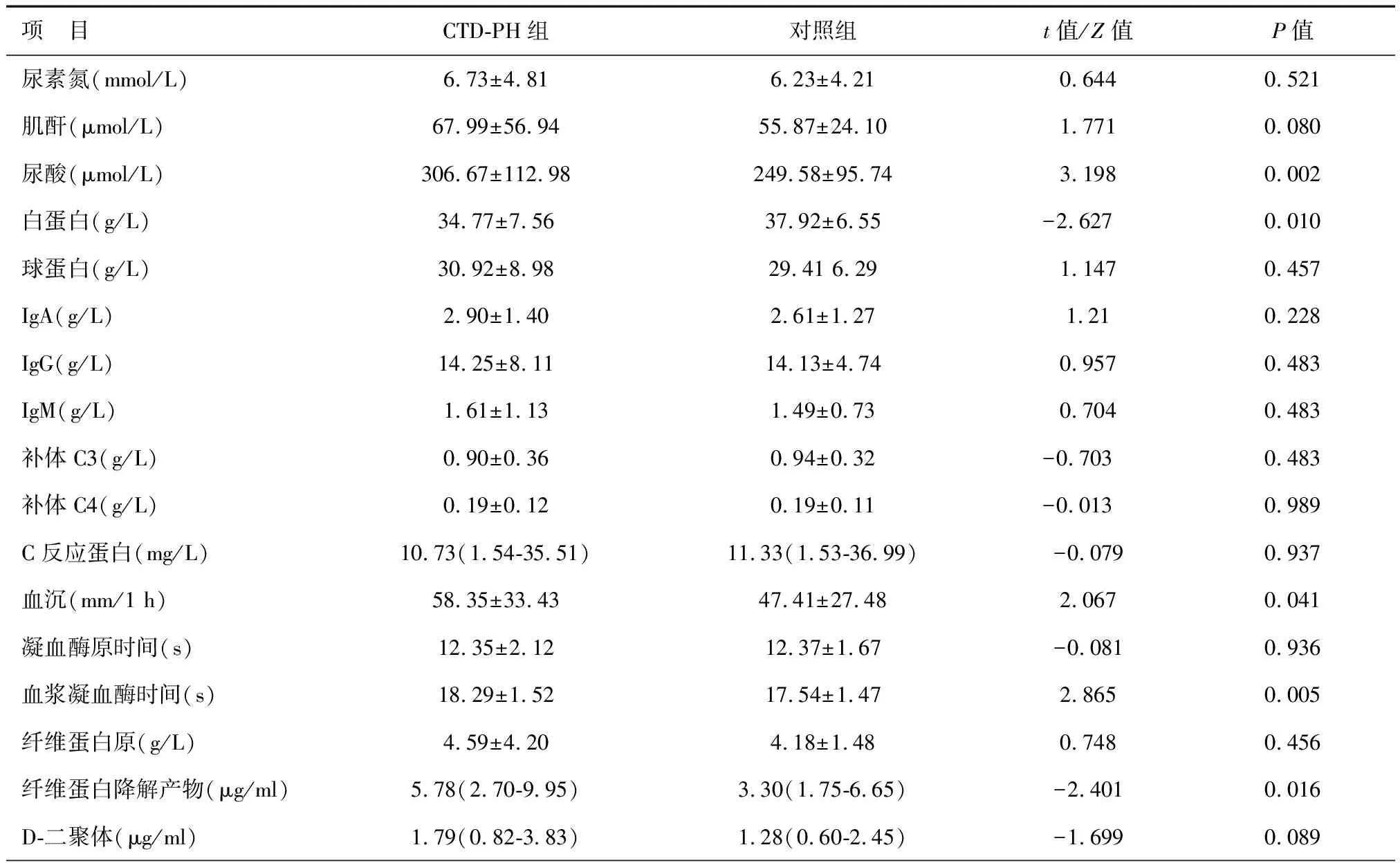
表2 CTD-PH组与对照组其他实验室指标的比较
本研究中,CTD-PH组与对照组间呼吸系统症状发生率无统计学差异。因此,肺高压患者的呼吸系统症状无特异性,不能用作早期诊断。相比之下,ILD则与呼吸系统症状存在一定的相关性。同时,因选取患者均为住院病例,其中24例患者存在呼吸系统感染等常见可引起呼吸系统症状的疾病,可能存在对结果的干扰。另外,本研究数据显示两组之间的雷诺现象发生率并无显著差异。这与既往一些研究得出的结论不同,可能与患者病例入选标准差异等有关,尚有待于扩大样本量,或行前瞻性研究等进一步明确。
本组资料结果显示血尿酸水平与PAP成正相关,且CTD-PH组血尿酸水平高于对照组,这与国外报道的结果相一致[7-8]。其机制可能如下:①肺高压患者存在组织缺氧,三磷酸腺苷消耗增加,产生腺嘌呤核苷酸增多,激活黄嘌呤氧化还原酶,导致尿酸产生增加;②肺高压合并心衰时有机阴离子转运体功能障碍,造成肾近端小管对尿酸盐的重吸收增加;③尿酸水平增高刺激肺血管内皮细胞精氨酸酶的产生,从而降低局部左旋精氨酸的水平,导致一氧化氮(NO)生成减少[8]。尿酸还可对抗乙酰胆碱对肺血管的扩张作用。尿酸可激活产生缩血管物质(如环氧化酶-2、血栓素、肾素、血管紧张素Ⅱ、醛固酮)作用于肺血管平滑肌导致血管收缩[7,10-11];④动物实验表明,高尿酸血症可导致小血管硬化,病理表现为中膜增厚、平滑肌细胞增生和管腔狭窄[12]。降低血尿酸水平可以阻滞血管病变进展。尿酸还具有促炎作用,如促进白细胞介素-1β(interleukin-1β, IL-1β)的产生和单核细胞催化因子-1(monocyte chemotactic protein-1, MCP-1)在血管细胞中的释放;以上细胞因子参与了血管重塑[13]。综上所述,血尿酸水平升高导致肺血管内皮细胞功能障碍,引起肺血管收缩,造成肺高压;血管重塑和炎症也参与其发病机制。有报道血尿酸与肺高压患者生存呈独立相关,是评估肺高压患者病情严重性和治疗反应性[14],以及预测病死率的重要标志[15-17]。降尿酸治疗能否用于治疗肺高压尚有待进一步研究。
血清白蛋白水平被证明是多种类型肺高压的危险因素。Kawut等[18]研究表明,白蛋白水平与特发性肺动脉高压(idiopathic pulmonary arterial hypertension, IPAH)患者的生存率相关,白蛋白水平较高者预后较好。Unal等[19]研究显示在持续性腹膜透析患者,血清白蛋白水平是发生肺高压的主要危险因素,并与PAP成负相关。本研究提示CTD-PH组白蛋白低于对照组,且白蛋白水平与PAP成负相关。尿蛋白水平与白蛋白水平负相关,提示可能存在白蛋白的慢性丢失。目前,透析治疗的慢性肾衰竭所致的肺高压正日益受到重视,尿毒症的血管病变与肺血管病变的相关性也受到更多的关注。Chayawee等[20]行Meta分析提示:系统性硬化病患者的各类脏器并发症(如:肺高压、肾危象和肌炎等)发生率均占15%左右。这一结果提示,CTD患者各脏器功能损害可能存在共同的病理生理基础。除考虑到慢性丢失对白蛋白水平的影响,尚不能排除肝脏的合成功能异常对白蛋白水平的影响。受肝脏活检病理学发展的限制,CTD对肝脏的影响尚未引起重视。在继肺脏和肾脏之后,CTD患者肝脏结构和功能的变化值得进一步研究。
炎症指标和自身抗体与CTD-PH间是否具有相关性尚有争议。Quarck等[21]研究表明,IPAH和慢性血栓栓塞性肺高压(chronic thromboembolic pulmonary hypertension, CTEPH)患者C反应蛋白较正常人群升高;且CRP水平与心功能分级、右房压及治疗的反应性有关。而本研究则显示CTD-PH患者中CRP升高无统计学意义,这与国内一些研究相一致。这提示了CTD-PH与IPAH、CTEPH等发病机制之间可能存在差异,即:炎症反应在CTD-PH发病机制中作用的不确切性;从而解释了免疫抑制治疗对CTD-PH患者效果不佳的原因。本研究中,血沉在两组之间具有统计学差异,且与PAP正相关,考虑到两组之间白蛋白水平差异的影响,即使采用统计学方法以减小白蛋白水平对结果的干扰后仍提示血沉在两组之间具有统计学差异,其结果仍需进一步研究验证。CTD-PH组与对照组相比,FDPs水平升高,血浆凝血酶时间延长。而凝血酶原时间、纤维蛋白原及D-二聚体等在两组之间无统计学差异。以上结果提示存在原发性纤溶现象。近年来,国内外少有相关方面的研究,而目前对CTD-PH是否应用抗凝药物仍有争议,进一步研究相关机制将更有助于临床实践。
由于本研究属回顾性分析,相关评价和检查资料不够完全,导致本研究内容相对局限。今后尚需更多地进行前瞻性研究。
参 考 文 献
1 Condliffe R, Kiely DG, Peacock AJ, et al. Connective tissue disease-associated pulmonary arterial hypertension in the modern treatment era [J]. Am J Respir Crit Care Med, 2009, 179 (2): 151-157.
2 Mathai SC, Hassoun PM. Pulmonary arterial hypertension in connective tissue diseases[J]. Heart Fail Clin, 2012, 8(3): 413-425.
3 董佳慧, 孙耕耘. 结缔组织病相关肺动脉高压的研究进展[J/CD]. 中华肺部疾病杂志: 电子版, 2014, 7(1): 104-107.
4 British Cardiac Society Guidelines and Medical Practice Committee, and approved by the British Thoracic Society and the British Society of Rheumatology. Recommendations on the management of pulmonary hypertension in clinical practice[J]. Heart, 2001, 86 Suppl 1: 1-13.
5 Vachiéry JL, Coghlan G. Screening for pulmonary arterial hypertension in systemic sclerosis[J]. Eur Respir Rev, 2009, 18(113): 162-169.
6 Rajaram S, Swift AJ, Capener D, et al. Comparison of the diagnostic utility of cardiac magnetic resonance imaging, computed tomography, and echocardiography in assessment of suspected pulmonary arterial hypertension in patients with connective tissue disease[J]. J Rheumatol, 2012, 39(6): 1265-1274.
7 Zharikov SI, Swenson ER, Lanaspa M, et al. Could uric acid be a modifiable risk factor in subjects with pulmonary hypertension? [J] Med Hypotheses, 2010, 74(6): 1069-1074.
8 Van Albada ME, Loot FG, Fokkema R, et al. Biological serum markers in the management of pediatric pulmonary arterial hypertension[J]. Pediatr Res, 2008, 63(3): 321-327.
9 Zharikov S, Krotova K, Hu H, et al. Uric acid decreases NO production and increases arginase activity in cultured pulmonary artery endothelial cells[J]. Am J Physiol Cell Physiol, 2008, 295(5): C1183-1190.
10 Yu MA, Sánchez-Lozada LG, Johnson RJ, et al. Oxidative stress with an activation of the renin-angiotensin system in human vascular endothelial cells as a novel mechanism of uric acid-induced endothelial dysfunction[J]. J Hypertens, 2010, 28(6): 1234-1242.
11 Corry DB, Eslami P, Yamamoto K, et al. Uric acid stimulates vascular smooth muscle cell proliferation and oxidative stress via the vascular renin-angiotensin system[J]. J Hypertens. 2008, 26(2): 269-275.
12 Mazzali M, Kanellis J, Han L, et al. Hyperuricemia induces a primary renal arteriolopathy in rats by a blood pressure-independent mechanism [J]. Am J Physiol Renal Physiol, 2002, 282(6): F991-997.
13 Gasse P, Riteau N, Charron S, et al. Uric acid is a danger signal activating NALP3 inflammasome in lung injury inflammation and fibrosis[J]. Am J Respir Crit Care Med, 2009, 179(10): 903-913.
14 Jiang X, Han ZY, Wang Y, et al. Hemodynamic variables and clinical features correlated with serum uric acid in patients with pulmonary arterial hypertension [J]. Chin Med J (Engl), 2008, 121(24): 2497-2503.
15 Bendayan D, Shitrit D, Ygla M, et al. Hyperuricemia as a prognostic factor in pulmonary arterial hypertension [J]. Respir Med, 2003, 97(2): 130-133.
16 Njaman W, Iesaki T, Iwama Y, et al. Serum uric Acid as a prognostic predictor in pulmonary arterial hypertension with connective tissue disease [J]. Int Heart J,?2007, 48(4): 523-532.
17 Dimitroulas T, Giannakoulas G, Dimitroula H, et al. Significance of serum uric acid in pulmonary hypertension due to systemic sclerosis: a pilot study [J]. Rheumatol Int, 2011, 31(2): 263-267.
18 Kawut SM, Horn EM, Berekashvili KK, et al. New predictors of outcome in idiopathic pulmonary arterial hypertension [J]. Am J Cardiol, 2005, 95(2): 199-203.
19 Unal A, Sipahioglu M, Oguz F, et al. Pulmonary hypertension in peritoneal dialysis patients: prevalence and risk factors[J].Perit Dial Int, 2009, 29(2): 191-198.
20 Muangchan C, Canadian Scleroderma Research Group, Baron M, et al. The 15% Rule in Scleroderma: The Frequency of Severe Organ Complications in Systemic Sclerosis. A Systematic Review[J]. J Rheumatol, 2013, 40(9): 1545-1556.
21 Quarck R, Nawrot T, Meyns B, et al. C-reactive protein: a new predictor of adverse outcome in pulmonary arterial hypertension [J]. J Am Coll Cardiol, 2009, 53(14): 1211- 1218.

