醛固酮与慢性肺源性心脏病肺动脉高压的相关性研究
覃淑娟 陈昌枝
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)主要的病理基础是气道、肺实质、肺血管的慢性非特异性炎症,炎症损伤和修复导致气道和血管壁重塑,从而引起进行性气流受限及慢性缺氧,其后期往往出现肺动脉高压而导致慢性肺源性心脏病发生[1]。肺动脉高压是COPD的重要合并症,其病理特征为肺动脉平滑肌细胞增殖导致肺动脉血管重塑,其确切发病机制尚未明确[2]。本研究目的旨在探讨肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system, RAAS)中的醛固酮是否参与了肺心病肺动脉高压的形成。
资料与方法
一、临床资料
选择2012年1月至2013年12月我院呼吸内科收治的COPD患者90例,均符合2007 年中华医学会关于COPD的诊断标准[3],肺功能具有不完全可逆的气流受限,吸入支气管扩张剂后,1 s用力呼气量(forced expiratory volume in one second, FEV1)<80%预计值,FEV1/FVC<70%。根据COPD患者病情分为COPD并肺动脉高压组,肺心病肺心功能代偿期组,慢性肺源性心脏病肺心功能失代偿期组。
COPD并肺动脉高压组:30例患者均符合2004年美国胸科医师学会(ACCP)及欧洲心脏病学会(ESC)制定肺动脉高压诊断标准[4-6],及超声心动图检查提示肺动脉高压的标准[7],但无右心室肥大表现。其中男20 例,女10 例,平均年龄为( 67.82±9.02) 岁。
慢性肺源性心脏病肺心功能代偿期组:30例患者为确诊COPD 10年以上,病程迁延并发展,符合1977年我国修定的 “慢性肺源性心脏病诊断标准”,同时符合卫生部统编第七版内科学教材慢性肺源性心脏病肺心功能代偿期的诊断标准。其中男23例,女7例,平均年龄为(69.38±8.75) 岁。
慢性肺源性心脏病肺心功能失代偿期组:30例患者为确诊COPD 10年以上,病程迁延并发展,符合1977年我国修定的 “慢性肺源性心脏病诊断标准”,同时符合卫生部统编第七版内科学教材慢性肺源性心脏病肺心功能失代偿期的诊断标准。其中男22例 ,女8例,平均年龄为(70±5.65)岁。
所有3组研究对象均经询问病史、体格检查、相关实验室检查及辅助检查等排除先天性心脏病、风湿性心脏病、原发性心肌病、冠状动脉粥样硬化性心脏病、肺血管疾病、支气管扩张、肺血管栓塞、支气管哮喘、原发性及继发性高血压、糖尿病、结缔组织疾病及其它可能影响心功能、肺动脉压、肺通气及换气功能的疾病。所有3组研究对象在检查前均通过医院伦理委员会讨论并被告知相关检查的目的与检查方法,且均签署知情同意书,自愿接受检查。
二、仪器及试剂
主要仪器:意大利COSMED Quark PFT3肺功能仪,PHILIPSIE35心脏B超机,德国西门子血气分析仪,DFM-96型多管放射免疫计数器,醛固酮定量检测试剂盒比利时RADIM公司提供。日本三洋电气公司MCE-192冰箱,北京京立离心机有限公司生产的LD5-2A型台式低速离心机。
三、研究方法
1. 醛固酮检测:所有对象于清晨空腹卧位采肘静脉血,将3 ml血立即注入含有EDTA的试管, 以离心半径8 cm,3000 r/min 离心10 min,分离血浆,置-20 ℃低温冰箱保存,按照试剂盒操作说明,采用放射免疫免疫分析法,将待测样品中的醛固酮和125I-醛固酮与有限的ALD 抗体在适宜条件下进行竞争性结合反应。125I-醛固酮与抗体结合的比例决定于待测样品或标准品中非标记的醛固酮的含量。抗原抗体复合物用分离试剂沉淀下来,采用DFM-96型多管放射免疫γ计数器测定复合沉淀物的放射性计数。
2. 心脏彩超检查:均由一名经验丰富的副主任医师使用彩色多普勒超声心动图仪操作。用连续波Doppler法(CW)根据返流压差估测肺动脉压[8]。取三尖瓣返流频谱,选择心尖四腔心切面,取样容积置于三尖瓣返流束起始处,取样线方向同样尽量平行于返流束方向,测得三尖瓣返流最高流速,根据简化Bernoulli方程(ΔP=4V2,V为最大返流速度) 可求得右心室与右心房之间压差。若无右室流出道梗阻,肺动脉收缩压(sPAP)与右心室收缩压(sRVP)相似,即: sPAP=sRVP=右房压(RAP) +三尖瓣跨瓣压差(ΔP)。通过二维超声心动图测量左房右房横径,右室舒张末内径(RVEDD)、左室舒张末内径(LVEDD),右心室流出道内径、右心室内径、右心室前壁厚度等。
3. 动脉血气分析:在未予吸氧的条件下,取桡动脉血2 ml, 用德国西门子全自动血气分析仪测定动脉血氧分压( partial pressure of oxygen, PaO2)、 血二氧化碳分压( partial pressure of carbon dioxide, PaCO2)等血气指标测定。
四、统计学方法
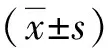
结 果
一、临床资料比较
比较各组间的临床资料,年龄、体重指数、吸烟指数差异无统计学意义(P>0.05),在肺功能FEV1占预计值比较上,慢性肺源性心脏病失代偿期组的FEV1占预计值低于COPD并肺动脉高压组、慢性肺源性心脏病代偿期组,差异有统计学意义(P<0.05),见表1。
二、患者血浆醛固酮浓度、肺动脉压力、PaO2、PaCO2
3组患者血浆醛固酮浓度、肺动脉压力、PaO2、PaCO2比较,差异均有统计学意义(P<0.05),其中慢性肺源性心脏病失代偿期组的醛固酮水平、肺动脉压、二氧化碳分压均高于COPD并肺动脉高压组、慢性肺源性心脏病代偿期组,差异有统计学意义(P<0.05)。慢性肺源性心脏病失代偿期组的动脉血氧分压水平低于COPD并肺动脉高压组、慢性肺源性心脏病代偿期组,见表2。
三、血浆醛固酮水平与肺动脉压力、PaO2、PaCO2和FEV1占预计值的相关性
血浆醛固酮水平与肺动脉压力成线性正相关(r=0.514,P=0.001),与血氧分压呈负相关(r=-0.248,P=0.019),差异均有统计学意义。血浆醛固酮水平与二氧化碳分压、FEV1%无相关(分别为r=0.155P=0.146,r=-0.078P=0.464),差异无统计学意义。
讨 论
醛固酮是RAAS系统中的重要组成部分,是最强的盐皮质激素。目前的研究发现,醛固酮对心血管系统的影响除了引起潴钠排钾之外,还具有引起心肌纤维化、血管重塑、心室肥大等作用。肺动脉高压为COPD的常见并发症,表现为内皮细胞功能障碍和平滑肌细胞的异常增生,导致肺血管的异常收缩和远端肺小动脉的重构,进而出现中膜肥厚内膜增生丛状损害和血栓形成等病理改变,其病理特征为肺动脉平滑肌细胞的增殖导致肺动脉血管重塑[9]。因此,具有致心肌纤维化、血管重塑、心室肥大等作用的醛固酮可能参与了慢性肺源性心脏病肺动脉高压的形成。
本研究结果显示,慢性肺源性心脏病失代偿期组的醛固酮水平、肺动脉压水平均高于COPD并肺动脉高压组、慢性肺源性心脏病代偿期组,差异有统计学意义(P<0.05)。其原因可能为慢性肺源性心脏病失代偿期患者由于右心功能不全,肾素-血管紧张素-醛固酮系统被激活,导致醛固酮分泌增多,而严重右心功能不全可累及左心功能,使左房压增高,又可出现被动性肺动脉高压,从而导致肺动脉高压的严重程度增加。另外本研究也发现肺动脉压力随着醛固酮浓度的增加而升高,两者呈显著的正相关关系,这与徐红蕾等[10]报告一致,表明醛固酮与慢性肺源性心脏病患者的肺动脉高压有一定的相关关系。而肺动脉压力随着动脉血氧分压的降低而升高,两者呈低度负相关关系,表明缺氧亦参与了肺动脉高压的形成。

表1 3组间临床资料比较
注:与COPD并肺动脉高压组、慢性肺源性心脏病代偿期组比:aP<0.05

表2 3组间醛固酮浓度、肺动脉压、PaO2、PCO2比较
注:与COPD并肺动脉高压组、慢性肺源性心脏病代偿期组比:aP<0.05(1 mmHg=0.133 kPa)
COPD 引起的肺动脉高压属于一种多因性肺动脉高压,本研究结果显示醛固酮与肺肺动脉压力呈显著的正相关,血醛固酮浓度增加可致肺动脉高压进一步恶化,右心功能不全加重。其作用机制可解释为:①醛固酮通过激活盐皮质激素受体,可导致血管重塑与靶器官损伤[11];②醛固酮可刺激肺动脉平滑肌细胞增生致血管重塑,这种作用可被醛固酮受体拮抗剂依普利酮所抑制[12];③增多的醛固酮通过降低血管抗氧化能力导致血管内皮功能障碍,并损害血管反应性,增强氧化应激,并限制一氧化氮的生物活性[13];④增多的醛固酮激活交感神经系统,降低了压力感受器敏感性,增加电解质排泄量(K+,Mg2+),并参与细胞凋亡等[14];⑤醛固酮可激活炎症反应,通过增加纤溶酶原激活物抑制剂-1的表达和促进组织纤维化[15]。
肺动脉压的高低,直接影响到COPD患者的预后,如能早期有效地控制肺动脉高压,对于提高COPD患者的生存质量,改善预后,防止慢性肺源性心脏病的发生发展具有重要社会及经济效益。而目前COPD肺动脉高压形成机制复杂,涉及到基因、细胞、体液、分子等多因素的综合作用,其具体机制目前尚不完全清楚,因此醛固酮在COPD 肺动脉高压形成中的作用机制还有待进一步探讨。
参 考 文 献
1 董佳慧, 孙耕耘. 结缔组织病相关肺动脉高压的研究进展[J/CD]. 中华肺部疾病杂志: 电子版, 2014, 7(1): 104-107.
2 曾天星, 洪旭初. 慢性阻塞性肺疾病的表型及治疗[J/CD]. 中华肺部疾病杂志: 电子版, 2014, 7(2): 216-219.
3 中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病(COPD)诊治指南(2007年修订版)[J]. 中华结核和呼吸杂志, 2007, 30(1): 8-17.
4 Proceeding of 3nd World symposium on pulmonary arterial hypertension.Venice, Italy, June 23-25, 2003[J]. J Am Coll Cardiol, 2004, 43(2 Suppl S): 1S-90S.
5 Diagnosis and management of pulmonary arterial hypertension: ACCP evidence-based clinical practice guidelines[J]. Chest, 2004, 126(Suppl 1): 7S-10S.
6 Galiè N, Torbicki A, Barst A, et al. Guidelines on diagnosis and treatment of pulmonary arterial hypertension. The task force on diagnosis and treatment of pulmonary arterial hypertension of the european society of cardiology[J]. Eur Heart J, 2004, 25(24): 2243-2278.
7 McQuillan BM, Picard MH, Leavitt M, et al. Clinical correlates and reference intervals for pulmonary artery systolic pressure among echocardiographically normal subjects[J]. Circulation, 2001, 104(23): 2797-2802.
8 Berger M, Haimowitz A, Van Tosh A, et al. Quantitative assessment of pulmonary hypertension in patients with tricuspid regurgitation using continuous wave Doppler ultrasound[J]. J Am Coll Cardiol, 1985, 6(2): 359-365.
9 Bradford CN, Ely DR, Raizada MK. Targeting the vasoprotective axis of the renin-angiotensin system: a novel strategic approach to pulmonary hypertensive therapy [J]. Curr Hypertens Rep, 2010, 12(4): 212-219.
10 徐红蕾, 陈少贤, 蔡映云, 等. 醛固酮与肺心病患者肺动脉高压的关系[J]. 温州医学院学报, 2006, 36(4): 353-355.
11 Fiebeler A, Muller DN, Shagdarsuren E, et al. Aldosterone, mineralocorticoid receptors, and vascular inflammation[J] . Curr Opin Nephrol Hypertens, 2007, 16(2): 134-142.
12 Yamanaka R, Otsuka F, Nakamura K, et al. Involvement of the bone morphogenetic protein system in endothelin and aldosterone-induced cell proliferation of pulmonary arterial smooth muscle cells isolated from human patients with pulmonary arterial hypertension[J]. Hypertens Res, 2010, 33(5): 435-445.
13 Leopold JA, Dam A, Maron BA, et al. Aldosterone impairs vascular reactivity by decreasing glucose-6-phosphatede hydrogenase activity [J]. Nat Med, 2007, 13(2): 189-197.
14 Carey RM. Aldosterone and cardiovascular disease [J]. Curr Opin Endocrinol Diabetes Obes, 2010, 17(3): 194-198.
15 Gaddam KK, Verma A, Thompson M, et al. Hypertension and cardiac failure in its various forms[J]. Med Clin North Am, 2009, 93(3): 665-680.

