酵母双杂交筛选Clathrin相互作用蛋白
吕学军 陆卫忠 张永娟 郭 亮 李少莹 李玉英 钱桂生
急性肺损伤(acute lung injury, ALI)与急性呼吸窘迫综合症(acute respiratory distress syndrome, ARDS)是当前危重疾病领域最为重视的研究热点之一。长期以来,国内外学者对该病进行了大量研究,但迄今为止ALI/ARDS的发病机制仍不清楚[1]。肺泡上皮细胞为典型的极性细胞,细胞极性的变化与细胞功能密切相关,如分泌功能、液体清除功能、膜通道等。研究证实,ALI/ARDS时,肺泡上皮细胞存在极性损伤,而这种极性损伤在ALI/ARDS早期扮演重要角色。
新近研究发现,Clathrin蛋白是维持上皮细胞极性所必须的重要蛋白。Clathrin基因的沉默会干扰细胞膜基底外侧蛋白的运输和再循环从而使其失去极性,但是对顶端蛋白的极性没有影响[2]。因此,Clathrin对于上皮细胞的极性维持和调节起到关键作用,但Clathrin在ALI/ARDS发生时具体作用机制仍不明确。如能分离Clathrin相互作用蛋白,对于阐明Clathrin在ALI/ARDS肺泡上皮极性损伤中的具体作用机制具有重要价值。
因此,本研究应用酵母双杂交技术从小鼠肺cDNA文库中筛选与Clathrin相互作用蛋白,进一步阐明Clathrin在ALI/ARDS发生时肺泡上皮极性损伤中的具体作用机制。
材料与方法
一、pSos-Clathrin诱饵载体构建
按小鼠Clathrin基因序列设计相应引物,以含有Clathrin编码序列的质粒克隆为模板,分别在上游和下游引物引入BamH1及SalⅠ酶切位点 (上游引物为:5′-ACGGGATCCATATGGCTGAGGACTTCGGCTTC-3′, 下游引物为: 5′-ACGCGTCGACCTAGCGGGACAGTGGTGTTTG-3′),PCR扩增Clathrin基因全长,产物长度:710 bp。PCR产物纯化后经BamH1和SalⅠ酶切,回收后与经相同条件酶切回收的pSos载体连接,构建重组载体pSos-Clathrin,酶切鉴定后测序。
二、Clathrin诱饵蛋白自激活实验
将下列质粒共转化到制备好的感受态细胞中。
阳性对照组(Positive control):pSos MAFB + pMyr SB
阴性对照组(Negative control):pSos MAFB + pMyr Lamin C
实验组(Experiment group):pSos Clathrin + pMyr SB; pSos Clathrin + pMyr Lamin C
7 d后平板上长出克隆,将克隆分别接种至两块SD/glucose (-UL)平板和两块SD/galactose (-UL)平板上。观察克隆生长情况,确定诱饵蛋白自激活特性。
三、Clathrin 诱饵蛋白表达检测
分别接种转化pSos/Clathrin及pSos空载体的cdc25H酵母细胞至SD/-Leu培养基中,过夜培养,离心收集酵母细胞,完全裂解酵母细胞,提取蛋白,经SDS-PAGE电泳,转移到PVDF膜,封闭液封闭2 h,加入兔抗Sos蛋白多克隆抗体(1︰200),结合4 h,羊抗兔IgG(1︰1000)二抗结合1 h后曝光,显影定影。
四、Clathrin小鼠肺cDNA文库筛选及阳性克隆验证
将pSos-Clathrin质粒和pMyr-小鼠肺cDNA文库质粒共转至感受态的酵母细胞中并将转化产物接种到SD/galactose (-UL)琼脂平板。25 ℃孵育48 h,随后转入37 ℃孵育。7 d后,挑取62个克隆并重铺在SD/glucose (-UL)琼脂平板上,25 ℃孵育5 d。再将其分别重铺在SD/glucose (-UL) 平板和SD/galactose(-UL) 平板上,找出37 ℃下在SD/galactose (-UL)平板上生长,而在SD/glucose (-UL)平板上不生长的克隆。分别扩增含有阳性克隆的酵母细胞后提取文库质粒DNA并酶切鉴定。进一步对筛选得到的阳性克隆进行回转验证。对回转验证结果为阳性的文库克隆质粒送检测序,分析克隆序列。
结 果
一、pSos-Clathrin诱饵载体构建
重组载体pSos-Clathrin经酶切并测序鉴定。结果表明插入的Clathrin基因序列及插入方向完全正确。酶切鉴定结果如图1。
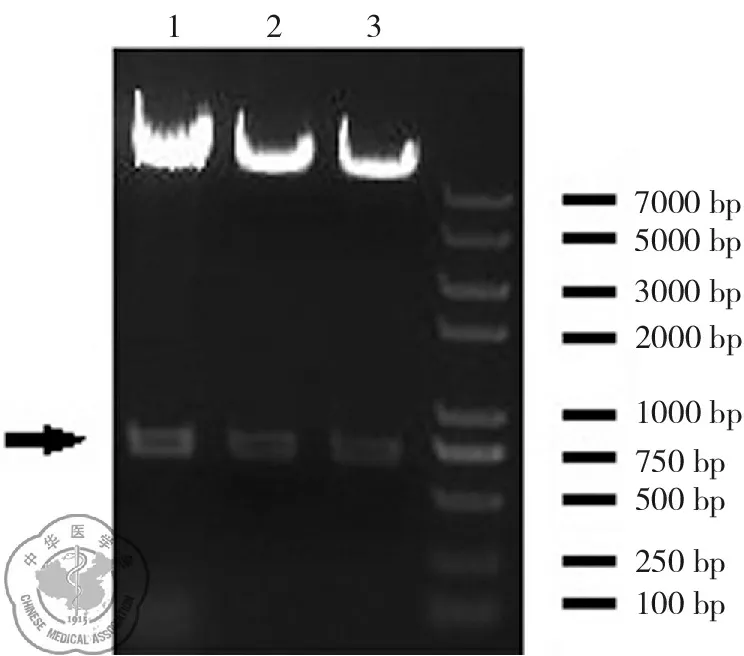
图1 pSos-Clathrin重组载体酶切鉴定结果
二、Clathrin诱饵蛋白自激活实验
转化铺板6 d后所有平板上均长出克隆,取少许克隆培养物分别接种至两块SD/glucose (-UL)平板和两块SD/galactose (-UL)平板上。7 d后观察各平板上克隆生长情况,如图2、图3。

图2 各转化组在25 ℃ SD/Glucose(-UL)和SD/Galactose(-UL)平板生长情况
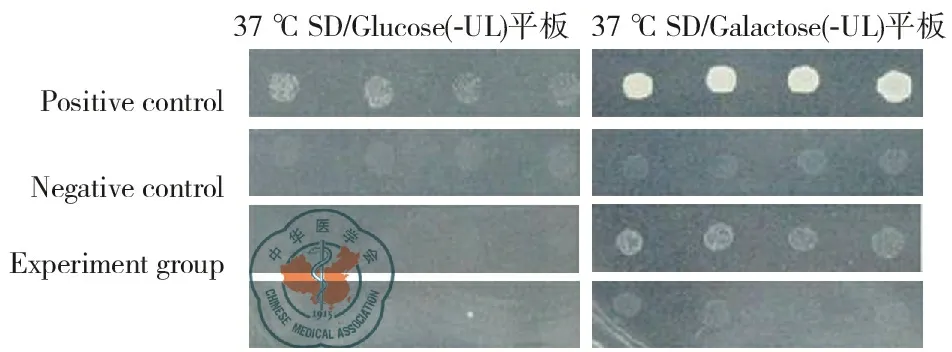
图3 各转化组在37 ℃ SD/Glucose(-UL)和SD/Galactose(-UL)平板生长情况
结果显示,对照组在各温度及缺陷平板上关系正确。实验组在25 ℃ SD/Glucose(-UL)和SD/Galactose(-UL)平板上均有生长;在37 ℃SD/Glucose(-UL)平板上, 两组均无生长; 在37 ℃ SD/Galactose(-UL)平板上,pSos Clathrin + pMyr SB生长,而pSos Clathrin+pMyr Lamin C不生长,表明Clathrin无自激活作用,适用于CytoTrap膜蛋白文库筛选系统。
三、Clathrin 诱饵蛋白表达检测
实验组在相对分子量145×103水平位置可检测到Sos-Clathrin融合蛋白的表达。空载体对照组可在相对分子量120×103左右处检测到Sos蛋白的表达,如图4。

注:Lane 1:转化pSos/Clathrin组;Lane 2:pSos空载体对照组
四、Clathrin蛋白小鼠肺cDNA文库筛选及阳性克隆验证
文库转化物铺至大平板7~10 d以后,从37 ℃半乳糖平板上共挑取了62个克隆,将细胞重铺在SD/glucose (-UL)琼脂平板上,在25℃孵育5 d。大部分细胞可长出克隆,将长出的克隆的细胞分别复制接种在一个SD/glucose (-UL) 平板和一个SD/galactose (-UL) 平板上,37 ℃孵育约5 d。在SD/galactose (-UL)平板上生长,而在SD/glucose (-UL)平板上不生长的克隆为阳性克隆。经过两轮验证之后,共有10个克隆被初步确定为阳性克隆。扩增前一步得到的10种含有阳性克隆的酵母细胞后,提取其中含有的文库质粒DNA。转化大肠杆菌XL1-blue感受态细胞后,小量提取质粒。用EcoRI和XhoI双酶切鉴定,得到的外源片断从相对分子量0.5×103到1.8×103不等,如图5。

图5 纯化质粒的酶切电泳结果
五、阳性文库质粒与诱饵质粒回转验证
将筛选得到的阳性文库质粒和诱饵质粒,共转化到酵母感受态细胞中。将每个转化反应铺在SD/glucose(-UL) 平板上,25 ℃倒置孵育5 d。在每个平板上挑取2个菌落,并将其重铺在一个SD/glucose (-UL) 平板和一个SD/galactose(-UL) 平板上,在37 ℃孵育约48 h。在SD/galactose (-UL)平板上生长,而在SD/glucose (-UL)平板上不生长的克隆可以验证蛋白之间的相互作用。实验组10个克隆在37 ℃孵育48 h后,4种克隆在SD/galactose (-UL)平板上可以生长,而在SD/glucose (-UL)平板上不能生长,其余6种克隆在两种平板上均无法生长,提示以上4种克隆与Clathrin蛋白之间存在相互作用,如图6。4种阳性送检测序。
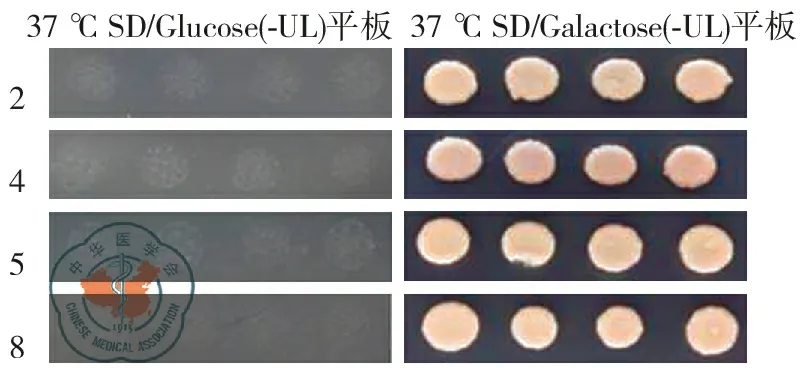
图6 阳性克隆回转验证结果
六、阳性测序结果
将阳性克隆2,4,5,8送测序,并通过生物信息学软件对测序结果进行分析。结果如下:
克隆2:Mus musculus adenylate cyclase-associated protein 1 (yeast)
克隆4:Mus musculus filamin, alpha
克隆5:Mus musculus DAP kinase-related apoptotic kinase 2 (Drak2)/Mus musculus serine/threonine kinase 17b (apoptosis-inducing) (Stk17b)
克隆8:Mus musculus G protein-coupled receptor kinase 6 (Grk6), transcript variant 1, mRNA
讨 论
酵母双杂交系统由Fields和Song等首先在研究真核基因转录调控中建立。典型的真核生长转录因子等都含有二个不同的结构域:DNA结合结构域(DNA-binding domain, BD)和转录激活结构域(transcription-activating domain, AD)。前者可识别DNA上的特异序列,并使转录激活结构域定位于所调节的基因的上游,转录激活结构域可同转录复合体的其他成分作用,启动它所调节的基因的转录。酵母双杂交技术即利用上述特性,将酵母的转录因子的两个功能域分解,由编码BD和AD的DNA片段与需要研究的蛋白质(X和Y)的cDNA分别构建重组体BD-X和AD-Y。如果蛋白质X和Y之间存在相互作用,则BD和AD被拉近,转录活性恢复,即可激活下游报告基因的表达[3]。因此应用酵母双杂交技术可以分析已知蛋白质之间是否存在相互作用。
通过酵母双杂交技术筛选的与已知蛋白相互作用的蛋白质,其功能往往密切相关,彼此相互调节,共同参与某些病理生理过程,这对于阐明各种生物现象的分子机理和基因作用机制具有重要意义。本研究应用pSos酵母双杂交筛选系统,以pSos-Clathrin为诱饵质粒筛选小鼠肺cDNA 文库,得到与Clathrin相互作用的4种蛋白质,并在酵母细胞中初步验证了它们的相互作用。
在这筛选到的4种蛋白质中,腺苷酸环化酶关联蛋白1(CAP1)首先是在酵母中发现的。CAP能和肌动蛋白单体结合,肌动蛋白是细胞保持形态和细胞运动的基本单位,肌动蛋白的单体通过聚合和解聚,完成细胞的运动。在肌动蛋白由单体组合成多聚体及多聚体解聚成单体的循环利用过程中,CAP发挥了重要作用。基因敲除CAP1后,细胞肌动蛋白的装配速度明显减慢[4],在酵母细胞敲除CAP1后,体积增大,出芽模式不规则,肌动蛋白的装配也会紊乱[5]。而敲除了CAP1后Dictyostelium(一种真菌)会出现细胞极性的改变[6]。果蝇的CAP缺失也会影响其卵细胞极性的维持[7]。以上资料表明CAP1表达的异常使得肌动蛋白装配紊乱,进而影响细胞的形态、极性和迁徙。
细丝蛋白ɑ(Filamin ɑ)作为非肌性肌动蛋白结合蛋白,结构保守,表达广泛。细丝蛋白ɑ主要通过动态调节肌动蛋白的聚合、解聚、分支、交联和捆束参与细胞骨架的动态重构,改变细胞的形态和运动以应对外界刺激,定向细胞运动在胚胎发育期间的机体器官发育过程中具有重要意义[8]。
DAP凋亡诱导蛋白激酶2(DRAK2)属于死亡相关蛋白激酶家族(DAP kinase, DAPK),是一类新的钙离子/钙调素依赖激酶,使其底物蛋白的丝氨酸/苏氨酸残基磷酸化。研究表明DRAK2与T细胞免疫和细胞凋亡有关[9-10]。
G蛋白耦联受体激酶(G protein-coupled receptor kinase,GRK)是一类丝/苏氨酸蛋白激酶。至今已克隆出7种亚型的GRK,其中GRK6 广泛分布于心脏、脑、肺和胎盘等各种组织。研究表明GRK6 与炎症调控、凋亡细胞的清除、肿瘤发生发展和转移以及药物成瘾性等有关[11-14]。
通过酵母双杂交筛选的4种与Clathrin相互作用蛋白的可靠性可进一步通过免疫共沉淀技术进一步验证,但其相互作用机制,包括极性损伤和调节细胞凋亡等尚有待深入研究。
参 考 文 献
1 金发光. 急性肺损伤的诊治研究现状及进展[J/CD]. 中华肺部疾病杂志: 电子版, 2013, 6(1): 1-3.
2 Deborde S, Perret E, Gravotta D, et al. Clathrin is a key regulator of basolateral polarity[J]. Nature, 2008, 452 (7188): 719-723.
3 Fields S, Sternglanz R. The two-hybrid system: an assay for protein-protein interactions[J]. Trends Genet, 1994, 10(8): 286-292.
4 Bertling E, Hotulainen P, Mattila PK, et al. Cyclase-associated protein 1 (CAP1) promotes cofilin-induced actin dynamics in mammalian nonmuscle cells[J]. Mol Biol Cell, 2004, 15(5): 2324-2334.
5 Gerst JE, Ferguson K, Vojtek A, et al. CAP is a bifunctional component of the Saccharomyces cerevisiae adenylyl cyclase complex[J]. Mol Cell Biol, 1991, 11(3): 1248-1257.
6 Noegel AA, Blau-Wasser R, Sultana H, et al. The Cyclase-associated Protein CAP as regulator of cell polarity and cAMP signaling in dictyostelium[J]. Mol Biol Cell, 2004, 15(2): 934-945.
7 Baum B, Perrimon N. Spatial control of the actin cytoskeleton in Drosophila epithelial cells[J]. Nat Cell Biol, 2001, 3(10): 883-890.
8 Pollard TD, Borisy GG. Cellular motility driven by assembly and disassembly of actin filaments[J]. Cell, 2003, 112(4): 453-465.
9 Weist BM, Hernandez JB, Walsh CM. Loss of DRAK2 signaling enhances allogeneic transplant survival by limiting effector and memory T cell responses[J]. Am J Transplant, 2012, 12(8): 2220-2227.
10 Mao J, Luo H, Wu J. Drak2 overexpression results in increased beta-cell apoptosis after free fatty acid stimulation[J]. J Cell Biochem, 2008, 105(4): 1073-1080.
11 Tarrant TK, Rampersad RR, Esserman D, et al. Granulocyte chemotaxis and disease expression are differentially regulated by GRK subtype in an acute inflammatory arthritis model (K/BxN)[J]. Clin Immunol, 2008, 129(1): 115-122.
12 Nakaya M, Tajima M, Kosako H, et al. GRK6 deficiency in mice causes autoimmune disease due to impaired apoptotic cell clearance[J]. Nat Commun, 2013, 4: 1532.
13 Raghuwanshi SK, Smith N, Rivers EJ, et al. G protein-coupled receptor kinase 6 deficiency promotes angiogenesis, tumor progression, and metastasis[J]. J Immunol, 2013, 190(10): 5329-5336.
14 Raehal KM, Schmid CL, Medvedev IO, et al. Morphine-induced physiological and behavioral responses in mice lacking G protein-coupled receptor kinase 6[J]. Drug Alcohol Depend, 2009, 104(3): 187-196.

