响应面法优化土茯苓总黄酮的提取工艺
★ 王敏 胡梦梅 陈文龙 卢传礼 朱伟
(广州中医药大学第二临床医学院 广东 广州 510000)
土茯苓为百合科植物光叶菝葜(SmilarglabraRoxb.)的干燥根茎,其性味甘、淡、平,归肝、胃经,具有解毒,除湿,通利关节之功,可用于梅毒及汞中毒所致的肢体拘挛,筋骨疼痛;湿热淋浊,带下,痈肿,瘰疬,疥癣等疾病[1]。化学成分研究表明,土茯苓根茎含有甾体皂甙、黄酮及黄酮甙类、苯丙素类、鞣质等成分[2]。在各类成分中,黄酮类化合物被认为是土茯苓中最重要的活性成分[3]。目前,在土茯苓总黄酮提取工艺研究方面,多采用正交实验设计[4,5],其注重如何科学合理地安排实验,可同时考虑几种因素,寻找最佳因素水平组合,但它不能在给出的整个区域上找到因素和响应值之间的一个明确的函数表达式即回归方程。
响应面分析法(response surface methodology, RSM)是一种优化多变量系统的有效试验工具,可采用多元二次回归方程来拟合多个因素与响应值之间、因素与因素之间的函数关系,找出各因素的最佳组合和响应值的最优值,有效地解决多变量问题。由于响应面分析法在优化研究中具有实验次数少、精确度高、降低成本、提高产出、优化加工条件、解决生产过程中实际问题等优点,已被广泛用于生物、化学、食品等领域[6,7]。因此,本实验采用响应面法,以总黄酮提取率为响应值,考察提取时间、乙醇浓度、提取温度、料液比等提取条件之间交互作用对总黄酮提取率的影响,优化土茯苓总黄酮的最佳工艺条件。
1 材料与方法
1.1 材料 土茯苓药材购自康美中药饮片(批号:12120527),经广东省中医院药学部陈燕芬主任中药师鉴定为百合科光叶菝葜(SmilarglabraRoxb.)的干燥根茎,符合2010版《中国药典》的规定。原料经干燥,粉碎,过200目筛后得到均匀粉末,避光、干燥保存备用。芦丁(≥99%,成都曼斯特生物科技有限公司);其他试剂均为国产分析纯,实验用水为去离子水。
1.2 总黄酮的提取 准确称取2 g土茯苓粉末置于大小适中的锥形瓶内,按不同的料液比(1∶10~1∶60 g/mL)加入一定浓度的乙醇溶液(15~90%,v/v),摇均,放置于一定温度(25~75℃)的恒温水浴中,提取一段时间(10~60 min),4000 r/min离心20 min,取出上清液,按上述步骤重复2次,合并上清液,定容,4℃避光保存,待测。
1.3 总黄酮的含量测定 采用亚硝酸钠-硝酸铝-氢氧化钠显色体系,以芦丁为基准,进行总黄酮的含量测定[6]。
1.3.1 芦丁标准曲线的制作 精密称取芦丁对照品0.004 0 g,70%乙醇溶解,并定容至10 mL,摇均,得质量浓度为400 μg·mL对照品溶液,4℃避光保存,备用。将对照品溶液用70%乙醇溶液稀释成一系列浓度(0,25,50,100,150,200,400 μg/mL)溶液。分别取0.5 mL上述溶液加入0.075 mL亚硝酸钠溶液(5%),摇均,放置6 min;然后分别加入0.075 mL硝酸铝溶液(10%),摇匀,放置6 min;再分别加入1 mL氢氧化钠溶液(4%),摇均,放置10 min后,490 nm波长处测定吸光度值,每组反应液平行3次。以吸光度(Y)为纵坐标,以芦丁质量浓度(X)为横坐标,绘制标准曲线,得回归方程Y=0.001 8X+0.037 3(r=0.999 7),芦丁在浓度25~400 μg/mL范围内与吸光度呈良好的线性关系。
1.3.2 样品中总黄酮的提取率计算 取待测样品溶液0.5 mL,用70%乙醇溶液进行适当稀释,按1.3.1节方法测定样品的吸光度,按下式计算总黄酮的提取率:
1.4 响应面实验设计 通过单因素预试验,选择提取时间、乙醇浓度、提取温度、料液比4个因素,采用Design Expert 7.0.0 统计分析软件中Box-Behnken的实验设计,设计4因素3水平的响应面试验,利用响应面实验结果,确定土茯苓中总黄酮的最佳提取条件。试验因素与水平设计见表1。

表1 Box-Behnken试验设计因素与水平的编码
2 结果与分析
2.1 各因素单独对总黄酮提取率的影响
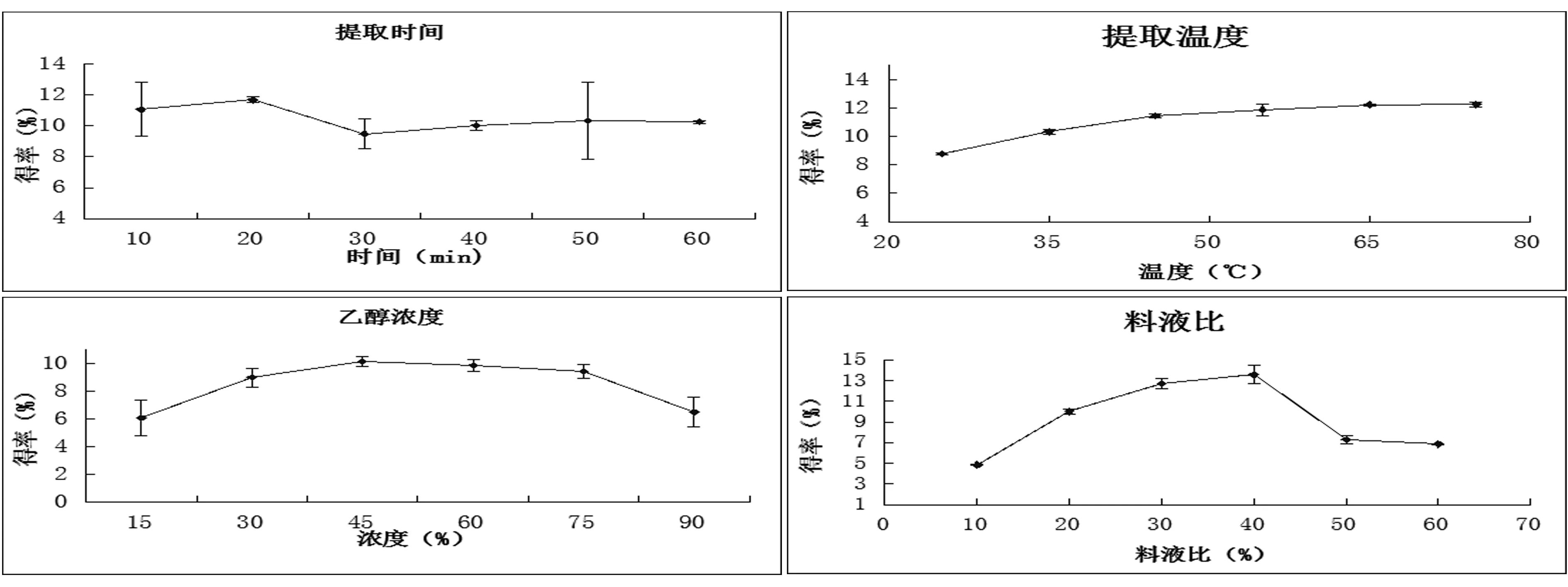
图2 各因素单独对总黄酮提取率的影响
单因素实验分别考察了提取时间、乙醇浓度、提取温度以及料液比4个因素,以总黄酮提取率作为评价指标,在确定其他参数不变的情况下改变其中一个参数进行单因素实验,实验结果见图2。从图2A中可以看出总黄酮提取率随着时间的增加而升高,药材与溶剂接触的时间延长有利于土茯苓中总黄酮的溶出;在20 min时提取率达到最大,随后缓慢下降至平缓。图2B表明提取温度越高,土茯苓总黄酮提取率越好,其可能的原因在于温度升高促进了溶剂分子的热运动,同时降低了溶剂的黏性,更利于溶剂对于细胞壁的穿透性[5],但温度在65℃时提取率趋于平缓,故选取65℃为佳。由图2C可见总黄酮提取率随乙醇浓度升高而增加,当乙醇浓度超过一定范围时,提取率反而下降,这可能是由于黄酮易溶于中等或者中等偏上极性的溶剂中[9],故选取55%为宜。图2D结果表明,料液比增加,总黄酮提取率先上升后降低,当料液比超过1∶20时,提取率增长速度降低趋于平缓,虽在1∶40处提取率达到最大,但考虑到若采用较大的料液比时,一方面增加了乙醇的用量,另一方面也增加了后续工艺的难度,最终导致生产成本的增加,故选择1∶20为宜。
2.2 响应面优化工艺实验结果
2.2.1 Box-Behnken实验设计与回归模型的建立 根据单因素实验结果以及Box-Behnken设计原理,以提取时间(X1)、乙醇浓度(X2)、提取温度(X3)和料液比(X4)四个因素为自变量,总黄酮提取率为响应值,设计了共29个实验组的响应面分析实验,每组实验平行3次,试验方案和结果见表2。
2.2.2 建立模型回归方程与显著性检验 利用Design Expert 7.0.0软件对表2的结果进行多元线性回归拟合,得到总黄酮提取率(Y)对提取时间(X1)、乙醇浓度(X2)、提取温度(X3)、料液比(X4)的二次多项回归方程:
Y=35.31+1.82X1+1.14X2+1.67X3+15.45X4+3.24X1X2+2.73X1X3+6.71X1X4+0.43X2X3+4.22X2X4+1.53X3X4-8.46X12-6.32X22-7.22X32-5.96X42
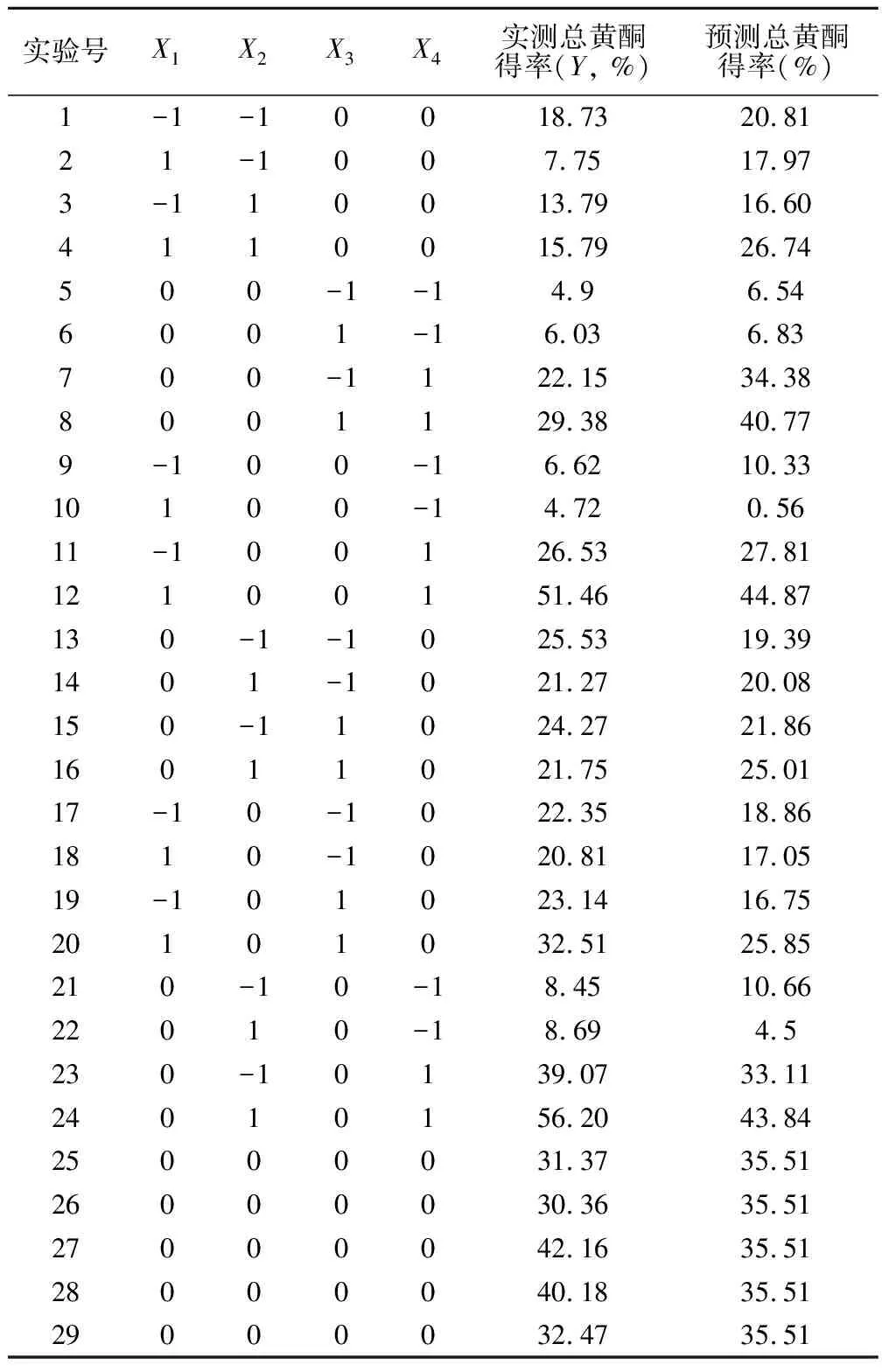
表2 Box-Behnken试验设计与结果
为考察上述回归方程的有效性及各因素对提取率的影响程度,对上述回归模型进行方差分析,结果见表3。由表3可以看出模型极显著(Prob>F值为0.009 1小于0.01),而失拟项(Lack of Fit)不显著(Prob>F值为0.132 2大于0.05),说明该方程对试验拟合较好。单个因素X4和二次项X12对响应值的影响显著。
2.2.3 响应面优化工艺分析 为了进一步研究相关变量之间的交互作用,利用Design Expert 软件模拟了影响因素对总响应因子交互影响的3D响应曲面图(图3),将其中两个因素固定在零水平,考察另外两个因素之间的交互作用。从曲面图和对应的等高线的形状可以直观反映出两自变量交互作用的显著程度,圆形表示两因素交互作用不显著,椭圆形表示两因素交互作用显著[10,11]。

表3 响应面分析法对总黄酮提取率的方差分析结果
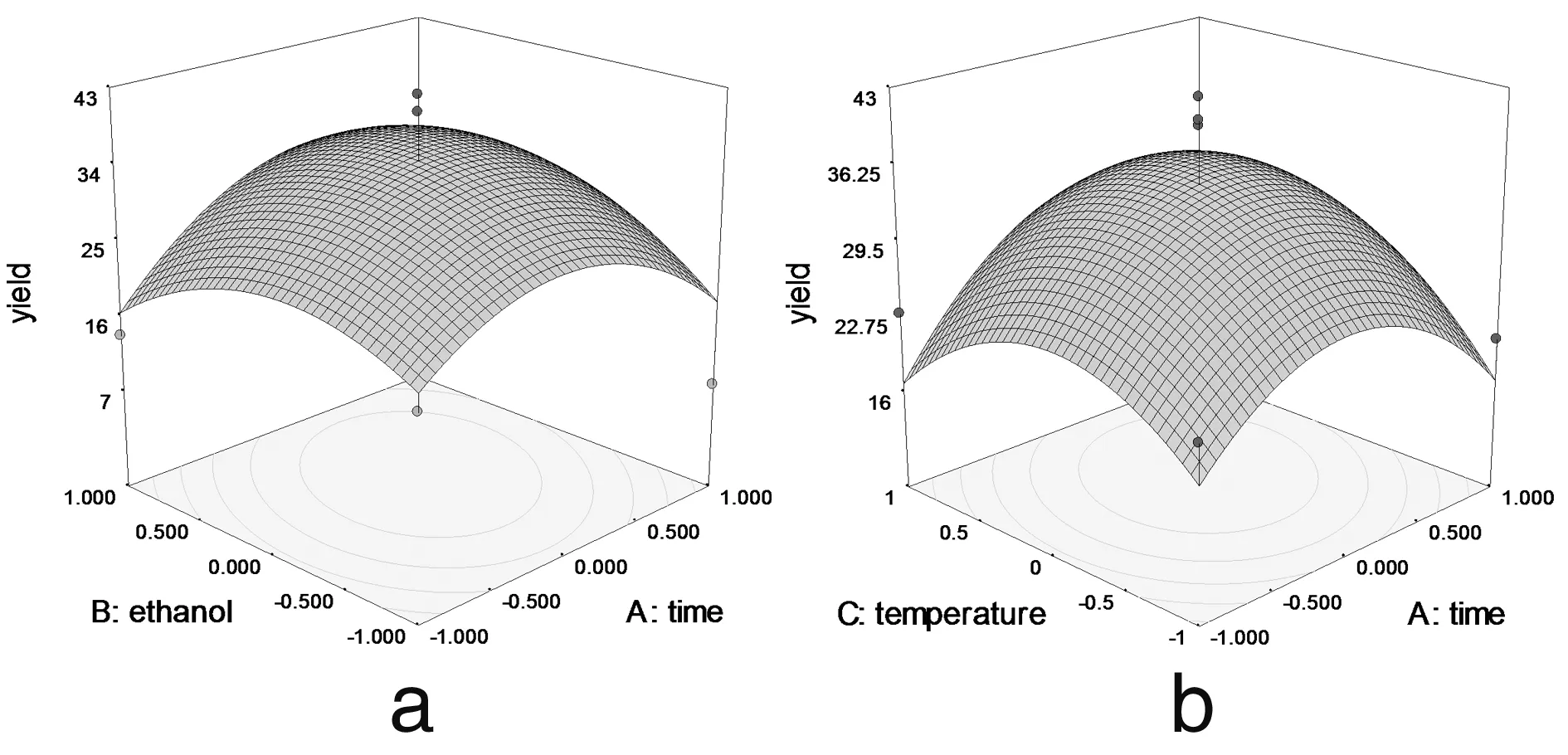

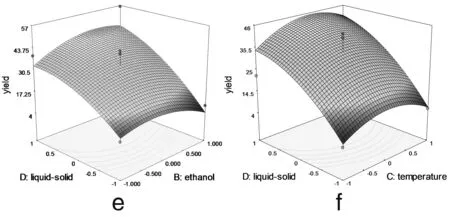
图3 各两因素交互作用对总黄酮提取率影响的响应面图
由图3可以看出料液比和提取时间 (3c)、乙醇浓度(3e)、提取温度 (3f) 两两之间的交互作用非常显著,表现为曲面较陡,等高线沿料液比方向变化较快,而沿其他因素方向变化较慢。在实验水平下,料液比对提取率的影响比提取时间、提取温度、乙醇浓度显著[12]。图3a显示了提取时间和乙醇浓度对总黄酮提取率的影响。可以看出,随着提取时间和乙醇浓度的同时增大,提取率呈先增大后降低的抛物线趋势,其原因有可能与黄酮类物质的极性大小和稳定性有关[13]。但二者交互作用对提取率的影响不显著。图 3b 和3d与图3a十分相似,等高线近似圆形,表明提取时间和提取温度以及提取温度和乙醇浓度交互作用对总黄酮提取率影响不显著。
利用Design Expert 7.0.0软件对回归模型进行进一步的典型性分析,得到最优提取工艺条件为:提取时间35.2 min、乙醇浓度:58.05%、提取温度:68.7℃、料液比1∶30,总黄酮提取率理论值为49.931%。
2.3 验证实验 为检验响应面分析法所得结果的可靠性,采用上述优化条件进行土茯苓总黄酮的提取实验,考虑到实际情况,将修正后的最优提取条件定为:提取时间35min、乙醇浓度58%、提取温度69℃、料液比1∶30,提取次数3次,共进行3次平行实验,得到土茯苓总黄酮的平均提取率为49.003%,略低于理论值49.931%,其与理论预测值的相对误差为1.89%,说明响应面法设计准确,模型可靠,不失为土茯苓总黄酮提取工艺优化的一种有效方法。
3 结论
本实验在单因素实验的基础上,通过响应面法优化出土茯苓总黄酮提取工艺的最优条件为:提取时间35.2 min、乙醇浓度:58.05%、提取温度:68.7℃、料液比1∶30,提取次数3次。根据实验实际情况修正上述条件后,总黄酮提取率为49.003%,与理论值49.931%相差不大,相对误差为1.89%,表明响应面分析法优化得到的参数条件准确可靠,可为土茯苓药材的工业化大规模生产提供了实验参考和依据。
[1]国家药典委员会.中华人民共和国药典﹒一部[S].北京: 中国医药科技出版, 2010: 43.
[2]刘虎岐, 高锦明, 邱明华, 等.菝葜属的生物学和化学研究进展[J].天然产物研究与开发, 2001,13(1): 90-93.
[3]刘世旺, 徐艳霞, 王娟.菝葜与土茯苓黄酮类化合物的比较研究[J].中国野生植物资源, 2006, 25 (3): 44-46.
[4]陈文龙, 陈燕芬, 卢传坚, 等.土茯苓总黄酮提取工艺的正交设计优化[J].时珍国医国药, 2013, 25(3): 544-546.
[5]刘志刚, 曾祥腾, 孙维峰, 等.正交实验优化土茯苓黄酮类成分提取工艺研究[J].中华中医药学刊, 2010, 28 (3): 466-468.
[6]李琰, 范璐, 孙秀华.葛根提取工艺的考察[J].北京中医药大学学报, 2001, 24(4): 26-27.
[7]Gan C Y, Latiff A A.Optimisation of the solvent extraction of bioactive compounds from Parkia speciosapod using response surface methodology[J].Food Chemistry,2011,124(4):1 277-1 283.
[8]Hossain M B, Brunton N P, Patras A.et al.Optimization of ultrasound assisted extraction of antioxidant compounds from marjoram (Origanum majoranaL.) using response surface methodology[J].Ultrasonics Sonochemistry,2012,19(3),582-590.
[9]王晋黄, 池汝安, 陈少峰, 等.土茯苓中提取总黄酮的工艺研究[J].植物研究, 2006, 26(3): 370-373.
[10]Lai J X, Xin C, Zhao Y, et al.Optimization of ultrasonic assisted extraction of antioxidants from black soybean (Glycine maxvar) sprouts using response surface methodology [J].Molecules, 2013, 18 (1): 1 101-1 110.
[11]周玉, 孙晓佳, 孙莹, 等.响应面法分析优化毛脉酸模多糖提取工艺[J].中医药学报, 2013, 41 (3): 48-52.
[12]夏道宗, 于新芬, 马志杰.二次回归通用旋转设计优化土茯苓总黄酮的提取工艺[J].中华中医药学刊, 2009, 27(7): 1 460-1 463.
[13]Wang X S, Wu Q N, Wu Y F, et al.Response surface optimized ultrasonic-assisted extraction of flavonoids from sparganii rhizoma and evaluation of their in vitro antioxidant activities[J].Molecules, 2012, 17 (6): 6 769-6 783.

