新型含1,2,3-三氮唑的喹唑啉酮席夫碱的合成*
刘 霞,苏长会
(1.江苏开放大学 理工学院,江苏 南京 210036;2.江苏城市职业学院 江苏 南京 210017;3.南京大学 金陵学院 化学与生命科学学院,江苏 南京 210089)
·快递论文·
新型含1,2,3-三氮唑的喹唑啉酮席夫碱的合成*
刘 霞1,2,苏长会3
(1.江苏开放大学 理工学院,江苏 南京 210036;2.江苏城市职业学院 江苏 南京 210017;3.南京大学 金陵学院 化学与生命科学学院,江苏 南京 210089)
以2-氨基-4-氟苯甲酸为原料合成了中间体 3-氨基-7-氟-2-甲基喹唑啉-4(3H)-酮(3);以4-硝基苯甲醛为原料合成了中间体 4-[4-(氯甲基)-1H-1,2,3-三氮唑-1-基]-苯甲醛(5);3和5在四氯化钛催化下经缩合反应合成了一种新型的含1,2,3-三氮唑的喹唑啉酮席夫碱——(E)-3-{4-[4-(氯甲基)-1H-1,2,3-三氮唑]苯亚甲胺基}-2-甲基-7-氟-4(3H)-喹唑啉酮(1)。1,3和5均为新化合物,其结构经1H NMR,13C NMR,IR,MS和元素分析表征。
三氮唑;喹唑啉酮;席夫碱;合成
1,2,3-三氮唑化合物[1]既具有芳香环的稳定性,又有很好的生物兼容性,能将不同底物的药效基团通过三氮唑环链接成为一个分子,其衍生物可通过氢键和偶极作用提高与生物靶点的结合能力,具有比咪唑更低的毒性。目前,已有很多三氮唑衍生物作为抗菌、抗肿瘤、抗炎症、抗高血压等[2-3]药物广泛应用于临床。
喹唑啉酮类化合物是一类具有良好生物活性的含氮杂环化合物,在抗菌、抗炎、抗高血压和抗癌等方面[4-5]都显示出优良的活性。对以喹唑啉酮类化合物为基础的衍生物研究成为热点,特别是含有其他杂环片段的喹唑啉酮类衍生物,其结构的可变性和广谱的生物活性使之在医药和农药领域有着广泛的应用。如用于晚期结、直肠癌治疗的抗叶酸剂雷替曲塞就含有喹唑啉酮结构片段[6]。席夫碱也是一种具有特殊生理活性的药效基团,如抑菌、杀菌、抗肿瘤、抗病毒等[7]。最近的研究显示,喹唑啉酮中的C-2或N-3位被芳基或杂芳基取代时,抗炎活性大大提高[8]。因此,我们将三氮唑和席夫碱官能团引入其中,期望得到一种新型的具有抗菌、抗炎活性的化合物。

本文以2-氨基-4-氟苯甲酸为原料合成了中间体 3-氨基-7-氟-2-甲基喹唑啉-4(3H)-酮(3);以4-硝基苯甲醛为原料合成了中间体 4-[4-(氯甲基)-1H-1,2,3-三氮唑-1-基]-苯甲醛(5);3和5在四氯化钛催化下经缩合反应合成了一种新型的含1,2,3-三氮唑的喹唑啉酮席夫碱——(E)-3-{4-[4-(氯甲基)-1H-1,2,3-三氮唑]苯亚甲胺基}-2-甲基-7-氟-4(3H)-喹唑啉酮(1,Scheme 1)。1,3和5均为新化合物,其结构经1H NMR,13C NMR,IR,MS和元素分析表征。
1 实验部分
1.1 仪器与试剂
SGW X-4型显微熔点仪(温度未校正);Varian Mercury Plus 300型核磁共振仪(300Hz,CDCl3为溶剂,TMS为内标);Bruker Vector 22型红外光谱仪(KBr压片);Mariner Mass Spectrometer型质谱仪;Carlo Erba 1106型元素分析仪。
7-氟-2-甲基-4(3H)-3,1-苯并噁嗪酮(2)参考文献[11-12]方法合成【类白色固体,收率95.2%,m.p.195.4℃~195.7℃;1H NMRδ:2.46(s,3H),7.17~7.21(m,2H),8.20(dd,J=6.0,9.0Hz,1H);MS-ESIm/z:180{[M+H]+}】;其余所用试剂均为分析纯或化学纯。
1.2 合成
(1)3的合成[11]
在反应瓶中依次加入2895mg(5mmol),乙醇15mL和水合肼750mg(15mmol),搅拌下于80℃反应2h(TLC检测)。降至室温,析晶,抽滤,滤饼用乙醇重结晶得类白色固体3930mg,收率96.4%,m.p.153.1℃~153.7℃;1H NMRδ:2.68(s,3H),4.87(s,2H),7.13~7.29(m,2H),8.24(dd,J=6.0Hz,9.0Hz,1H);13C NMR(75MHz)δ:21.93,111.41,114.41,116.71,128.83,148.70,156.79,163.82,167.15;ESI-MSm/z:194{[M+H]+};Anal.calcd for C9H8N3OF:C 55.93,H 4.19,N,21.70;found C 55.96,H 4.17,N 21.75。
(2)4-叠氮基苯甲醛(4)的合成
在反应瓶中依次加入4-硝基苯甲醛3.02g(20mmol),六甲基磷酰三胺(HMPT)35mL和叠氮钠2.6g(40mmol),搅拌下于60℃反应8h(TLC检测)。加入乙醚200mL,分别用水(2×100mL)和饱和氯化钠溶液(100mL)洗涤,用无水硫酸钠干燥,旋蒸除溶得棕色油状液体42.78g,收率94.5%;1H NMRδ:7.18(d,J=9.0Hz,2H),7.91(d,J=10.5Hz,2H),9.97(s,1H);IRν:3301,3288,2117,1698cm-1;ESI-MSm/z:148{[M+H]+}。
(3)5的合成[10]
在反应瓶中依次加入41.47g(10mmol),混合溶剂[V(乙醇)∶V(水)=9∶1],3-氯丙炔0.75g(10mmol),抗坏血酸钠198mg(1mmol)和碘化亚铜191mg(1mmol),氮气保护,搅拌下于室温反应3h(TLC检测)。抽滤,滤液旋蒸除溶,残余物用乙酸乙酯(100mL)溶解,分别用水(2×50mL)和饱和食盐水(50mL)洗涤,用无水硫酸钠干燥,旋蒸除乙酸乙酯后经硅胶柱层析[洗脱剂:V(石油醚)∶V(乙酸乙酯)=10∶1]纯化得黄色固体52.03g,收率91.7%,m.p.119.5℃~20.3℃;1H NMRδ:4.80(s,2H),7.96(d,J=8.4Hz,2H),8.07(d,J=8.4Hz,2H),8.14(s,1H),10.08(s,1H);13C NMRδ:35.47,119.13,120.45,131.01,135.82,140.35,145.73,190.19;IRν:1700,1684,1621,1549cm-1;ESI-MSm/z:244{[M+Na]+};Anal.calcd for C10H8N3OCl:C 54.22,H 3.63,N 18.92;found C 54.19,H 3.64,N 18.96。
(4)1的合成
在反应瓶中依次加入甲苯10mL,5221mg(1mmol),2193mg(1mmol)和四氯化钛19mg(0.1mmol),搅拌下于110℃(回流)反应5h(TLC检测)。旋蒸除甲苯,残余物用乙醇重结晶得棕色粉末1335mg,收率85.0%,m.p.208.5℃~209.1℃;1H NMR(DMSO-d6)δ:2.56(s,3H),4.96(s,2H),7.39~7.48(m,2H),8.13~8.25(m,5H),9.05(s,1H),9.09(s,1H);13C NMR(75MHz)δ:22.38,36.24,111.94,115.19,118.10,120.56,122.74,129.85,130.48,132.52,138.39,145.03,145.50,155.08,156.82,164.01,167.99;IRν:3300,1680,1595,1559,1508,1479,1253cm-1;ESI-MSm/z:397{[M+H]+};Anal.calcd for C19H14N6OFCl:C 57.52,H 3.59,N 21.16;found C 57.51,H 3.56,N 21.18。
2 结果与讨论
2.1 合成
(1)4和5的合成
合成4的传统方法是以硝基化合物为原料依次进行还原胺化、重氮化和叠氮化,但由于硝基苯甲醛中的醛基易与硝基还原生成的氨基发生缩合,导致收率大大降低。为避免发生缩合反应,本文采用HMPT作溶剂[9],硝基苯甲醛与叠氮钠于60℃直接反应8h得4,收率大于90%。4与氯丙炔经环加成反应[10]得5,收率也大于90%。
(2)1的合成
本文以2-氨基-4-氟苯甲酸为原料依次与乙酸酐和水合肼反应,高收率的合成了3[11-12]。3和5经缩合反应合成了1。溶剂和催化剂的选择对1的收率影响很大,影响结果见表1。由表1可见,乙醇作溶剂时,5会优先和其羟基反应生成缩醛;三氯甲烷或DMF作溶剂时,仅得到痕量产物;苯作溶剂时,1收率提高至17%。考虑到苯的毒性较大,用甲苯代替苯作溶剂进行实验,也可得到相似的结果。
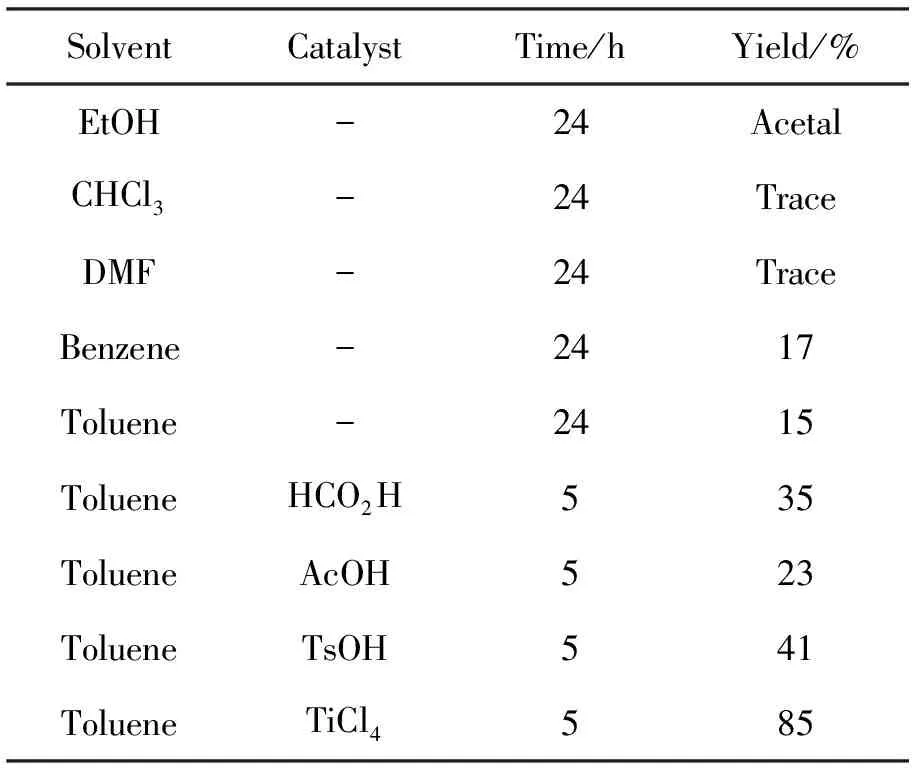
表1 溶剂和催化剂对合成1的影响*Table1 Effect of solvent and catalyst on synthesizing 1
*aldehyde(1mmol),amine(1mmol),catalyst(0.1eq),solvent(10mL)under reflux condition
为提高1的收率,分别加入催化量的甲酸、乙酸、对甲苯磺酸和TiCl4催化,收率有了明显提高。从表1可见,用TiCl4作催化剂时,收率提高至85%,其可能原因有两点:(1)TiCl4作为路易斯酸活化醛基促进反应的进行;(2)TiCl4的吸水作用促进反应向正向进行。
[1] Katritzky A R,Zhang Y,Singh S K.1,2,3-Triazole formation under mild conditions via 1,3-dipolar cycloaddition of acetylenes with azides[J].Heterocycles,2003,60(5):1225-1239.
[2] Genin M J,Allwine D A,Anderson D J,etal.Substituent effects on the antibacterial activity of nitrogen-carbon-linked (azolylphenyl)oxazolidinones with expanded activity against the fastidious gram-negative organisms haemophilus influenzae and moraxella catarrhalis[J].J Med Chem,2000,43(5):953-970.
[3] Brockunier L L,Parmee E R,Ok H O,etal.MeO-PEG-bounded azide cycloadditions to alkynyl dipolarophiles[J].Bioorg Med Chem Lett,2000,10(18):2111-2114.
[4] Roopan S M,Nawaz Khan F,Jin J S,etal.An efficient one pot-three component cyclocondensation in the synthesis of 2-(2-chloro-quinolin-3-yl)-2,3-dihydroquinazolin-4(1H)-ones:Potential antitumor agents[J].Res Chem Intermed,2012,37(8):919-927.
[5] Mohamed M S,Kamel M M,Kassem E M M,etal.Novel 6,8-dibromo-4(3H)quinazolinone derivatives of anti-bacterial and anti-fungal activities[J].Eur J Med Chem,2010,45(8):3311-3319.
[6] Cao S L,Han Y,Yuan C Z.Synthesis and antiproliferative activity of 4-substituted-piperazine-1-carbodithioate derivatives of 2,4-diaminoquinazoline[J].Eur J Med Chem,2013,64:401-409.
[7] 朱万仁,李家贵,陈渊,等.新型席夫碱的合成及其抑菌活性[J].合成化学,2011,19(3):341-344.
[8] Alagarsamy V,Dhanabal K,Parthiban P,etal.Synthesis and pharmacological investigation of novel 3-(3-methylphenyl)-2-substituted amino-3H-quinazolin-4-ones as analgesic and anti-inflammatory agents[J].J Pharm Pharmacol,2007,59(5):669-677.
[9] Stokes B J,Vogel C V,Urnezis L K,etal.Intramolecular Fe(II)-catalyzed N-O or N-N bond formation from aryl azides[J].Org Lett,2010,12(12):2884-2887.
[10] Zhang W S,Su C H ,Jiang Y B,etal.Synthesis of phenylacetylene containing 1,2,3-triazole group[J].Res Chem Intermed,2009,35:589-595.
[11] Nagase T,Mizutani T,Ishikawa S,etal.Synthesis and pharmacological investigation of novel 3-(3-methylphenyl)-2-substituted amino-3H-quinazolin-4-ones as analgesic and anti-inflammatory agents[J].J Med Chem,2008,51(15):4780-4789.
[12] Alagarsamy V,Murugananthan G,Venkateshperumal R.Synthesis,analgesic,anti-inflammatory and antibacterial activities of some novel 2-methyl-3-substituted quinazolin-4-(3H)-ones[J].Biol Pharm Bull,2003,26(12):1711-1714.
SynthesisofaNovelQuinazolin-4(3H)-onewith1,2,3-TriazolesMoietyConjugatedbySchiffBase
LIU Xia1,2,SU Chang-hui3
(1.College of Science and Technology,Jiangsu Open University,Nanjing 210036,China;2.The City Vocational College of Jiangsu,Nanjing 210017,China;3.Chemistry and Life Science College,Nanjing University Jinling College,Nanjing 210089,China)
An intermediate,3-amino-7-fluoro-2-methylquinazolin-4(3H)-one(3),was obtained from 2-amino-7-fluorobenzoic acid.4-[4-(Chloromethyl)-1H-1,2,3-triazol-1-yl]benzaldehyde(5)was prepared from 4-azidobenzaldehyde.A novel complex,(E)-3-{4-[4-(chloromethyl)-1H-1,2,3-triazol-1-yl]benzylideneamino}-7-fluoro-2-methylquinazolin-4(3H)-one(1),was synthesized by the condensation reaction of3with5using TiCl4as the catalyst.1,3and5were novel compounds and the structures were characterized by1H NMR,13C NMR,IR,MS and elemental analysis.
triazol;quinazolinone;Schiff base;synthesis
2014-01-08;
2014-02-20
江苏省省属高校自然科学基金资助项目(13KJB150009)
刘霞(1981-),女,汉族,江苏南京人,副教授,主要从事药物合成的研究。E-mail:liuxia_1107@163.com
O621.3;O626.26
A
1005-1511(2014)04-0520-03

