东方百合离体再生前后叶片遗传稳定性的ISSR检测
于海玲,王发国,李仕裕
(1.中国科学院华南植物园,广东 广州 510650;2.中国科学院大学,北京 100049)
东方百合离体再生前后叶片遗传稳定性的ISSR检测
于海玲1,2,王发国1,李仕裕1,2
(1.中国科学院华南植物园,广东 广州 510650;2.中国科学院大学,北京 100049)
以东方百合品种西伯利亚(Siberia)为材料,对影响百合ISSR-PCR的主要参数进行优化,确立了所适用的ISSR反应体系和扩增条件,并采用Mix体系进行引物筛选,得出最佳引物为:3A30、3A37、UBC815和UBC844。利用本试验优化的引物和Mix体系,对组织培养再生前后的百合叶片遗传物质的稳定性进行检测,结果表明,再生前后百合叶片遗传物质未发生明显变化,稳定性较高。因此,可以采用组培快繁的方法扩大东方百合原种的生产量。
东方百合;ISSR;叶片再生;遗传稳定性
百合(LiliumSpp),又名强仇、百合蒜、摩罗、中庭等,隶属单子叶植物亚纲百合科,为多年生草本球根花卉。百合花朵大,花色丰富多彩,花姿优美,既能作切花、盆花,又能应用在园林绿地中,是著名的观赏花卉。百合还可食用、药用等,因此在国内外花卉市场上占有重要的地位。东方百合是百合中最具有市场优势的切花品种,包括天香百合、鹿子百合、日本百合衍生的品种以及它们与湖北百合的杂交种。东方百合开放的花朵为碗形花,是百合中花朵最大的。东方百合花色丰富,具有浓郁的芳香气味,有很高的观赏价值。近年来,东方百合杂交种的栽培面积越来越大,在切花生产中占据重要地位[1]。
简单重复序列区间扩增标记(inter simple sequence repeat,ISSR)是在简单重复序列(simple sequence repeat,SSR)基础上创建、基于PCR扩增的一种新型分子标记技术。ISSR分子标记通常为显性标记,呈孟德尔式遗传,具有技术简便快捷、稳定性强、DNA多态性高等优点。ISSR不像SSR具有物种特异性,其产物多态性比RAPD、RFLP等分子标记更加丰富,可提供更多基因组信息,且稳定可靠,试验重复性更好。目前已在遗传作图、遗传多样性、分子标记育种、种质鉴定、基因定位等方面得到广泛应用[2]。
不论对无性繁殖试管苗,还是以转基因研究为目标的植株再生体系,都要求既简单、快速、高效,又必须保持原有品种的优良特性。再生植株在遗传上的稳定性是组培快繁和转基因研究能否成功的关键因素。百合再生体系研究大多通过优化培养条件来保证大部分外植体的分化率[3-6],但对再生植株是否发生了DNA水平的变异尚少见报道。本研究采用ISSR分子标记法对叶片再生前后的百合进行遗传稳定性鉴定,以期采用组培快繁的方法来扩大东方百合原种的生产量。
1 材料与方法
1.1 试验材料
50株第3代叶片组织培养再生后的东方百合品种西伯利亚(Siberia)叶片和母株叶片(对照),由西北农林科技大学超低温实验室提供。
1.2 试验方法
1.2.1 基因组DNA提取 分别采用改良的CTAB法[7]和DNA试剂盒(北京天根公司)提取50个再生后植株叶片及母株叶片DNA,并用1.5%琼脂糖凝胶(琼脂糖0.45 g溶解于30 mL 1×TBE中)电泳检测DNA质量。在紫外分光光度计下测其浓度,最后稀释标定值10 ng·μL-1,放入-20 ℃冰箱备用。
1.2.2 体系筛选 为确定东方百合ISSR-PCR的最适扩增条件,在预试验的基础上,采用单因素试验设计,以UBC845和3A8为引物,对影响PCR的主要因子:Mg2+浓度、引物浓度、dNTP浓度等进行梯度试验;在单因素变量试验的基础上,每个因素选择3个适宜水平进行组合试验,以确定东方百合ISSR-PCR的最佳反应组合体系。
1.2.3 引物筛选 引物筛选采用以下2种方法。(1)根据上述试验设计,选择出较优的体系。采用该体系中的设计参数,进行引物的筛选。即在Mg2+浓度、Taq DNA聚合酶用量、dNTP浓度、引物浓度一定的基础上,改变引物的种类,通过PCR扩增、电泳、紫外凝胶成像,根据结果来选择适合东方百合ISSR反应的最佳引物。(2)采用沃尔森技术有限公司Mix反应体系直接进行引物的筛选。Mix反应体系适合绝大多数的ISSR反应,与方法(1)相比,不用进行体系筛选,因而较为简单、易操作。本试验采用第2种方法筛选出引物,未采用筛选出的较优体系进行引物筛选。
随机选取DNA模板在25 μL反应体系中进行扩增筛选,从24个ISSR引物(沃尔森公司的3A系列引物和UBC系列引物)中选取12个扩增条带清晰、重复性好的引物(表1)用于进一步的PCR扩增。本试验采用的25 μL反应体系中含1 μL引物、1 μL DNA、12.5 μL Taq Mix、10.5 μL ddH2O,其中,引物为10 mmol·μL-1。
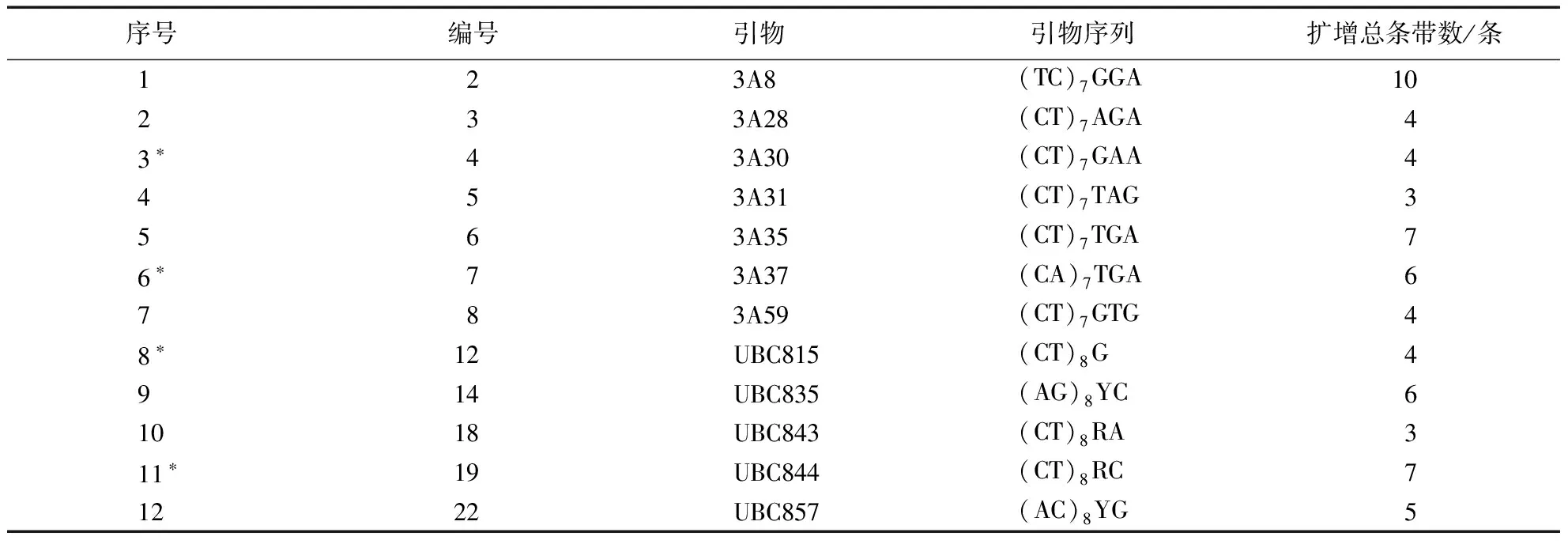
表1 ISSR引物对东方百合再生植株的扩增1)Table 1 ISSR analysis of oriental lily renewable plants with 12 primers
1)*为筛选出的最佳引物;R=(A,G),Y=(C,T)。
1.2.4 PCR扩增程序 94 ℃预变性5 min;94 ℃变性40 s,52.8 ℃ 退火45 s,72 ℃ 延伸1.5 min,40个循环;最后72 ℃ 延伸8 min,4 ℃保存。
1.2.5 PCR产物检测 取5 μL扩增后的产物在1.5%琼脂糖凝胶(琼脂糖0.45 g溶解于30 mL 0.5×TBE中)、120 V电压下,电泳30 min,用溴化乙锭染色10 min,在紫外凝胶成像系统中观察、记录、保存图像。
2 结果与分析
2.1 DAN提取结果
本试验中2种提取方法对比表明,DNA试剂盒提取的DNA在1.5%琼脂糖胶电泳上呈现为清晰的条带,RNA去除干净,无降解现象或降解很少,无拖尾,无弥散,且质量比较稳定,一致性高,质量与浓度均比CTAB方法提取的DNA高。故在后续的体系筛选、引物筛选等试验中均采用DNA试剂盒所提取的基因组DNA(图1)。
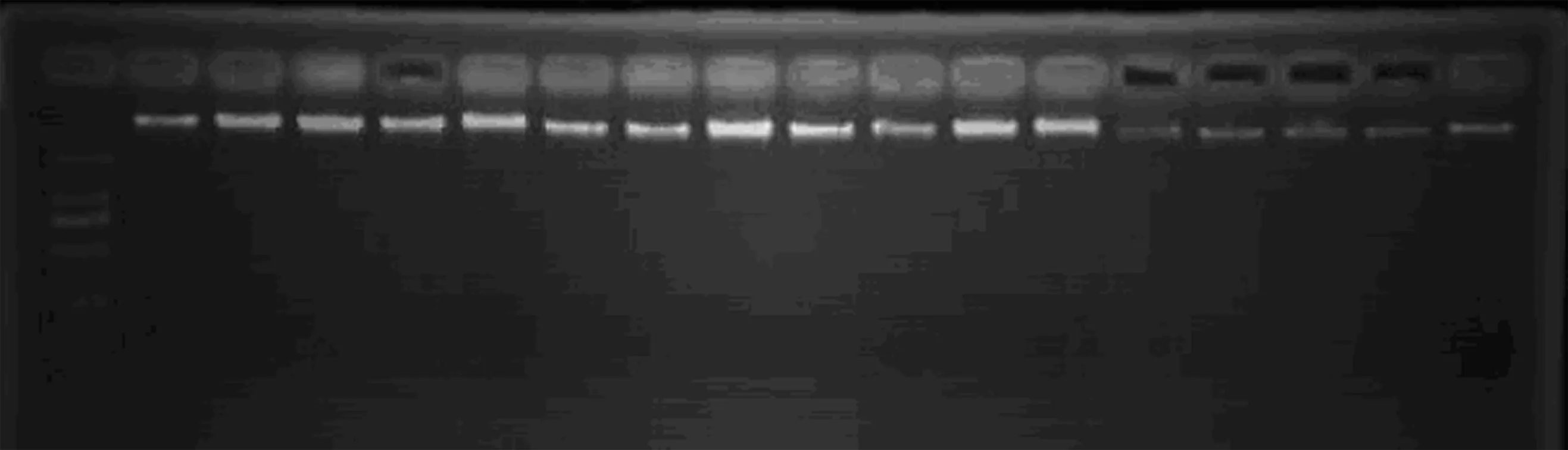
图1 东方百合部分样品的DNA电泳图谱(DNA试剂盒提取)Fig.1 The electrophoretogram of some samples of lilium by plant genomic DNA Kit
2.2 体系筛选
从琼脂糖凝胶电泳检测结果来看,在20 μL反应体系中,体系14、23、26、27、14′、16′、17′、22′谱带较为清晰,多态性较高,其他体系未扩增出清晰的条带或者表现出极低的多态性(图2)。其中27、22′和17′体系较优。①27:Buffer 2.5 μL、dNTP 2.5 μL、Mg2+2.0 μL、3A8引物1.5 μL、DNA 0.5 μL、Taq酶0.3 μL、ddH2O 15.7 μL;②22′:Buffer 2.5 μL、dNTP 2.5 μL、Mg2+1.5 μL、UBC845引物1.0 μL、DNA 0.5 μL、Taq酶0.3 μL、ddH2O 16.7 μL;③17′:Buffer 2.5 μL、dNTP 2.0 μL、Mg2+2.0 μL、3A8引物1.2 μL、DNA 0.5 μL、Taq酶0.3 μL、ddH2O 16.5 μL。其中,1×Buffer,Taq酶5 U·μL-1,引物10 mmol·μL-1,Mg2+25 mmol·μL-1,dNTP 2.5 mmol·L-1。
2.3 引物筛选
采用前述Mix反应体系,对24条引物进行PCR后的结果如图3所示。从图3可见,编号为2、4、6、7、8、12、14、18、19、22的引物,扩增的条带较多,且相对清晰。由于条带不很清晰,拖尾现象较为明显,故对所挑选出的引物再次进行PCR扩增(图4)。
经过筛选,确定了4个最佳引物,分别为:3A30、3A37、UBC815和UBC844(表1)。
2.4 PCR扩增结果
利用24个ISSR随机引物对东方百合再生植株叶片基因组进行PCR扩增,大部分引物均能扩增出DNA条带,扩增条带数和长度各不相同。经反复试验,其中扩增稳定且条带清晰的引物有12个(图3、4)。该12个引物共扩增出63条清晰的谱带,各引物扩增出的谱带数为3-10条,平均每个引物扩增5.2条(表1)。从条带数目以及清晰无拖尾现象来看,虽然引物3A8扩增出的条带较多,但几次试验稳定性不高,且条带不清晰,因此以引物3A30、3A37、UBC815、UBC844扩增效果最好,为筛选出的最佳引物(图4),用于后续试验。依片段大小,DAN长度均在250-2000 bp之间,其中63条带全部为单态带,多态位点百分率为0(图5)。

1-27体系所用引物为3A8;1′-27′体系所用引物为UBC845。

图3 不同引物ISSR-PCR扩增反应结果Fig.3 The result of ISSR-PCR by different primers
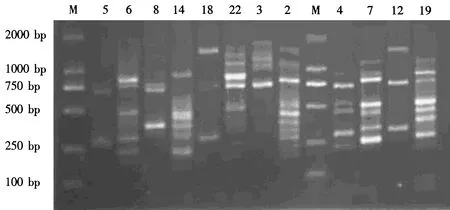
M为Marker DL2000。
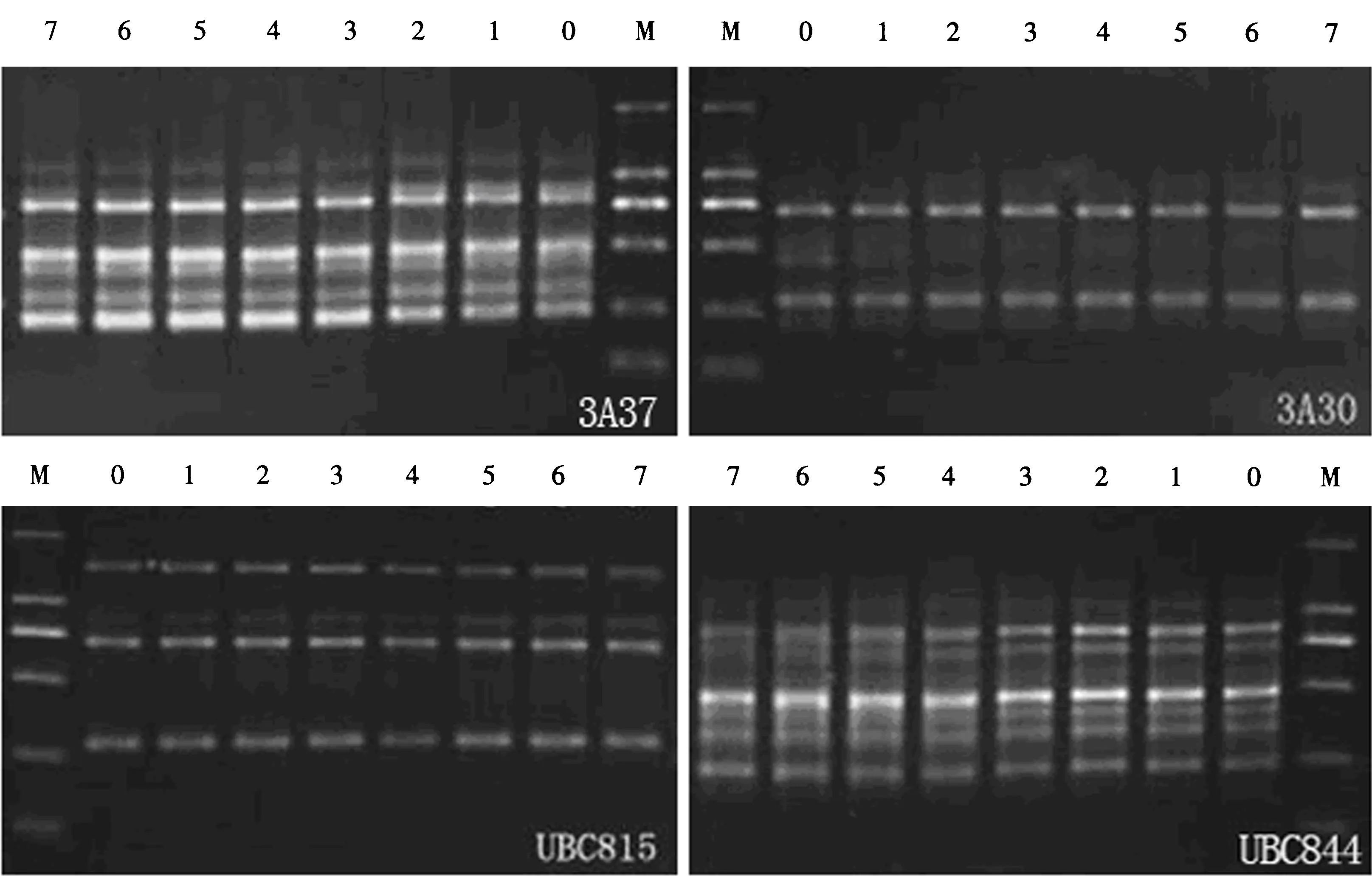
M为Marker DL2000;0为母本植株叶片;其余均为再生后的百合叶片。
2.5 遗传稳定性检验
对百合母株叶片和50株再生后叶片分别完成DNA提取后,采用前述Mix体系和已筛选出的4条引物,随机选取7株再生后叶片的DNA进行PCR扩增,扩增结果如图5所示。
从琼脂糖凝胶电泳检测结果来看,相同引物扩增出的条带较为一致,说明百合经离体再生培养后的再生植株在DNA水平上基本没有变化,未显示出与母株不同的多态性(图5),也可见百合组织培养过程中未引起植物体细胞无性系的明显变异,经离体再生培养后的植株与母株的遗传特性保持一致。
3 小结
东方百合具有极高的经济价值和观赏价值,市场需求量也逐渐增大。目前我国东方百合原种的种球主要以进口为主,价格昂贵,常规的分球繁殖方法繁殖系数较小,远不能满足市场需求[8]。采用组织培养的方法进行东方百合种苗(球)工业化生产是解决这一问题的有效途径[9]。将组织培养的方法用于快繁,关键在于保持其优良品性,这一点对于一些具有极高观赏价值的东方百合来说更为重要。采用ISSR分子标记对一定数量的随机引物进行分析,可以给出覆盖整个基因组DNA的多态性信息,并直接从DNA水平检测碱基序列的变化,因此可以从分子水平上阐明组培苗遗传稳定性的分子机理[10]。本研究应用ISSR分子标记技术对东方百合组培再生苗基因组DNA进行分析,得到的DNA片段无论是带型还是谱带的强弱、数目均与再生前的母株DNA一致。这说明再生苗在DNA水平上并未发生变异,其遗传物质是稳定的,保持了母株的遗传特性,这与前人关于土三七[11]、小蔓长春花[12]、越橘[13]等组培苗遗传稳定性的研究报道一致。由此可见,以组培快繁技术快速扩大东方百合原种的生产量是可行的。
[1]王清华.东方百合组织培养浅述[J].青海农林科技,2007(3):39-51.
[2]郑明文,吴祝华,席梦利,等.岷江百合ISSR-PCR反应体系的优化[J].林业科技开发,2007,21(6):19-22.
[3]张静,刘菊华,徐碧玉,等.东方百合高效离体再生体系的建立[J].热带作物学报,2011,32(2):269-272.
[4]赵庆芳,曾小英,丁兰,等.东方百合组织培养和快速繁殖研究[J].西北师范大学学报:自然科学版,2003,39(1):66-68.
[5]柳玉晶,龚束芳,樊金萍,等.百合愈伤组织的诱导及植株再生[J].东北农业大学学报,2007,38(3):352-355.
[6]袁芳亭,陈龙清.麝香百合的叶片离体培养及植株再生[J].湖北农业科学,2001(3):50-51.
[7]邹喻苹,葛颂,王晓东.系统与进化植物学中的分子标记[M].北京:科学出版社,2001:13-22.
[8]赵祥云,王树栋,陈新露,等.百合[M].北京:中国农业出版社,2000:52-61.
[9]邹迎春,覃大吉,魏代俊,等.东方百合组培快繁技术研究[J].湖北民族学院学报:自然科学版,2009,27(4):449-451.
[10]高丽,杨波,李洪林.叶艺春兰组培苗遗传稳定性的ISSR研究[J].亚热带植物科学,2007,36(2):13-17.
[11]岑举人,步怀宇,张来军,等.土三七不定芽直接发生与遗传稳定性的RAPD分析[J].核农学报,2010,24(3):502-506.
[12]何斌,侯恩太,王英娟,等.小蔓长春花组织培养快速繁殖中的遗传稳定性[J].植物生理学报,2012,48(2):197-201.
[13]李晓艳,张志东,李亚东,等.越橘组培苗遗传稳定性研究[J].吉林农业大学学报,2009,31(5):521-523.
(责任编辑:陈幼玉)
AssessmentofgeneticstabilityofleavesinvitroregeneratedfromorientallilybyISSR
YU Hai-ling1,2,WANG Fa-guo1,LI Shi-yu1,2
(1.South China Botanical Garden,Chinese Academy of Sciences,Guangzhou,Guangdong 510650,China;2.University of Chinese Academy of Sciences,Beijing 100049,China)
The optimal ISSR-PCR reaction conditions in oriental lily Siberia(Lilium×Siberia)was established according to the main parameters.The Mix system was adopted for primer screening and the best primers drawn were 3A30,3A37,UBC815,UBC844.Using the experimental optimization primers and the Mix system,the genetic stabilites of the leaves before and after regeneration were investigated.The results showed that the genetic stabilities of the leaves before and after regeneration did not change sigenificantly.The genetic stabilities were high.Therefore,tissue culture methods can be used to expand the production of original oriental lily.
oriental lily;ISSR;leaves regeneration;genetic stability
2013-12-25
于海玲(1988-),女,硕士研究生。研究方向:园林植物应用。
S682.2+9
A
1673-0925(2014)01-0035-06

