1,6-二磷酸果糖对慢性阻塞性肺疾病急性加重期患者动脉血气及肺功能的影响
叶 青 邝 军 朱建勇 张立波 何 敏
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)在我国疾病死亡排序中,占第3位,而在农村,COPD则占死亡原因的首位[1]。COPD的患者大部分为中老年人,一般情况差,呼吸衰竭和严重的电解质紊乱为其常见的晚期表现,大部分患者最终可因电解质紊乱、营养不良难以纠正而导致死亡。1,6-二磷酸果糖是细胞内糖酵解的中间产物,是一种高能物质,它作用于细胞膜,通过激活细胞膜上的磷酸果糖激酶,增加细胞内高能磷酸键和三磷酸腺苷(adenosine triphosphate, ATP)浓度,增强心肌收缩力,增加心输出量。另外还可抑制氧自由基的释放,现已在临床上广泛应用[2]。本研究将1,6-二磷酸果糖应用于COPD急性加重期(AECOPD)患者,观察其对患者血气及肺功能的影响,评价其对AECOPD患者的疗效。
材料与方法
一、观察对象
选取2012年10月至2013年5月在我院住院治疗,且临床诊断为AECOPD的患者60例。诊断均符合中华医学会呼吸病学分会制定的《慢性阻塞性肺疾病诊治指南(2007年修订版)》中的标准[3]。其中男38例,女22例,年龄57~88岁,平均63±7岁,治疗组30例、对照组30例,病史10~60年。两组患者在年龄、性别、病史、临床表现、影像学、肺功能检查方面比较差异无统计学意义(P>0.05)。
二、治疗方法
对照组采用常规治疗包括:低流量吸氧,抗菌药物的使用,支气管舒张剂,止咳,祛痰。治疗组在对照组治疗的基础上加用1,6-二磷酸果糖10 g/d静滴, 14 d为1疗程。
三、观察指标
分别抽取患者用药前和用药后静息及非吸氧状态下动脉血,立即应用美国GEM Premier 4000型全自动血气分析仪进行血气分析,检测PaO2、PaCO2、FEV1等指标。同时对患者用药前后进行肺功能检查。
四、疗效判定标准
有效:病情好转,症状、体征有所好转,实验室检查指标所恢复;无效:病情无明显改善甚至加重。计算出总有效率。
五、统计学方法
结 果
一、两组动脉血气、肺功能比较
治疗前两组患者PaO2、PaCO2、FEV1差异比较无统计学意义。治疗后治疗组PaO2、FEV1显著高于治疗前(P<0.05),也显著高于对照组治疗后(P<0.05),治疗组治疗后PaCO2显著低于治疗前(P<0.05),见表1。
二、疗效比较
两组治疗前后在症状、体征变化上,治疗组较对照组症状有明显的缓解,总体治疗有效率均明显高于对照组,平均住院日明显缩短,见表2、3。
讨 论
COPD是严重威胁老年人健康的疾病,其主要病理学特点是气道的持续性、慢性、非特异性炎症,同时伴有进行性肺损害,与吸入烟草烟雾等有害气体或颗粒的异常炎症反应有关,出现逐渐加重的低氧血症和/或二氧化碳潴留,最终导致呼吸衰竭[4-6]。1,6-二磷酸果糖是糖酵解中间产物,可作用于细胞膜。张士祥等[7]检测了血清酶的变化后发现1,6-二磷酸果糖对细胞膜有保护作用,可减少组织酶和其他物质的外泄。它还可促进细胞对循环中钾的摄取及刺激细胞内高能磷酸键和2,3-二磷酸甘油的产生。冯美云等[8]的研究认为1, 6- 二磷酸果糖可使机体抗脂质过氧化能力加强, 减少自由基生成及其对组织的损伤作用。另外,1,6-二磷酸果糖可增加红细胞内2,3-二磷酸甘油酯,降低红细胞脆性,增加红细胞在血管内的变形能力,且具有抑制红细胞聚集的能力,有利于改善微循环障碍[9]。动物实验也证实1,6-二磷酸果糖对肺微循环和肺功能具有保护性作用[10-11]。目前,对AECOPD患者营养治疗的新策略是及时改善线粒体功能,线粒体是以ATP的形式为细胞提供能量的主要来源,而1,6-二磷酸果糖不用磷酸化即可进入三羧酸循环,并能较快改善线粒体能量代谢的紊乱以防止线粒体功能进一步受损,从而改善AECOPD患者的 PaO2、PaCO2以及营养状况,缩短控制感染时间[12]。AECOPD患者在使用氨茶碱、β2受体激动剂、糖皮质激素治疗时会严重消耗肾磷酸盐,导致血磷下降,出现低磷血症,而低磷酸血症和肾磷酸盐再吸收障碍之间有较高的相关性。有研究表明,低磷血症使肺泡表面活性物质生成减少,引起肺泡闭陷,进一步加重呼吸衰竭,故AECOPD患者适当补充磷酸盐对疾病的治疗及恢复具有重要意义[13]。

表1 两组治疗前后PaO2、PaCO2、FEV1比较
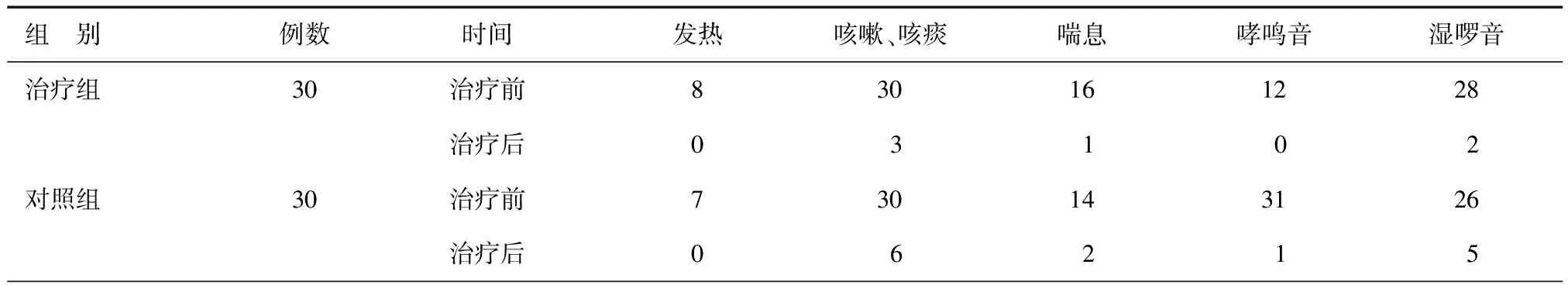
表2 两组患者治疗前后症状、体征变化情况(n)
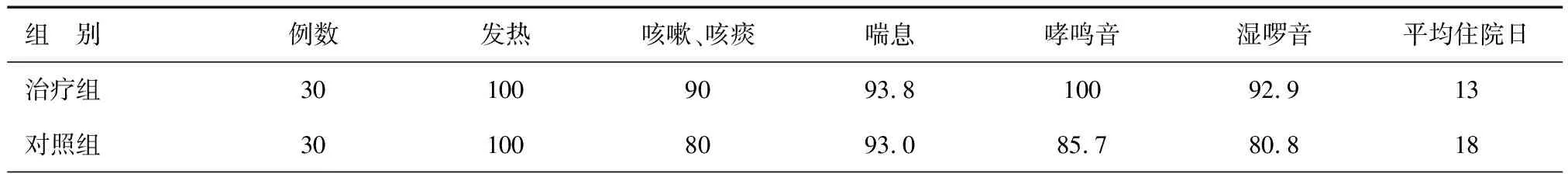
表3 两组治疗总有效率(%)和平均住院日(d)
另外,1,6-二磷酸果糖在抑制氧自由基的产生,稳定生物膜以及提高心肌收缩力、增加心脏每搏输出量方面能力突出。它作用于细胞膜时,可以刺激磷酸果糖酶的活性,使细胞内高能磷酸键激增,ATP和cAMP浓度增加,提高支气管平滑肌的舒张功能,从而解除气道痉挛,改善肺通气,对AECOPD患者的治疗有帮助。
本研究结果显示,治疗组在同等的基础治疗上使用1,6-二磷酸果糖后,动脉血气PaO2、PaCO2、FEV1较对照组有明显的改善,临床症状、体征均明显好转。提示1,6-二磷酸果糖用于AECOPD患者的治疗具有良好的效果,值得推广使用。
参 考 文 献
1 张爱兵. C反应蛋白检测在COPD急性加重期的诊断价值分析[J]. 中国医药导刊, 2011, 13(7): 1240-1242.
2 肖华凤, 杨 敏, 潘尚仁, 等. 1,6-二磷酸果糖的体内过程研究[J]. 中国医药导报, 2012, 4(2): 42-44.
3 中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南(2007年修订版)[J]. 中华结核和呼吸杂志, 2007, 30(1): 8-17.
4 Rabe KF, Hurd S, Anzueto A, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary[J]. Am J Respir Crit Care Med, 2007, 176(6): 532-555.
5 Hui CKM, Chung KF. Indacaterol: pharmacologic profile, efficary and safety in the treatment of adults with COPD[J]. Expert Rev Respir Med, 2011, 5(1): 9-16.
6 郭 伟, 张 杰. 慢性阻塞性肺疾病患者气道黏液高分泌的研究与临床治疗[J]. 中华实用内科杂志, 2007, 27(17): 1390.
7 张士祥, 冯美云. 1,6-二磷酸果糖营养液对小鼠肾脏、心肌、骨骼肌组织及其血清自由基代谢的影响[J]. 北京体育大学学报, 1996, 19(3): 23-29.
8 冯美云, 王习霞. 1,6-二磷酸果糖营养液对人体抗疲劳能力的影响[J]. 中国运动医学杂志, 1996, 15(3): 219-224.
9 李跃萍, 刘 苏. 1,6-二磷酸果糖对自体肺体外循环中肺组织的保护作用[J]. 中国热带医学, 2011, 11: 872-873.
10 薛庆亮, 汪建新, 江 宏. 1,6-二磷酸果糖对肺微循环和肺功能的保护性作用[J]. 中国临床康复, 2005, 9: 98-100.
11 Nunes FB, Simoes Pires MG, Alves Filho JC, et al. Physiopathological studies in septic rats and the use of fructose 1,6-bisphosphate as cellular protection[J]. Crit Care Med, 2002, 30: 2069-2074.
12 庞晓军, 杜正隆, 曾 红, 等. 强化肠外营养治疗慢性阻塞性肺疾病急性加重期患者的临床观察[J]. 中国药房, 2010, 21: 2612-2614.
13 肖 瑶. 低磷血症的发生及其对机体的影响[J]. 临床和实验医学杂志, 2007, 6: 161-163.

