肺癌化疗相关性白细胞减少的危险因素分析
罗 莉 张明周 朱小莉 吴学玲
肺癌是目前最常见的恶性肿瘤之一,其病死率居恶性肿瘤之首[1-2]。化疗是肺癌综合治疗的重要方法之一,化疗相关性白细胞减少(chemotherapy-induced leucopenia, CIL)是化疗最常见也是最严重的不良反应,不仅延缓化疗进程而影响治疗效果,并且可能导致严重的并发症而危及患者生命[3]。因此,及时发现CIL的危险因素并采取相应措施以避免其发生是肺癌化疗的一个重要环节。本研究通过对肺癌化疗后CIL相关影响因素的回顾性分析,旨在探讨发生CIL的危险因素,为预防和减少肺癌化疗后CIL的发生,提高患者的生活质量提供依据。
对象与方法
一、研究对象
选择第三军医大学新桥医院呼吸科2013年1月至2013年7月收治的肺癌化疗患者292例,均经组织病理学确诊为肺部恶性肿瘤,所有患者化疗前、后至少各有一次血常规检查结果,且化疗前未接受重组人粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)治疗。如系多次化疗,选择白细胞最低的一次纳入研究。根据化疗后白细胞计数是否减少,分为CIL组(CIL组)和无CIL组(对照组)。
二、研究方法
首先对两组病例进行人口学资料(性别、年龄、基础疾病)统计。然后对可能引起CIL的影响因素进行分析:包括体质量下降率(体质量下降值/基础体重)、PS评分、肝功能、肾功能、治疗前白细胞计数、治疗前血小板计数、治疗前血红蛋白计数、肺癌分期、骨转移、化疗药物相对剂量强度(RDI=实际用药量/标准用药量)、曾接受化疗次数、曾接受放疗、最近28 d内放疗等13项。
三、统计学处理
利用SPSS13.0软件建立数据库,计量资料采用t检验,计数资料采用χ2检验。将可能引起CIL的影响因素纳入单因素分析,对两组间差异有统计学意义的临床指标采用Binary Logistic回归,计算OR值及其95%可信限,进一步筛选出发生CIL的独立危险因素。
结 果
一、人口学资料
共292例肺癌化疗患者纳入研究,CIL组192例,对照组100例。CIL组中女性44例,男性148例,平均年龄(59.7±0.64)岁,其中高龄患者(60岁以上)104例,共70例有基础疾病。对照组中女性25例,男性75例,平均年龄(57.9±1.07)岁,高龄患者47例,共39例有基础疾病。两组的性别(P=0.691)、年龄(P=0.245)、基础疾病(P=0.670)差异无统计学意义,见表1。
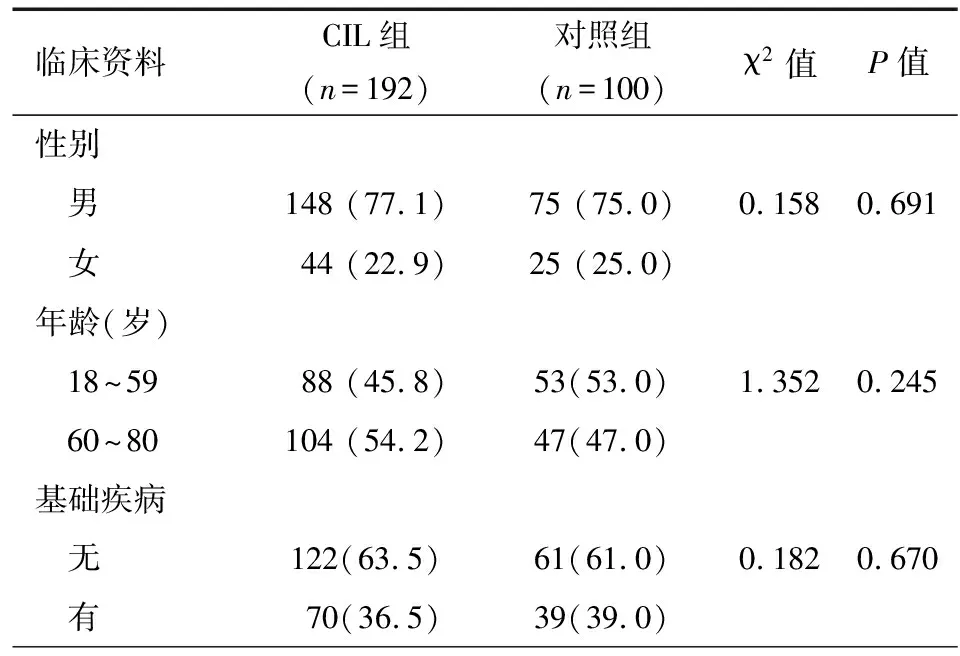
表1 人口学临床资料[n(%)]
二、临床特点比较
将可能引起CIL的影响因素共13项纳入单因素分析,结果显示,在α=0.05的水准上,CIL组在体质量下降率、PS评分、治疗前白细胞计数、治疗前血小板计数、曾接受化疗次数等5个方面,与对照组比较差异有统计学意义(P<0.05),见表2。
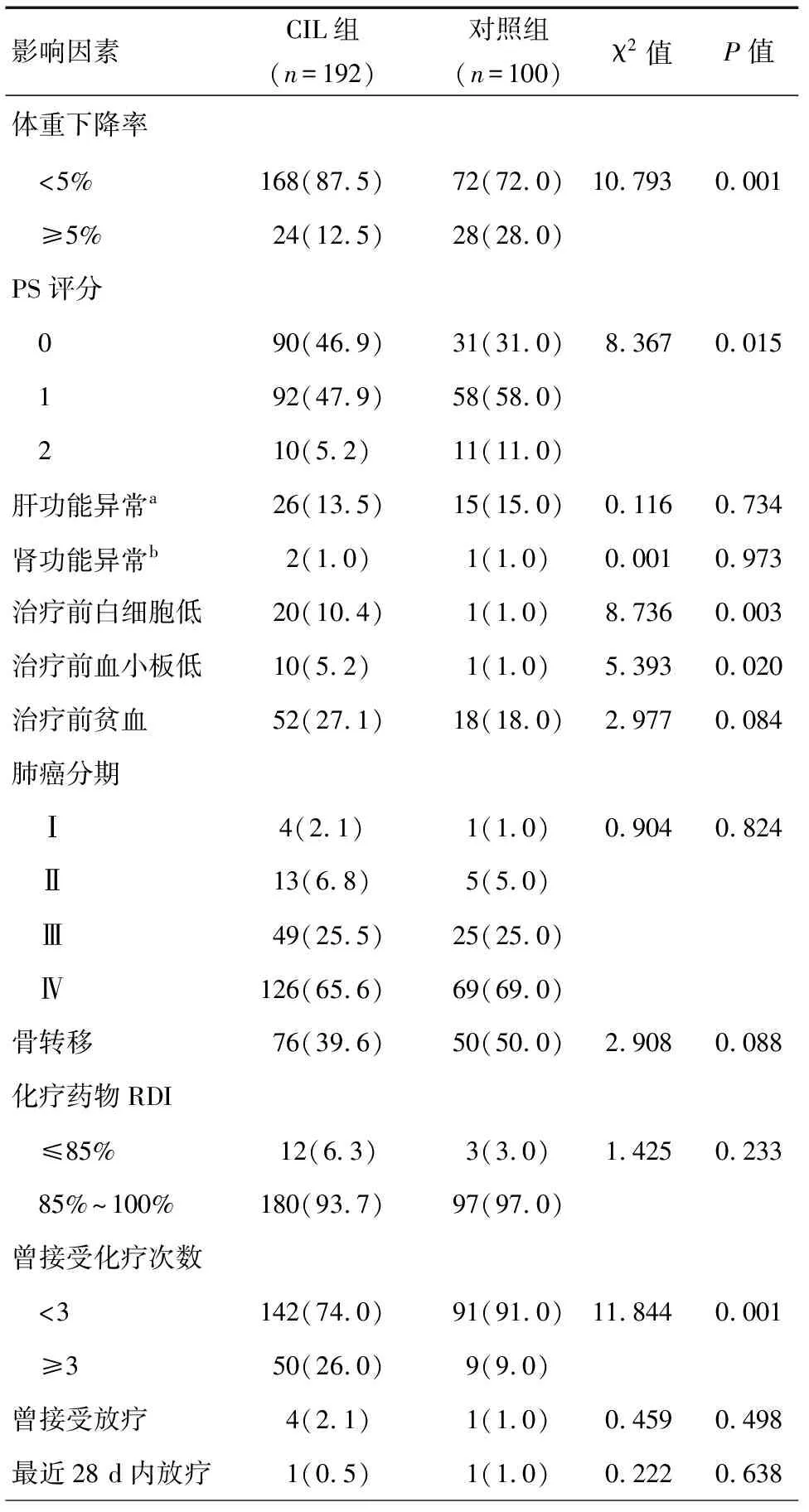
表2 两组临床特点差异性比较[n(%)]
三、危险因素分析
将表2中差异有统计学意义的5个因素引入Binary Logistic回归方程,如表3、4所示,最终筛选出3个因素有统计学意义,说明治疗前白细胞减低、体质量下降率≥5%、曾接受化疗次数≥3是发生CIL最主要的危险因素。在控制其它影响因素的前提下,体质量下降率≥5%患者发生CIL的可能性,是<5%患者的3.086(1/0.324)倍(P=0.001<0.05);治疗前白细胞减低患者是正常者的11.852倍(P=0.019<0.05);曾接受化疗次数≥3患者是<3患者的2.709倍(P=0.013<0.05)。

表3 Binary Logistic回归分析变量赋值表
讨 论
大多数肺癌在发病初期症状隐匿、无特异性,容易被人们忽视,导致确诊时以中晚期肺癌居多,错过了手术治疗的最佳时机,因而化学药物治疗成为肺癌患者的首选治疗方案[4]。血液学毒性,特别是CIL是许多细胞毒化疗药物的主要剂量相关性不良反应[5]。CIL常导致感染机率增加、化疗进程延迟、化疗药物剂量受限,进而降低化疗疗效,影响患者的生活质量,增加病死率和医疗费用[6-13]。近来有研究表明,Ⅲ~Ⅳ级CIL(白细胞计数<2×109/L)的发生率达16~59%[14]。因此,对肺癌化疗患者发生CIL的危险性进行评估,具有重要的实践意义。
本研究回顾性分析了我院呼吸科2013年1月至2013年7月收治的292例肺癌化疗患者的临床资料,共192例发生CIL,占65.8%,其中28例(14.6%)为Ⅲ~Ⅳ级CIL,与文献报道一致[14-15]。对可能与CIL相关的影响因素进行了单因素和多因素分析,结果表明,治疗前白细胞减低、体质量下降率≥5%、曾接受化疗次数≥3是肺癌化疗患者发生CIL的最主要危险因素。
骨髓中各类造血细胞减少的机率决定于细胞生命半衰期的长短。白细胞、血小板、红细胞的半衰期依次为6 h、5~7 d和120 d,由此可见白细胞最容易受到影响而减少。治疗前白细胞水平低,较为敏感地反映出骨髓粒系造血功能已有一定程度的降低,这类患者化疗后更容易发生骨髓抑制。本研究中CIL组有20例(10.4%)为治疗前白细胞减低患者,对照组仅1例(1.0%)(P=0.003<0.05),多因素分析表明,治疗前白细胞减低患者发生CIL的可能性是正常患者的11.852倍(P=0.019<0.05),显示了治疗前白细胞减低在预测CIL发生中的重要价值。结合本研究的情况,认为治疗前白细胞减低的发生可能与以下原因有关:①肿瘤晚期发生骨转移,肿瘤细胞已扩散到髓造血系统,直接抑制骨髓的正常造血功能[16]。本研究CIL组20例治疗前白细胞减低患者中,有7例伴发骨转移,占35%;②患者已接受过多次放化疗,正处于前次放化疗的骨髓抑制期;③化疗后多数患者出现胃肠道不良反应,导致进食差,营养不良,进而影响骨髓造血。
晚期肺癌患者的肿瘤负荷大,肿瘤细胞消耗营养物质多,而肿瘤细胞分泌所谓的“厌食因子”,也会导致患者食欲下降,加之化疗后大量的肿瘤细胞分解代谢,加重了消化系统的负担,出现不同程度的消化道反应,直接影响患者的进食和消化吸收,从而导致患者的营养不良,体重进行性下降,进而影响骨髓的增殖功能[17-18]。本研究结果显示体重下降程度与CIL的发生密切相关,体重下降率≥5%患者与<5%的患者相比,发生CIL的可能性增加了2.086(1/0.324-1)倍(P=0.001<0.05)。因此对化疗后消化道反应严重的患者应及时补充必需的营养物质,并给予止吐、抑酸、保护胃黏膜、增进食欲等对症治疗,以减轻化疗的消化道毒副反应,力图减少和避免严重骨髓抑制的发生。
本研究亦显示曾接受化疗次数超过3次也是发生CIL的危险因素之一,CIL组有50例(26.0%)在本次治疗前已接受过3次以上化疗,对照组仅9例(9.0%)(P=0.001<0.05)。多因素分析表明,曾接受3次以上化疗的患者发生CIL的可能性是3次以下患者的2.709倍(P=0.013<0.05)。其原因可能与化疗药物的接触性毒性和毒性蓄积作用有关。化疗药物的骨髓抑制作用主要表现在促进骨髓纤维化、功能抑制和阻止骨髓内成熟的血细胞释放这三个方面[19]。化疗初始阶段(第1~2周期)多以功能抑制和阻止血细胞释放入血为主。随着化疗次数增加,化疗药物可通过促进骨髓纤维化,而导致严重的骨髓抑制反应。因此,结合本研究结果,对于曾接受化疗次数超过3次的患者,应视为发生CIL的高危人群,严密监测血常规,针对性地采取预防措施,防止骨髓功能受到进一步抑制,促进骨髓功能的恢复是完全必要和可行的。
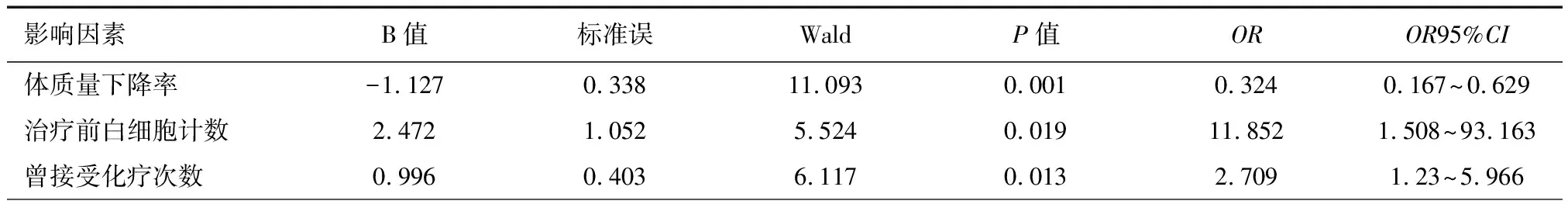
表4 CIL危险因素分析(多因素分析)
CIL的发生是受到多种因素共同影响的,临床医生可通过评估肺癌化疗患者发生CIL的风险,预防性应用粒细胞集落刺激因子,降低化疗后骨髓抑制的程度和持续时间,帮助患者度过感染高危期,有助于化疗的顺利施行和患者生存质量的改善[20]。
参 考 文 献
1 Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009[J]. CA Cancer J Clin, 2009, 59(4): 225-249.
2 钱桂生. 肺癌不同病理类型发病率的变化情况及其原因[J/CD]. 中华肺部疾病杂志: 电子版, 2011, 4(1): 1-5.
3 刘秋菊, 姜玉珍, 贾姣源. 化疗后骨髓抑制危险因素分析[J]. 江西医学院学报, 2005, 45(3): 48-50.
4 叶 清, 蒋捍东. 肺癌患者血清肿瘤标志物水平变化与化疗疗效及生存时间的相关性[J/CD]. 中华肺部疾病杂志: 电子版, 2013, 6(6): 500-503.
5 Lyman GH. Risks and consequences of chemotherapy-induced neutropenia[J]. Clin Cornerstone, 2006(8 Suppl 5): S12-S18.
6 National Comprehensive Cancer Network. 2005. NCCN clinical practice guidelines in oncology: myeloid growth factors in cancer treatment[M]. Version 2. 2005.
7 Dolan S, Crombez P, Munoz M. Neutropenia management with granulocyte colony-stimulating factors: from guidelines to nursing practice protocols[J]. Eur J Oncol Nurs, 2005, 9(suppl 1): S14-S23.
8 Weycker D, Edelsberg J, Kartashov A, et al. Risk and healthcare costs of chemotherapy-induced neutropenic complications in women with metastatic breast cancer[J]. Chemotherapy, 2012, 58(1): 8-18.
9 Padilla G, Ropka ME. Quality of life and chemotherapy- induced neutropenia[J]. Cancer Nurs, 2005, 28(3): 167-171.
10 Ashley J, Taylor D, Houts A. The experience of chemotherapy- induced neutropenia: quality-of-life interviews with adult cancer patients[J]. J Support Oncol, 2004, 2(Suppl 2): 66-67.
11 Calhoun EA, Chang CH, Welshman EE, et al. The impact of chemotherapy delays on quality of life in patients with cancer[J]. J Support Oncol, 2004, 2(Suppl 2): 64-65.
12 Lyman GH, Kuderer NM. Filgrastim in patients with neutropenia: potential effects on quality of life[J]. Drugs, 2002, 62(Suppl 1): 65-78.
13 Former BV, Schwartzberg L, Tauer K, et al. Impact of chemotherapy-induced neutropenia on quality of life: a prospective pilot investigation[J]. Support Care Cancer, 2005, 13(7): 522-528.
14 Li J, Dai CH, Shi SB, et al. Induction concurrent chemoradiotherapy compared with induction radiotherapy for superior sulcus non-small cell lung cancer: a retrospective study[J]. Asia Pac J Clin Oncol, 2010, 6(1): 57-65.
15 ESMO. ESMO recommendations for the application of hematopoietic growth factors (hGFs) [J]. Ann Oncol, 2001, 12(9): 1219-1220.
16 Khafagy R, Shackley D, Samuel J, et al. Complications arising in the final year of life in men dying from advanced prostate cancer[J]. J Palliat Med, 2007, 10(3): 705-711.
17 郜启全, 张建平, 朱守洋, 等. 肿瘤患者化疗后粒细胞缺乏发生因素的临床分析[J]. 淮海医药, 2007, 25(5): 439-440.
18 Lyman GH, Lyman CH, Agboola O, et al. Risk models for predicting chemotherapy-induced neutropenia[J]. The Oncologist. 2005, 10(6): 427-437.
19 王柳春, 孙 慧, 李 凯, 等. 黄芪多糖与粒细胞集落刺激因子对化疗后骨髓功能的影响[J]. 中国肿瘤临床, 2008, 35(23): 1373-1376.
20 Heuser M, Ganser A, Bokemeyer C, et al. Use of colony-stimulating factors for chemotherapy-associated neutropenia: review of current guidelines[J]. Semin Hematol, 2007, 44(3): 148-156.

