巢式实时荧光定量聚合酶链反应检测结核分枝杆菌DNA的临床应用
孟小蓉 包 勇 李 凯 曹 敏 纪风兵
结核病是全球主要公共卫生问题之一,严重危害人类健康。虽然近年来全球防控措施逐渐增强,但其庞大的患病基数、人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染率上升、多耐药结核菌株增加等原因导致结核病的防控仍面临严峻形势[1]。世界卫生组织(WHO)2012结核病报告显示2011年全球新增结核病例870万,死亡140万[1]。诊断延迟是导致我国结核病防治工作进度缓慢的最主要原因[2]。目前,传统病原学检测方法如抗酸杆菌涂片和结核分枝杆菌(Mycobacteriumtuberculosis, MTB)培养,存在敏感性低、特异性差、操作繁琐、检测周期长等缺点。聚合酶链反应(polymerase chain reaction, PCR)技术以其高敏感性、操作简单快捷、不受环境和患者体质及用药影响等优点在结核病早期诊断中具有优越性,其中以能够准确定量、动态监测的实时荧光定量PCR技术最为常用。但是,该方法存在费用高、特异性差、对底物模板浓度要求高等缺点,使其对于单位体积MTB微量的样本敏感性更低,假阴性率升高。目前有学者将实时荧光定量PCR和巢式PCR两种技术结合,即巢式实时荧光定量PCR(quantitative nested real-time polymerase chain reaction, QNRT-PCR),用于乙肝病毒、人T细胞白血病病毒、人乳头瘤病毒等检测,均证实其有效弥补了实时荧光定量PCR缺点,具有更好的临床应用价值[3-5]。目前尚无将此方法应用于MTB DNA含量检测的报道,本研究拟建立QNRT-PCR检测MTB DNA方法,旨在探讨其在结核病诊断中的临床应用价值。
材料与方法
一、实验材料
1. 样本收集: 本研究自2012年6月至2013年10月,共采集24例肺结核患者痰液(取患者清晨漱口后留取晨痰于清洁痰杯中,1 h内送检)24份,25例结核性胸膜炎患者胸水(于胸腔穿刺后留取60 ml胸水于高压灭菌玻璃瓶内,立即分离,若不能立即分离样本置于4 ℃保存,不超过72 h)27份,对照组痰和胸水共75份。所有病例均取自成都市第三人民医院呼吸内科、成都市传染病院以及成都医学院第一附属医院传染病科[6-7]。 其中,肺结核的确诊以痰培养为“金标准”。结核性胸膜炎为临床诊断,诊断标准如下:①患者有结核中毒症状并伴有胸腔积液;②胸腔积液生化检测为渗出液;③至少观察抗结核治疗1个月有效,胸腔积液未再复发;④排除其它性质胸腔积液。
2.仪器试剂: 3.5荧光定量PCR仪(罗氏,瑞士)、PCR仪(Bio-RAD,美国)、低温冷冻离心机(Thermo)、低速离心机(Thermo)、六一普通水平电泳仪(北京)、核酸蛋白分子成像仪(德国,Eppendorf);细菌DNA提取试剂盒(全式金)、普通PCR试剂盒(全式金)、荧光定量PCR试剂盒(全式金)、针对特异结核分枝杆菌复合群MPT64基因设计引物[8],具体序列如下:外套上游引物(F-1): 5′-ATCCGCTGCCAGTCGTCTTCC-3′,外套下游引物(R-2):5′-CTCGCGAGTCTAGGCCAGCAT-3′,内套上游引(F-2): 5′-CATTGTGCAAGGTGAACTGAGC-3′,内套下游引物(R-2):5′-AGCATCGAGTCGATCGCGGAA-3′由上海生物工程股份有限公司合成,扩增片段分别为241 bp和201 bp。
二、实验方法
1. 标本前处理及DNA提取: 取痰液0.5 ml或胸水60 ml,以2~8 ℃,离心半径8 cm,12 000 r/min离心15 min,弃上清液;然后加生理盐水500 μl,斡旋混匀,室温下,以半径离心8 cm,12 000 r/min离心3 min,弃上清液,重复三次,取沉淀物提取DNA或-20 ℃保存备用。DNA的提取采用细菌DNA提取试剂盒(全式金),严格按照操作步骤进行。
2. 构建标准品: 以H37vRV标准菌株(由成都市第三人民医院实验医学部保存提供)为模板,采用F-2、R-2内套引物,进行常规PCR扩增,反应条件为引物各0.6 μl,Mix 12.5 μl,模板2 μl,加ddH2O至25 μl体系,扩增目的片段为201 bp,设置参数为94 ℃预变性3 min,然后94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min循环25次,72 ℃延伸10 min,反应完成后取PCR产物于2%琼脂糖凝胶电泳分析,在略大于200 bp处可见目的条带,将目的条带割胶回收与pGM-T载体连接,16 ℃过夜,并将连接液转化入大肠杆菌αH5感受态细胞进行氨苄抗生素筛选,再进行摇菌扩大培养,最后提取质粒行PCR电泳和测序鉴定,紫外分光光度计测定鉴定正确质粒OD260为0.5,OD260/OD280为1.83,根据公式:质粒拷贝数浓度(拷贝/ml)=(质量÷分子量)×6.02×1023,计算出质粒拷贝浓度为7.09×1012拷贝/ml,将其10倍系列稀释成含有1×103、1×104、1×105、1×106、1×107、1×108copy/μl的6个梯度, 作为检测MTB DAN的阳性参照定量标准品[8]。
3. 标准曲线的建立: 将7.09×1012拷贝/ml质粒倍比稀释后取7.09×102~7.09×109copy/μl的8个梯度,得到该方法在1×104~1×108拷贝/ml范围内,随着起始模板量的减少,对应的Ct值(每个反应管内的荧光信号到达设定的域值时所经历的循环数)相应增大,两者间呈线性关系,r=0.99,且溶解曲线呈单峰,见图1。

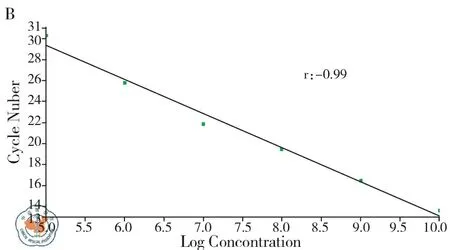
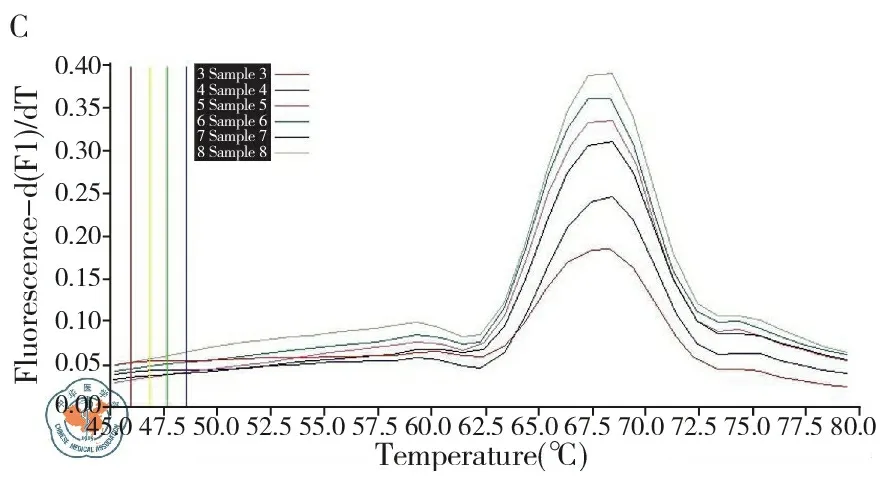
注:A:扩增曲线;B:标准曲线;C:溶解曲线
4. QNRT-PCR反应体系及条件: QNRT-PCR反应分两步,第一步,采用Bio-RAD PCR仪,反应体系为10 μl 2×PCR mix,引物F-1和R-1各0.16 μl,ddH2O 8.68 μl,模板(DNA提取物)2 μl,共20 μl体系,反应条件为预变性94 ℃ 3 min,变性94 ℃ 30 s,退火62 ℃ 30 s,复性72 ℃ 1 min,循环15次,然后再72 ℃ 10 min,循环1次;第二步,采用3.5荧光定量PCR仪,反应体系为2×qPCR mix 15 μl,enhancer 0.4 μl,引物F-2和R-2各0.2 μl,ddH2O 15 μl,模板为第一轮PCR反应产物0.15 μl,共30 μl反应体系,反应条件为荧光定量PCR两步法,即预变性94 ℃ 3 min,循环1次,然后变性94 ℃ 30 s,退火62 ℃ 30 s,循环35次,溶解曲线温度40~80 ℃。同时,所有样本均进行巢式PCR和荧光定量PCR方法检测,定量PCR反应条件同巢式实时荧光定量PCR第二步,巢式PCR反应条件第一步同巢式实时荧光定量PCR,第二步为预变性94 ℃ 3 min,循环1次,变性94 ℃ 30 s,退火60 ℃ 30 s,复性72 ℃ 1 min,循环25次,最后再72 ℃ 10 min,循环1次。
三、统计学方法
数据采用SPSS 19.0软件分析,两组计数资料分析采用卡方检验,两组均数间比较采用两样本比较t检验,组内两种PCR检测方法间的比较采用配对t检验,P<0.05表示具有统计学意义。
结 果
一、 患者的基本临床特征
本研究共纳入126例患者,其中肺结核24例,结核性胸膜炎渗出性27例,对照组病例主要为普通细菌性肺炎、肺真菌病、恶性胸腔积液、漏出性胸腔积液。所有患者的临床信息,包括年龄、性别、结核分枝杆菌培养和涂片、病理组织学、胸部影像学结果等,见表1。
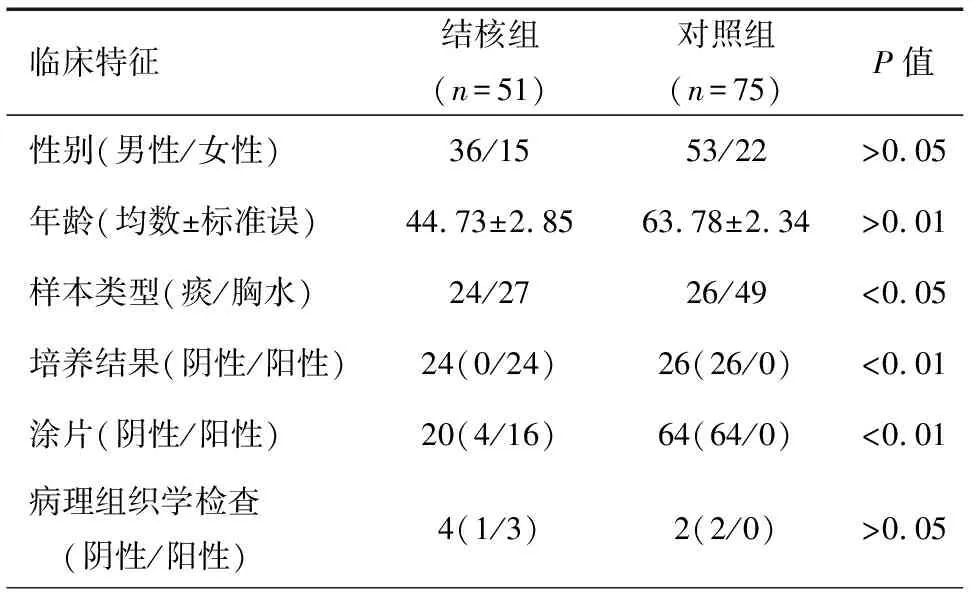
表1 患者临床资料
二、QNRT-PCR特异性、敏感性、重复性
以痰培养结核分枝杆菌阳性肺结核确诊标准,检测24份来自肺结核患者的痰MTB DNA,结果敏感性、特异性、阳性预测值、阴性预测值分别为95.83%、61.54%、69.70%和94.12%;以内科胸腔镜胸膜活检的组织病理学结果为金标准,巢式实时荧光定量PCR敏感性和特异性分别为75%和100%; 另外,所有检测结果至少重复2次,统计学结果无差异(P<0.05),重复性好,见表2。
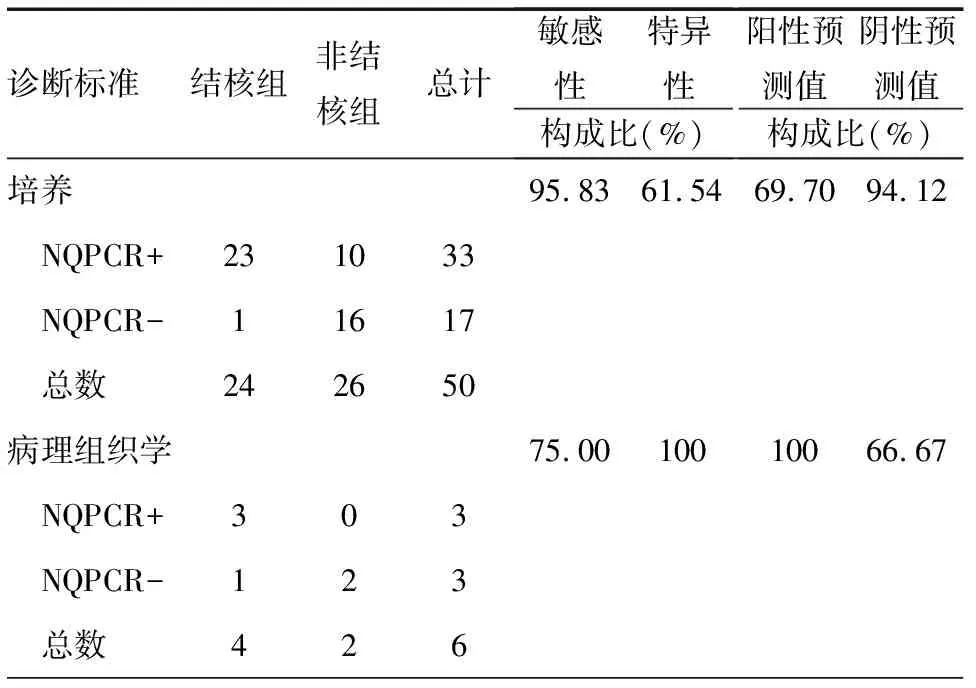
表2 QNRT-PCR诊断性能
QNRT-PCR、实时荧光定量PCR、巢式PCR三种方法检测结果比较阳性率差异具有统计学意义(P<0.05),QNRT-PCR的敏感性最高;且两种定量PCR检测结果比较,QNRT-PCR的 Ct值较小,见表3。
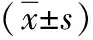
表3 三种PCR方法比较
三、QNRT-PCR在结核性胸膜炎的临床应用
本研究进一步将QNRT-PCR用于胸水中MTB DNA的检测。结果显示:在27例临床诊断结核性胸膜炎患者中,该方法检测阳性率达70.37%,明显高于单独采用荧光定量PCR及巢式PCR的阳性率66.67%及11.11%。
讨 论
QNRT-PCR是一种新的PCR技术,是在巢式PCR和定量PCR基础上改进和创新的技术。在结核病的诊断中,有日本学者先后于2006年、2008年两次报道应用该方法检测脑脊液中MTB DNA,敏感性和特异性分别为95.8%、100%,但样本例数仅有25例[10]。本研究首次以痰和胸水为样本,评价了QNRT-PCR在肺结核和结核性胸膜炎诊断中的检验性能,同时增加样本量及样本类型。
众所周知,传统的实时荧光定量PCR技术常用于临床样本的感染性病原体DNA定性和/或定量检测,但极少用于MTB DNA的准确定量[11-14]。因此,本研究以结核分枝杆菌MPT64基因部分序列为目的片段进行了分子克隆,构建了标准品,能准确定量底物模板中的拷贝数,并以培养为金标准,共检测了50份痰样本。QNRT-PCR敏感性高达95.83%,明显高于本研究中同步进行的实时荧光定量PCR 40%的敏感性,且前者Ct值的均数和标准差更小。分析其可能的原因有: ①本研究采用了本实验室新的细菌DNA提取方法,提高了DNA的提取效率;②MPT64基因被认为MTB最敏感和特异的序列[8],以其合成特异的引物有利于提高PCR扩增效率;③在定量PCR中,本研究运用高敏感性的SYBR Green染料法;④最重要的是,该方法中巢式PCR技术的应用,同传统的一步实时荧光定量PCR技术相比较,进一步提高了检测的敏感性和特异性。
在26份培养阴性的痰标本中,QNRT-PCR检测阳性10例(38%)。与此不同的是2例病理组织学阴性的痰标本QNRT-PCR结果都呈阴性;另一方,本研究同时对MTB、鲍曼不动杆菌、肺炎克雷伯杆菌、金黄色葡萄球菌、屎肠球菌、白色念珠菌共5株标准菌株的DNA进行检测,除MTB外,其它菌株及阴性对照Ct值>35或未扩增,再行琼脂糖凝胶电泳显示仅有MTB菌株样本在201 bp处见清晰条带,其它菌株及阴性对照结果均呈阴性。因此,本研究中较高的假阳性可能与MTB培养-即“金标准”本身敏感性低有关。另外,临床样本的混合性、复杂性,也有可能是影响PCR扩增结果的因素。
由于发病机制的原因,结核性胸膜炎的病原学诊断一直是个难题,胸水MTB培养敏感性仅有10%~35%[14]。在本研究中,共检测27例临床诊断结核性胸膜炎患者的27份胸水,QNRT-PCR、实时荧光定量PCR、巢式PCR、阳性率分别为74.37%、66.67%、11.11%。结果表明,针对胸水这种少量MTB样本特性,QNRT-PCR具有明显的优越性。
QNRT-PCR检测是一种合并巢式PCR高敏感性和实时荧光定量PCR动态监测、准确定量的新技术,进一步提高了其检测的特异性、增加了检测样本量及样本类型,将有利于临床结核病的诊断。
参 考 文 献
1 田攀文, 文富强. 肺结核复发危险因素的研究进展[J/CD]. 中华肺部疾病杂志: 电子版, 2013, 6(2): 159-161.
2 World Health Organization. WHO Global Tuberculosis Report 2012 [DB/OL]. WHO/HTM/TB/2012.6 . Geneva:WHO 2013. http://www.who.int/tb/publications/global_report/en/index.html.
3 陈建新, 文 芳. TaqMan-PCR技术定量检测脑脊髓液结核分枝杆菌DNA的研究[J]. 中华检验医学杂志, 2008,12(31): 1388-1389.
4 许春海, 李兆申, 代俊英, 等. 单核细胞乙型肝炎病毒cccDNA检测方法及应用价值[J]. 中华实验和临床病毒学杂志, 2011, 25 (4): 307-309.
5 Ishihara K, Inokuchi N, Tsushima Y, et al. Relevance of molecular tests for HTLV-1 infection as confirmatory tests after the first sero-screening[J]. J Immunoassay Immunochem, 2014, 35(1): 74-82.
6 Hernández-Arteaga S, López-Revilla R. Ultrasensitive quantitation of human papillomavirus type 16 E6 oncogene sequences by nested real time PCR[J]. Infect Agents Cancer, 2010, 5: 9-16.
7 魏莉娜, 方 丛, 黄 睿, 等. GDF9和BMP15在PCOS患者刺激周期卵母细胞不同成熟阶段的表达变化及意义[J]. 中华妇产科杂志, 2012, 47(11): 818-822.
8 Wang JY, Lee LN, Chou CS, et al. Performance assessment of a nested-PCR assay (the RAPID BAP-MTB) and the BD ProbeTec ET system for detection of Mycobacterium tuberculosis in clinical specimens[J]. J Clin Microbiol, 2004, 42(10): 4599-4603.
9 Takahashi T, Nakayama T. Novel technique of quantitative nested real-time PCR assay for Mycobacterium tuberculosis DNA[J]. J Clin Microbiol, 2006, 44(3): 1029-1039.
10 孟 茹, 陈创夫, 张 辉, 等. 结核杆菌实时荧光定量PCR快速检测方法的建立及应用[J]. 中国农学通报, 2010, 26(10): 1-4.
11 Takahashi T, Tamura M, Asami Y, et al. Novel wide-range quantitative nested real-time PCR assay for Mycobacterium tuberculosis DNA: clinical application for diagnosis of tuberculous meningitis[J]. J Clin Microbiol, 2008, 46(5): 1698-1707.
12 Rosso F, Michelon CT, Sperhacke RD, et al. Evaluation of real-time PCR of patient pleural effusion for diagnosis of tuberculosis[J]. BMC research notes, 2011, 4: 279.
13 辛茶香, 刘珍琼, 熊国亮. 荧光定量PCR技术检测结核分支杆菌DNA的应用价值[J]. 国际检验医学杂志, 2007, 28(3): 196-197.
14 李文楷. 支气管肺泡灌洗液实时荧光定量聚合酶链反应检测结核分枝杆菌-DNA对肺结核的诊断价值[J]. 西部医学, 2011, 23(10): 1954,1956.
15 应春妹, 汪雅萍, 张灏晏, 等. 荧光定量PCR技术在结核分枝杆菌检测中的应用[J]. 上海交通大学学报(医学版), 2007, 27(11): 1400-1401.
16 Ferrer J. Pleural tuberculosis[J]. Eur Respir J, 1997, 10(4): 942-947.

