巨噬细胞迁移抑制因子在小鼠脊髓损伤后的表达研究
, ,,
(1.第三军医大学基础部神经生物学教研室,神经生物学重庆市市级重点实验室,重庆 400038;2.第三军医大学新桥医院骨科,重庆 400037;3.解放军77100部队后勤部门诊部,重庆 400014)
中枢神经损伤后难以再生[1],中枢神经系统(central nervous system,CNS)自身特点及损伤后局部微环境是造成脊髓损伤(spinal cord injury,SCI)后再生困难的主要因素[2]。而周围神经系统(peripheral nervous system,PNS)损伤后可以再生,受损轴突和髓鞘碎片的及时清除为轴突再生提供通道。但是,CNS损伤后这个清除过程却被延迟,CNS中有吞噬和免疫功能的小胶质细胞以及损伤后浸润的巨噬细胞没有能够及时清除碎片,使损伤轴突的周围环境不利于再生。因此,在CNS损伤的急性期及时创造利于再生的环境对促进CNS损伤修复是非常必要的。脊髓损伤急性期,小胶质细胞和巨噬细胞参与的炎性反应是主要的病理表现之一[3]。巨噬细胞迁移抑制因子(macrophage migration inhibitory factor,MIF)作为固有免疫的组成部分[4],在压迫性脊髓损伤急性期表达明显上调[5],但其上调的意义目前还不完全清楚。前期研究发现,脊髓半横断损伤后与轴突再生相关的Ras同族基因家族成员A(Ras homolog gene family member A,RhoA)表达上调,可能与轴突再生受阻有关。本研究旨在探讨重物坠落所致脊髓损伤急性期MIF参与脊髓损伤及修复过程的机制。
1 材料与方法
1.1 材料
健康雄性C57BL/6小鼠30只,体质量20~25 g,由第三军医大学实验动物中心提供。脊髓砸伤装置一套(固定架、套管、重锤、击打锤)。主要试剂:抗体anti-MIF和anti-OX42购自Santa Cruz公司,FITC标记山羊抗兔IgG、TRITC标记山羊抗兔IgG、HRP标记山羊抗兔IgG,DAB试剂盒购自北京中杉公司,Simply P总RNA提取试剂盒购自BioFLux公司,RT-PCR试剂盒购自BioRT公司。
1.2 小鼠脊髓砸伤模型
将30只小鼠随机分为假手术对照组及手术组,腹腔注射4%水合氯醛麻醉,皮肤消毒后,纵行切开背部皮肤及皮下组织,钝性分离椎旁肌肉组织,切除T10棘突及椎板暴露硬脊膜,固定击打锤使之轻触脊髓表面,击打锤接触脊髓面为半径1 mm的圆形,使用砸伤装置将10 g重锤固定于5 cm高度,自由落下撞击击打锤砸伤T9~T10脊髓组织[6]。砸伤瞬间动物痉挛性摆尾并出现双下肢回缩后瘫痪,视为造模成功。假手术对照组仅切除T9~T10棘突及椎板,不进行砸伤。术后保暖至动物从麻醉中苏醒,正常喂养,每日1次腹腔注射青霉素2万单位,人工膀胱按压挤尿3次。根据BBB评分方法[6]分别于术后24 h和72 h,由与实验无关人员进行小鼠下肢功能评价。
1.3 损伤脊髓免疫组织化学染色
分别于术后24 h和72 h两个时相点腹腔注射3.5%水合氯醛麻醉小鼠,37 ℃生理盐水及预冷4%多聚甲醛经心脏灌注。取小鼠脊髓损伤段脊髓组织,经后固定、脱水后常规冰冻切片,厚度15 μm。切片PBS漂洗每次5 min,共3次;5%正常山羊血清37 ℃封闭1 h;加入一抗(anti-MIF,1︰200)37 ℃放置1 h后,4 ℃过夜;取出后,PBS漂洗3次,每次5 min;HRP标记二抗,37 ℃孵育1 h,PBS漂洗3次,每次5 min;用DAB显色试剂盒对切片进行显色普通光学显微镜下观察,拍照。
1.4 小胶质细胞分离培养
使用5 d以内新生小鼠,75%乙醇浸泡消毒后迅速断头,于预冷的D-Hanks平衡液中仔细剥离脑膜并分离皮层;剪碎并漂洗组织后,0.125%胰酶37 ℃中消化30 min,10%胎牛血清-DMEM/F12培养基终止消化,1 000 r/min离心5 min,弃上清,10%FBS-DMEM/F12-1%P/S培养基重悬浮细胞,轻微吹打至细胞悬浮,200目细胞筛过滤,种植于培养瓶中,12~24 h完成首次换液,以后每3 d更换一次培养基。培养至第14天,取出细胞并于眶式摇床上筛选细胞,200 r/min,2 h后,收集上清,1 000 r/min离心10 min,种植于24孔板中,密度3.5×105/cm2,37 ℃,5%CO2孵箱中备用[8]。
1.5 免疫荧光双标染色
取出细胞爬片,室温下,使用37 ℃预热的4%多聚甲醛液固定细胞30 min,PBS漂洗;5%正常山羊血清封闭,37 ℃,1 h;加入一抗混合液(使用一抗稀释液稀释OX42、MIF、MBP,浓度1︰100、1︰200),4 ℃过夜;PBS漂洗;37 ℃孵育二抗(Rho标记的羊抗兔二抗),避光;PBS漂洗,加入FITC标记的山羊抗小鼠二抗,37 ℃避光1 h;弃二抗,DAPI复染,室温30 min,PBS漂洗;抗荧光淬灭封片剂避光封片,拍照。全过程中,PBS漂洗均为每次5 min,均为3次。
1.6 RT-PCR检测损伤脊髓MIF和RhoA mRNA表达
提取损伤组织总RNA,检测A260、A280,计算RNA浓度及A260/A280,A260/A280比值在1.8~2.0范围内的RNA纯度合格。PCR扩增引物: Nogo-A基因上游:5’-CTGGAGTGGTGTATTTTGGTGC-3’,下游:5’-TACTGTTTGGGGCCTTGTCATT-3’,产物长度550 bp;MIF基因上游:5’-TTTGCAGGGAGGACACAGGAA-3’,下游:5’-TGGCAGCGTTCATGTCGTAATA-3’, 产物长度551 bp;RhoA基因上游:5’-TGTCAACTGCAAGAACTCTGGT-3’,下游:5’-AAGGAGCACTGTGACTTAGAGC-3’, 产物长度608 bp;β-actin基因上游:5’-ACGTTGACATCCGTAAAGACCT-3’,下游:5’-CAGTAACAGTCCGCCTAGAAGC-3’,产物长度286 bp。将PCR产物放入1.5%琼脂糖凝胶电泳(80 V,60 min),应用凝胶电泳成像仪观察并通过Quantity One软件进行数据采集及分析。
1.7 统计学分析
采用SPSS 13.0软件进行统计学分析,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 小鼠脊髓损伤后MIF的表达增加
假手术组小鼠脊髓白质中可见MIF阳性的轴突均匀分布,白质中也存在胶质细胞样的阳性细胞。灰质中以及神经元表达的MIF水平较低。脊髓损伤72 h后,白质中可见膨大的轴突末端呈MIF强阳性。灰质和白质中可见MIF强阳性的阿米巴样细胞,灰质中MIF表达增强(图1)。从脊髓横切片上可见,假手术组动物白质和灰质中均有MIF的低水平表达,脊髓损伤72 h后,MIF表达显著上调,尤其在白质中有大量MIF阳性的细胞及轴突终末,MIF阳性细胞从形态上看与活化的小胶质细胞相似,灰质中神经元中MIF表达改变不明显(图2)。
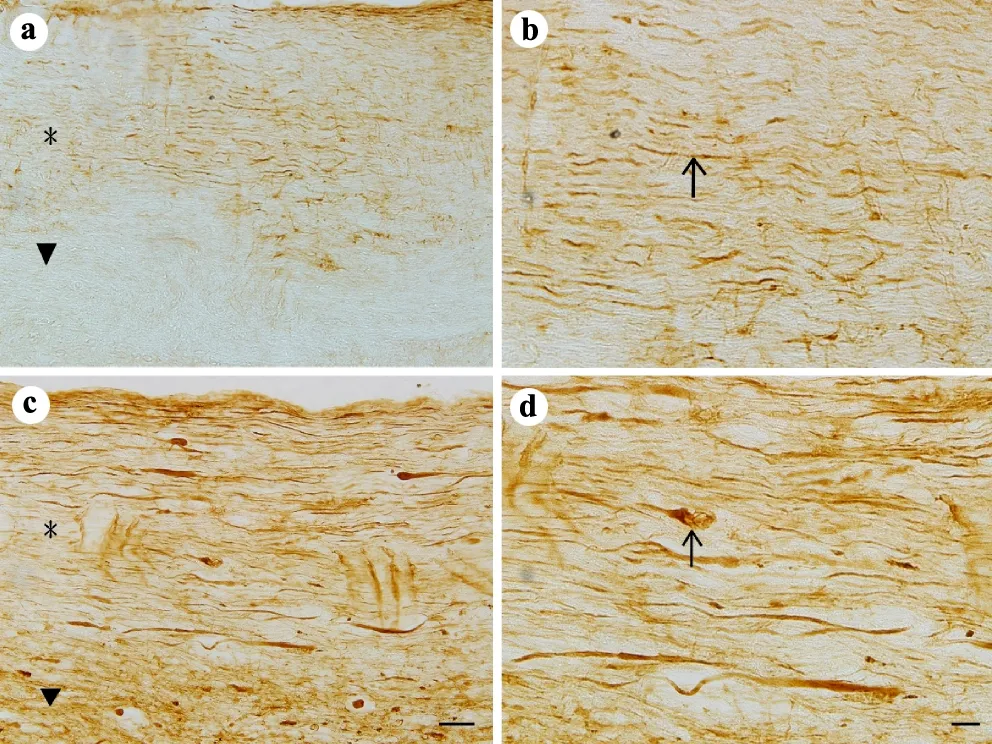
a:假手术组(×200,标尺=50 μm);b:a的局部放大(×400,标尺=20 μm);c:SCI后72 h组(×200,标尺=50 μm);d:c的局部放大(×400,标尺=20 μm);*:背侧白质区域;▼:灰质区域;↑:轴突
图1小鼠脊髓损伤后MIF的表达(纵切面)
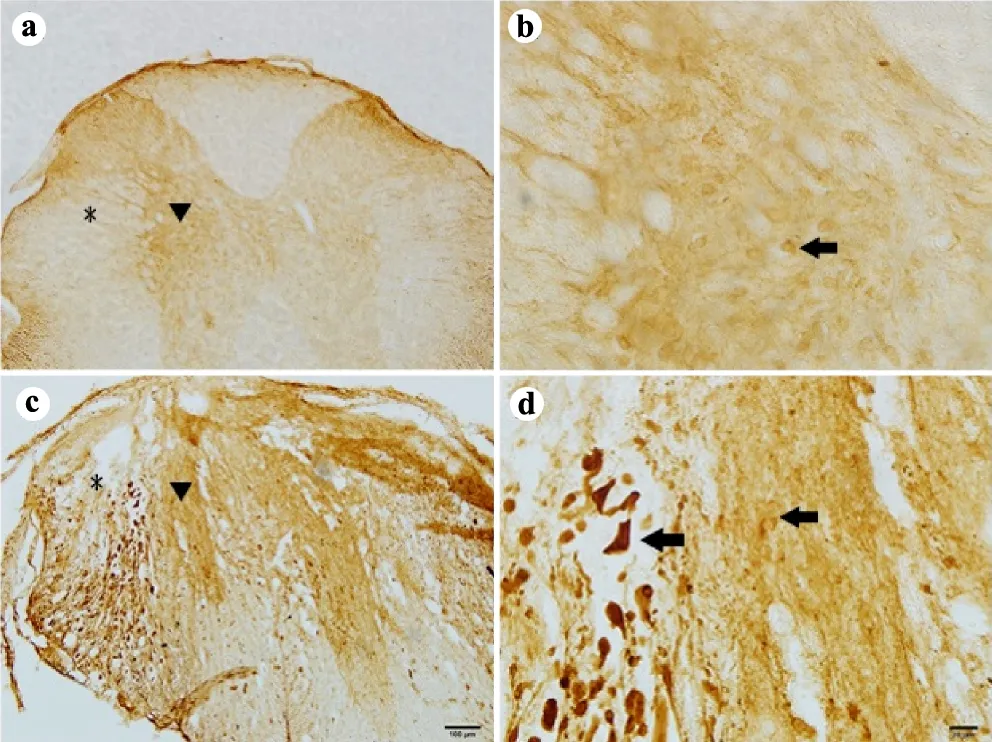
a:假手术组(×100,标尺=100 μm);b:a的局部放大(×400,标尺=20 μm);c:SCI后72 h组(×100,标尺=100 μm);d:c的局部放大(×400,标尺=20 μm);*:背侧白质区域;▼:灰质区域;↑:轴突
图2小鼠脊髓损伤后MIF的表达(横切面)
2.2 小胶质细胞中MIF和OX42的共表达
为了检验脊髓损伤后白质和灰质中存在的MIF阳性细胞为何种细胞,本研究进行了MIF/OX42的免疫荧光双标实验。OX42是特异性活化小胶质细胞标记物,荧光双标结果显示(图3),原代培养的小胶质细胞同时表达OX42和MIF,提示脊髓损伤后白质和灰质中存在的MIF强阳性细胞可能为活化的小胶质细胞。
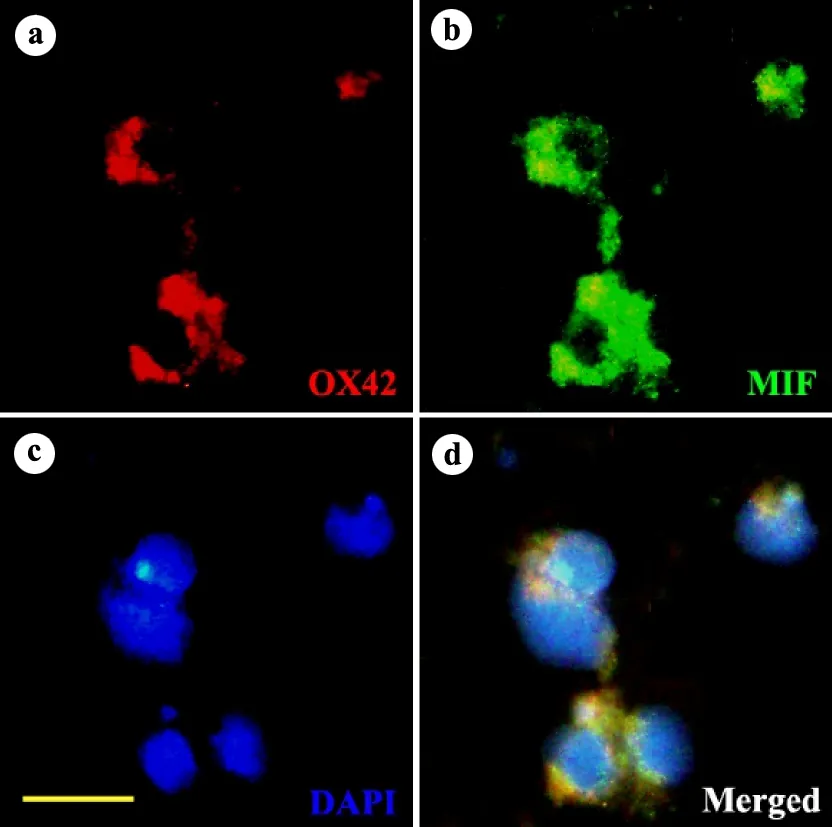
a:显示细胞为OX42阳性;b:显示细胞同时为MIF阳性;c:DAPI标记的细胞核;d:a、b、c的叠加
图3小胶质细胞中MIF和OX42的表达(×400,标尺=20μm)
2.3 假手术组及损伤后MIF、RhoA基因转录
MIF在脊髓砸伤后表达增加,为了探寻其增加的意义,本研究检测了损伤后MIF以及与轴突再生相关的RhoA的mRNA水平,统计学分析所用数据为3次实验的总数据。结果显示(图4),假手术组中MIF的mRNA水平很低,损伤72 h后MIF在基因转录水平上升高,2组之间有显著差异(P<0.05)。RhoA的水平与轴突的再生密切相关,相对于假手术组,损伤后72 h RhoA在基因转录水平上也显著升高(P<0.05)。分子量为400 ~500 bp处,损伤72 h后出现了非特异条带,推测是由于砸伤引起的物理冲击和化学炎症损伤影响了RNA的转录过程,模板链断裂并最终产生断裂的DNA片段。
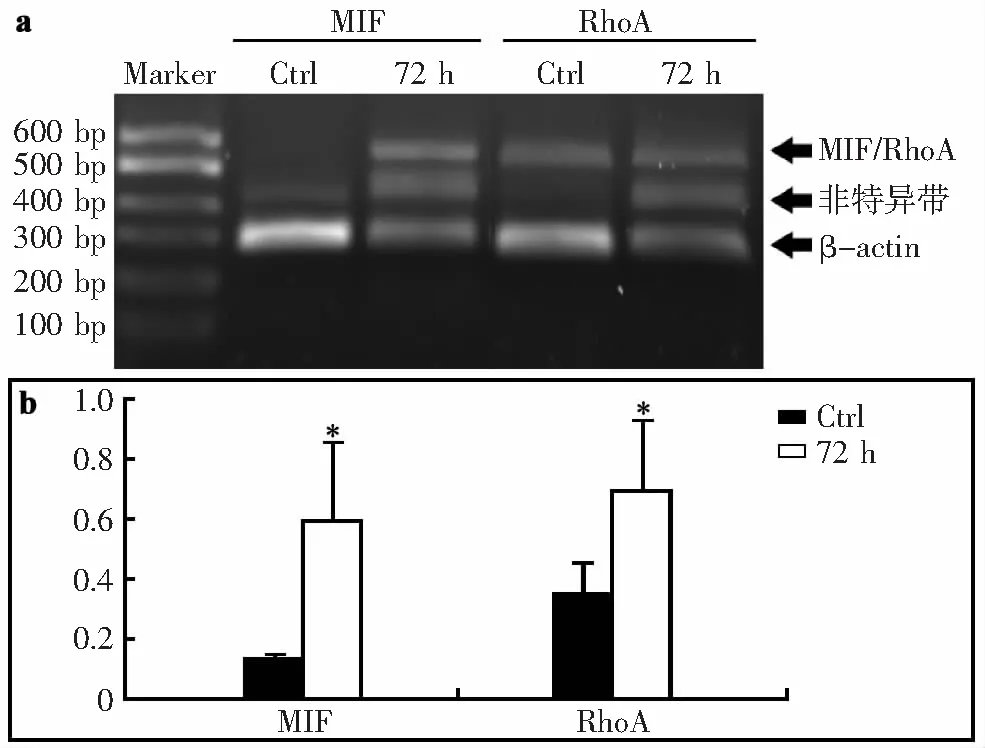
a:DNA琼脂糖电泳图;b:对电泳结果分析柱形图(*:与Ctrl比较,P<0.05)
图4损伤后72hMIF和RhoA的mRNA水平升高
3 讨论
巨噬细胞迁移抑制因子是机体固有免疫调控当中的一类重要分子,在压迫性脊髓损伤急性期表达上调[5],但对其上调的意义目前尚无定论。研究显示,敲除MIF基因有助于压迫性脊髓损伤小鼠后肢功能的恢复,提示MIF的存在阻碍了SCI后受损神经元的存活[9]。传统理论认为,MIF是一个促炎因子,主要参与脊髓损伤后的炎症反应,但炎症反应具有双刃剑的效应,MIF在其中的作用尚不明确。已知损伤后MIF在胶质细胞中水平增加,但神经元中MIF的水平改变不显著,提示增加的MIF可能主要来源于活化的小胶质细胞。原位杂交实验显示中枢神经系统中MIF的mRNA主要位于神经元和小胶质细胞,但MIF抗体标记则同时在星形胶质细胞、神经元和少突胶质细胞中呈现阳性[10]。在本研究中,免疫组织化学结果显示损伤后神经元中MIF表达上调不显著,而增加的MIF主要集中表达在阿米巴样的胶质细胞中,细胞化学染色的结果也证明OX42标记的原代小胶质细胞表达MIF,提示重物砸伤所致脊髓损伤后组织和细胞中增加的MIF主要来源于活化的小胶质细胞。
目前已有的研究显示MIF除了作为促炎因子以外,还与星形胶质细胞参与的血脑屏障通透性调节功能相关[11],并进而影响脊髓损伤后穿越CNS血脑屏障的巨噬细胞,使其直接或通过分泌某些活性因子在损伤局部发挥作用[12]。在本实验中发现,损伤后星形胶质和少突胶质样的细胞呈现MIF阳性,而这两类细胞并非MIF在CNS内的主要来源,可能的解释是这些胶质细胞是从胞外环境中摄取了MIF,但它们通过何种机制获取MIF还不清楚。本文推测,小胶质细胞产生的MIF,可能通过与星形胶质细胞和少突胶质细胞膜上的分子作用启动内吞机制摄取MIF。本研究随后检测了与轴突再生关系密切的RhoA,其mRNA水平明显升高,不利于轴突再生。同时,损伤后MIF mRNA水平的增加则进一步提示其与再生抑制存在一定的关系[13]。有研究表明,原代培养的小鼠成纤维细胞中,MIF可以通过RhoA参与调节细胞周期蛋白D1(cyclin D1)的表达,进而调节细胞周期[14]。本研究发现损伤后MIF与RhoA都出现了明显上调,这些结果提示,一方面,进入星形胶质细胞的MIF可能通过调控其细胞周期促进其增殖形成胶质瘢痕[5];另一方面,星形胶质细胞表面的MIF还可能进一步影响脊髓损伤后巨噬细胞的进入,调控巨噬细胞和小胶质细胞在损伤后局部微环境中对星形胶质细胞和少突胶质细胞的作用,比如清除髓鞘碎片以及阻碍胶质瘢痕的形成等。因此,MIF将对轴突损伤后再生的微环境产生重要的影响,研究MIF除了炎症作用以外的其他效应将有助于理解脊髓再生困难的原因和潜在的机制,为促进脊髓损伤后的修复提供新的策略。
[参考文献]
[1] 李建军,周红俊,洪 毅,等.2002年北京市脊髓损伤发病率调查[J]. 中国康复理论实践,2004,10(7):412-413.
[2] Chen MS,Huber AB,van der Haar ME,et al. Nogo-A is a myelin-associated neurite outgrowth inhibitor and an antigen for monoclonal antibody IN-1[J]. Nature,2000,403(6768):434-439.
[3] Dohrmann GJ,Wagner FC Jr,Bucy PC. Transitory traumatic paraplegia: electron microscopy of early alterations in myelinated nerve fibers[J]. J Neurosurg,1972,36(4):407-415.
[4] Calandra T,Roger T. Macrophage migration inhibitory factor: a regulator of innate immunity[J]. Nat Rev Immunol,2003,3(10):791-800.
[5] Koda M,Nishio Y,Hashimoto M,et al. Up-regulation of macrophage migration-inhibitory factor expression after compression-induced spinal cord injury in rats [J]. Acta Neuropathol,2004,108(1):31-36.
[6] 卢曼鹏,权正学,刘 渤,等. 小鼠脊髓损伤标准化重物打击模型的制备及评价[J]. 中国修复重建外科杂志,2008,22(8):933-938.
[7] Basso DM,Beattie MS,Bresnahan JC. A sensitive and reliable locomotor rating scale for open field testing in rats[J]. J Neurotrauma,1995,12(1):1-21.
[8] Skaper SD,Argentini C,Barbierato M. Culture of neonatal rodent microglia, astrocytes, and oligodendrocytes from cortex and spinal cord[J]. Methods Mol Biol,2012,846:67-77.
[9] Nishio Y,Koda M,Hashimoto M,et al. Deletion of macrophage migration inhibitory factor attenuates neuronal death and promotes functional recovery after compression-induced spinal cord injury in mice[J]. Acta Neuropathol,2009,117(3):321-328.
[10] Vera PL,Meyer-Siegler KL. Anatomical location of Macrophage Migration Inhibitory factor in urogenital tissues, peripheral ganglia and lumbosacral spinal cord of the rat[J]. BMC Neuroscience,2003,4:17.
[11] Bacher M,Weihe E,Dietzschold B,et al. Borna Disease virus-induced accumulation of macrophage migration inhibitory factor in rat brain astrocytes is associated inhibition of macrophage infiltration[J]. Glia,2002,37(4):291-306.
[12] Filbin MT. How inflammation promotes regeneration[J]. Nature Neuroscience,2006,9(6):715-717.
[13] Nishio Y,Nishihira J,Ishibashi T,et al. Role of macrophage migration inhibitory factor (MIF) in peripheral nerve regeneration: anti-MIF antibody induces delay of nerve regeneration and the apoptosis of Schwann cells[J]. Mol Med,2002,8(9):509-520.
[14] Swant JD,Rendon BE,Symons M,et al. Rho GTPase-dependent signaling is required for macrophage migration inhibitory factor-mediated expression of cyclin D1 [J]. J Biol Chem,2005,280(24):23066-23072.

