LATS1-YAP信号通路对人皮肤成纤维细胞增殖及细胞外基质合成的调控
卢 昊,刘 婷,陈 宇,毛彤春,雷泽源,樊东力 (第三军医大学新桥医院整形外科,重庆 400037)
皮肤成纤维细胞是皮肤真皮中最主要的细胞成分,在合成分泌纤维和细胞外基质(extracellular matrix,ECM)中扮演着重要的角色。在皮肤受到创伤后,皮肤成纤维细胞作为主要修复细胞,在趋化因子的作用下由创周向创面移位,并分泌细胞外基质成分,如Ⅰ型胶原蛋白(collagenⅠ)、层联蛋白等,成纤维细胞与ECM相互作用,在皮肤创伤修复过程中发挥着关键作用。而当皮肤创伤修复过程中成纤维细胞过度增殖,则会导致瘢痕或瘢痕疙瘩的出现,影响形体的美观,乃至影响功能。故如何调控皮肤成纤维细胞的增殖成为皮肤创伤修复和阻止瘢痕形成的关键环节,但目前调控皮肤成纤维增殖的机制尚不清楚。本研究旨在探讨LATS1-YAP信号通路对人皮肤成纤维细胞HS27增殖及细胞外基质合成的调控作用,以期为皮肤创伤后修复以及阻止创伤后瘢痕形成提供潜在治疗靶点。
1 材料与方法
1.1 主要材料和实验分组
人皮肤成纤维细胞HS27购自ATCC。DMEM培养基、优等胎牛血清、胰蛋白酶购自美国Hyclone公司,LATS1 siRNA、YAP siRNA由上海生物工程有限公司合成。LATS1兔单克隆抗体、YAP兔单克隆抗体、collagenⅠ兔单克隆抗体均购自英国Abcam公司。蛋白提取试剂盒、二抗辣根酶标记山羊抗兔、GAPDH兔多克隆抗体均购自北京天德悦生物科技公司。BeyoECL plus(超敏ECL化学发光试剂盒)购自江苏碧云天生物技术有限公司。lipofectmine2000购自美国Invitrogen公司。
LATS1 siRNA干预组:使用LATS1 siRNA对HS27细胞进行干预;YAP siRNA干预组:使用YAP siRNA对HS27细胞进行干预;未干预组HS27细胞只加入等量的培养基。
1.2 方法
1.2.1 细胞培养 将人皮肤成纤维细胞HS27培养于含10%FBS的高糖DMEM培养基中,于37℃、5%CO2细胞培养箱中培养传代,实验中选用对数生长期细胞。
1.2.2 LATS1 siRNA和YAP siRNA的转染 转染前1 d将对数生长期的HS27细胞分别接种6孔细胞培养板,每孔1×105个细胞。倒置显微镜下观察细胞生长情况,待培养板中细胞约60%融合时开始转染。取无血清DMEM培养基240 μl与10 μl lipofectmine2000混匀,再取无血清 DMEM 培养基240 μl与10μlLATS1/YAPsiRNA混匀,放置5~10min后将上述2种溶液混合,再放置20 min。将6孔细胞培养板中培养基吸出,用PBS洗涤1次后将脂质体siRNA混合液加入培养板,孵育6 h后吸取培养基,换为10%FBS的高糖DMEM,继续培养48 h。
1.2.3 检测 LATS1、YAP和collagenⅠ蛋白表达 收集各组细胞,加细胞蛋白提取液提取总蛋白,置于冰中裂解约20 min后,用细胞刮收集细胞于EP管中,4℃1 2 0 0 0 r/min离心10 min,取上清用核酸蛋白检测仪测蛋白浓度,将蛋白浓度调成一致,加入5×Loading buffer后在沸水中煮5 min变性。配制8%分离胶、5%浓缩胶后进行SDS-PAGE凝胶电泳,300 mA湿转120 min,将PVDF膜置于5%脱脂奶粉室温封闭2 h,分别加入5%脱脂奶粉稀释的LATS1、YAP和collagenⅠ一抗(稀释浓度均为1∶1 000)中4℃孵育过夜,次日用TBST漂洗6次,每次5 min,放入5%脱脂奶粉稀释的辣根过氧化物酶标记山羊抗兔IgG(1∶5 000)抗体中室温孵育1 h,TBST漂洗6次,每次5 min,ECL化学发光法显色,以GADPH内参蛋白校正。
1.2.4 检测HS27细胞的活力 以每孔103个细胞将HS27细胞接种于96孔培养板中,每孔体积200 μl,每组设5个复孔,置37℃、5%CO2培养箱中培养24 h后进行转染,待转染48 h后每孔加入5 mg/mL的MTT溶液20 μl,继续孵育4 h,小心吸弃培养孔内上清液。每孔加入150 μl DMSO,轻微振荡10 min,使结晶物完全溶解,酶标仪选择490 nm波长,测定各孔吸光度(A)值,空白对照孔调零。实验重复3次。
1.3 统计学分析
使用Image-Pro Plus 10.0对电泳图像进行分析;使用SPSS 16.0统计学软件对数据进行分析,各实验至少重复3次,2组均数间比较用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同干预条件下LATS1蛋白的表达
LATS1 siRNA干预组LATS1蛋白表达显著低于未干预组(P<0.05),YAP siRNA干预组LATS1蛋白表达与未干预组无显著差异(P>0.05),LATS1 siRNA干预组LATS1蛋白的表达显著低于YAP siRNA干预组(P<0.05),见图1。
2.2 不同干预条件下YAP蛋白的表达
LATS1 siRNA干预组YAP蛋白表达显著高于未干预组(P<0.05),YAP siRNA干预组YAP蛋白表达显著低于未干预组(P<0.05),LATS1 siRNA干预组YAP蛋白的表达显著高于YAP siRNA 干预组(P <0.05),见图2。
2.3 不同干预条件下collagenⅠ蛋白的表达
LATS1 siRNA干预组collagenⅠ蛋白表达显著高于未干预组(P<0.05),YAP siRNA干预组collagenⅠ蛋白表达显著低于未干预组(P<0.05),LATS1 siRNA干预组collagenⅠ蛋白的表达显著高于YAP siRNA干预组(P<0.05),见图3。
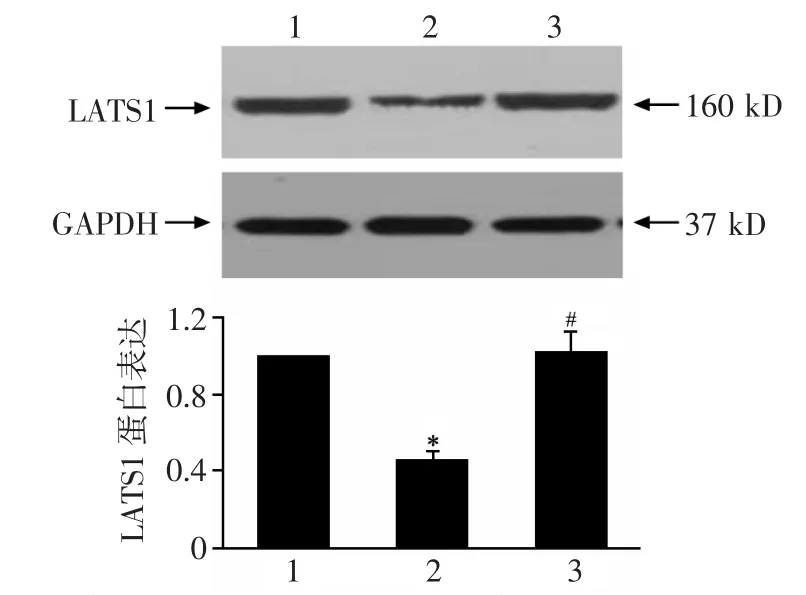
图1 LATS1蛋白的表达
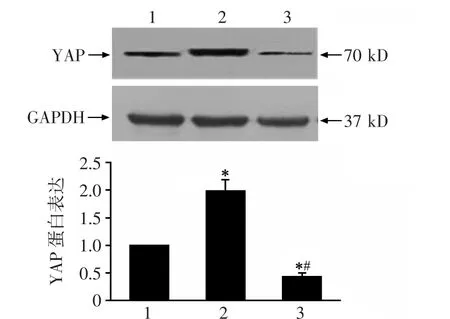
图2 YAP蛋白的表达
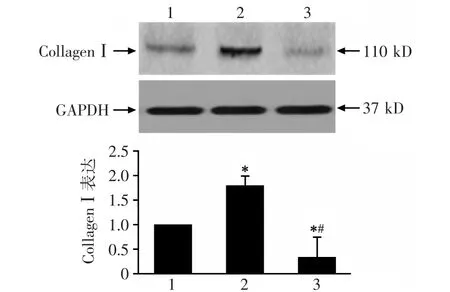
图3 collagenⅠ蛋白的表达
2.4 不同干预条件下HS27的活性
LATS1 siRNA干预组HS27细胞活力显著高于为未干预组(P<0.05),YAP siRNA干预组HS27细胞活力显著低于未干预组(P<0.05),LATS1 siRNA干预组HS27细胞活力显著高于YAP siRNA 干预组(P <0.05),见图4。
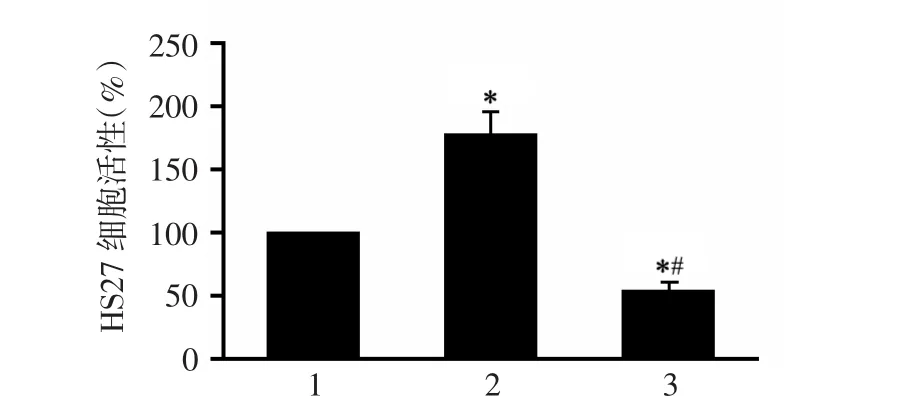
图4 HS27细胞的活性变化
3 讨论
皮肤是人身体最大的器官,主要承担着保护身体、排汗、感觉冷热和压力的功能,使体内各种组织和器官免受物理性、机械性、化学性和病原微生物侵袭。当皮肤受到损伤后,身体中多种细胞内外信号通路激活,使成纤维细胞、免疫细胞(如中性粒细胞、单核细胞、树突细胞)、内皮细胞等胞内一些相关基因表达、细胞的极性发生显著的改变,导致细胞的增殖、迁移、分化,从而修复皮肤创伤[1-2]。多数皮肤受损后修复时会出现成纤维细胞的过度增殖和ECM的紊乱,从而导致瘢痕的出现[3],极少数皮肤创伤修复中会出现异常增生和恶变[4],但目前尚无有效方法阻止瘢痕的形成甚至恶变,其主要原因是调控真皮层成纤维细胞增殖的机制尚不清楚。
LATS1和YAP蛋白是Hippo信号通路中的关键元件。Hippo信号通路具有调节器官体积、保持细胞增殖凋亡平衡、参与细胞接触性抑制调控等作用[5-6],而该通路的异常或失活可导致细胞的异常增殖以及肿瘤的形成[7]。研究发现LATS1基因敲除后,小鼠常死于胚胎阶段,即使存活下来也伴有肿瘤发生[8],提示LATS1在细胞增殖、分化以及抑制肿瘤发生中发挥着重要作用。YAP是经典Hippo通路的主要效应因子,被其上游Wts磷酸化而失活,YAP的过度表达会造成组织器官的增大,相反YAP的失活会造成组织器官萎缩。Hippo通路中其他因子的突变(如LATS1)受到抑制能增加YAP的活性,导致下游转录因子cyclinE、DIAP1等表达增加,促进细胞增殖,抑制细胞凋亡[9]。本研究同样证实了抑制LATS1,增加了YAP的表达,从而促进了细胞的活力,相反YAP受到抑制后,HS27细胞活力也显著下降。
皮肤中存在多种胶原蛋白,其中collagenⅠ是含量最丰富的胶原蛋白,占其干重的90%以上[10]。真皮层collagenⅠ的减少是皮肤皱纹形成的主要原因,同时皮肤创伤修复时紊乱collagenⅠ是形成瘢痕的关键环节[11],提示胶原蛋白的合成对维持组织的完整性发挥着重要作用。研究发现TGF-β和其他的细胞因子可促进collagenⅠmRNA的翻译和转录[12-13],而MMPs可负性调节 collagenⅠ的表达[14]。其他研究指出抑制Smad2/3的表达可显著下调collagenⅠ合成[15]。本研究发现当抑制LATS1时,collagenⅠ的合成增加,相反抑制 YAP时,collagenⅠ蛋白表达显著下调,提示LATS1-YAP信号通路可调控collagenⅠ的表达,但其机制尚不清楚,需进一步进行研究。
[1]Singer AJ,Clark RA.Cutaneous wound healing[J].N Engl J Med,1999,341(10),738 -746.
[2]Aarabi S,Longaker MT,Gurtner GC.Hypertrophic scar formation following burns and trauma:new approaches to treatment[J].PLoS Med,2007,4(9):e234.
[3]Opalenik SR,Davidson JM.Fibroblast differentiation of bone marrow-derived cells during wound repair[J].FASEB J,2005,19(11):1561 -1563.
[4]Trent JT,Kirsner RS.Wounds and malignancy[J].Adv Skin Wound Care,2003,16(1):31 -34.
[5]Zhao B,Lei QY,Guan KL.The Hippo-YAP pathway:new connections between regulation of organ size and cancer[J].Curr Opin Cell Biol,2008,20(6):638 -646.
[6]Zhao B,Wei X,Li W,et al.Inactivation of YAP oncoprotein by the Hippo pathway is involved in cell contact inhibition and tissue growth control[J].Genes Dev,2007,21(21):2747 - 2761.
[7]Da CL,Xin Y,Zhao J,et al.Significance and relationship between Yesassociated protein and surviving expression in gastric carcinoma and precancerous lesions[J].World J Gastroenterol,2009,15(32):4055 -4061.
[8]St John MA,Tao W,Fei X,et al.Mice deficient of Lats1 develop soft-tissue sarcomas,ovarian tumours and pituitary dysfunction[J].Nat Genet,1999,21(2):182 -186.
[9]Zhang J,Ji JY,Yu M,et al.YAP-dependent induction of amphiregulin identifies a non cell autonomous component of the Hippo pathway[J].Nat Cell Biol,2009,11(12):1444 -1450.
[10]Takasao N,Tsuji-Naito K,Ishikura S,et al.Cinnamon extract promotes type I collagen biosynthesis via activation of IGF-I signaling in human dermal fibroblasts[J].J Agric Food Chem,2012,60(5):1193 - 1200.
[11]Gurtner GC,Werner S,Barrandon Y,et al.Wound repair and regeneration[J].Nature,2008,453(7193):314 - 321.
[12]Honda N,Jinnin M,Kajihara I,et al.TGF-β-mediated downregulation of microRNA-196a contributes to the constitutive upregulated type I collagen expression in scleroderma dermal fibroblasts[J].J Immunol,2012,188(7):3323 -3331.
[13]Amento EP,Ehsani N,Palmer H,et al.Cytokines and growth factors positively and negatively regulate interstitial collagen gene expression in human vascular smooth muscle cells[J].Arterioscler Thromb,1991,11(5):1223-1230.
[14]Enjoji M,Kotoh K,Iwamoto H,et al.Self-regulation of type I collagen degradation by collagen-induced production of matrix metalloproteinase-1 on cholangiocarcinoma and hepatocellular carcinoma cells[J].In Vitro Cell Dev Biol Anim,2000,36(2):71 -73.
[15]Cho JW,II KJ,Lee KS.Downregulation of type I collagen expression in silibinin-treated human skin fibroblasts by blocking the activation of Smad2/3-dependent signaling pathways:potential therapeutic use in the chemoprevention of keloids[J].Int J Mol Med,2013,31(5):1148-1152.

