miR-378在牛不同组织中的表达规律及功能分析
张阳阳,戴立胜,周 乾,岳 媛,朱亚南,王 帅,徐芳芳,付 瑶,张嘉保
(吉林大学 动物科学学院,吉林 长春 130062;吉林大学 实验动物中心,长春 130062)
Micro RNA(miRNA)是一类具有组织特异性或发育阶段特异性表达特征的非编码调控小RNA,大小为18~24 nt,具有非常重要的生物学意义。miRNA主要通过基因切割和翻译抑制的方式调节mRNA的翻译或稳定性,调控前体细胞系的增殖和器官的发生,miRNA通过与靶基因mRNA的种子区相结合,在生物的生长发育、组织分化及疾病发生等过程中起重要的作用,这使得miRNA逐渐成为新的研究热点[1~5]。
miR-378在各脏器组织中均有表达,作用广泛,主要与细胞凋亡和血管发生有关。已有研究表明,小鼠miR-378促进小鼠成肌细胞增长[6],并通过靶向调控GalNT7增强肾连蛋白糖基化从而促进小鼠成骨细胞分化[7]。人miR-378靶向调控Sufu 和Fus-1促进细胞存活、肿瘤生长及血管发生[8]。miR-378作用广泛,与多种基因存在靶向作用。因此,本研究分析miR-378在牛各组织器官中的表达情况,检测其靶作用基因,探究其作用机理,充实牛繁殖育种机理理论基础,为提高牛各项生产性状提供依据。
1 材料与方法
1.1 实验材料
在当地选定实验用西门塔尔牛,待被选个体被屠宰时,迅速取出睾丸、垂体、肺脏、肝脏、肾脏、大脑、肠系膜脂肪、小肠、脾脏组织于液氮中临时保存,随后保存于-80 ℃冰箱中备用。大肠杆菌感受态DH5α由实验室制备。
1.2 实验方法
1.2.1 总RNA提取及反转录
从-80 ℃冰箱取出各组织样品,分别取50 mg,根据Trizol一步法提取总RNA,经1%的琼脂糖电泳鉴定其质量,并用Nanodrop测量其浓度。根据RT-PCR试剂盒(toyobo)内说明书进行反转录,根据颈环反转录引物5′GTCGTAATCCAGTGCGTGT CGTGGAGTCGGCAATTGCACTGGATACGACG CCTTCT3′制备miR-378 cDNA第一链,置于-20 ℃冰箱备用。
1.2.2 实时荧光定量 PCR分析
针对 miR-378特异性序列,设计上下游引物(上游引物:5′GGGACTGGACTTGG AGTCA3′下游引物:5′GTGCGTGTCGTGGAG TCG3′),进行实时荧光定量 PCR。采用U6为内标基因,内标基因与目的基因各设3个平行反应管。根据SYBR Premix Ex TaqTMⅡ(Tli RNaseH Plus)(TaKaRa)试剂盒,反应条件采用三步法,95 ℃预变性 15 s,95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸45 s,40个循环。相对表达量数值通过2-ΔΔCt进行计算。
1.2.3 靶基因重组双荧光素酶报告载体构建
根据TargetScan网站(http://www.targetscan.org/)及RNA22网站(http://cbcsrv.watson.ibm.com/rna22.html)等预测出miR-378候选靶基因。根据NCBI上候选靶基因SLC26A9成熟序列,选取其3′UTR上包含与miR-378结合位点序列,根据XhoⅠ和NotⅠ限制性酶切位点设计引物。退火合成靶序列克隆至双荧光素酶报告载体中。候选靶基因重组质粒的突变,在与种子区结合位点设计4个碱基突变,引物设计见表1。

表1 候选靶基因种子区扩增引物
1.2.4 双荧光素酶报告分析
用DMEM高糖基础培养基(Hyclone)加入10%胎牛血清,1%双抗于96孔板中培养NIH3T3细胞,将5pmol miR-378 或miR-NC mimics(吉玛公司)与2 ng靶基因双荧光素酶报告重组质粒或空载体,用LipofectamineTM 2000共同转染入NIH3T3细胞中。48 h后每孔用20 μL裂解液(PLB),15 min摇床充分裂解后,加入Luciferase Assay Substrate及Stop&Glo® Substrate,化学发光仪设定检测程序进行检测。
2 结果与分析
2.1 牛各组织样品总RNA提取
观察琼脂糖凝胶电泳中睾丸、垂体、肺脏、肝脏、肾脏、大脑、小肠、脾脏组织总RNA(图1),28 S、18 S、5 S三条带清晰无杂带,并测得总RNA浓度均在300 ng/μL~500 ng/μL之间,且A260/280均在1.8~2.0之间,总RNA质量良好,可以进行后续实验。
图1 牛各组织RNA琼脂糖凝胶电泳成像图
2.2 牛各组织样品实时荧光定量PCR检测
实时荧光定量PCR获得的数据用Realplex软件进行分析。如图2所示,miR-378在牛大脑、小肠、脾脏表达量相对较高,分别约为肝脏的4倍、4.5倍及8倍。而在睾丸、垂体中表达量相对较少,仅分别约为肝脏的0.1倍及0.2倍。由此可推测,miR-378对牛脂肪、小肠、脾脏的功能具有一定调节作用。
2.3 miR-378靶基因生物信息学分析
通过TargetScan、RNA22网站预测出多个靶基因,其功能作用各不相同,详见表2。
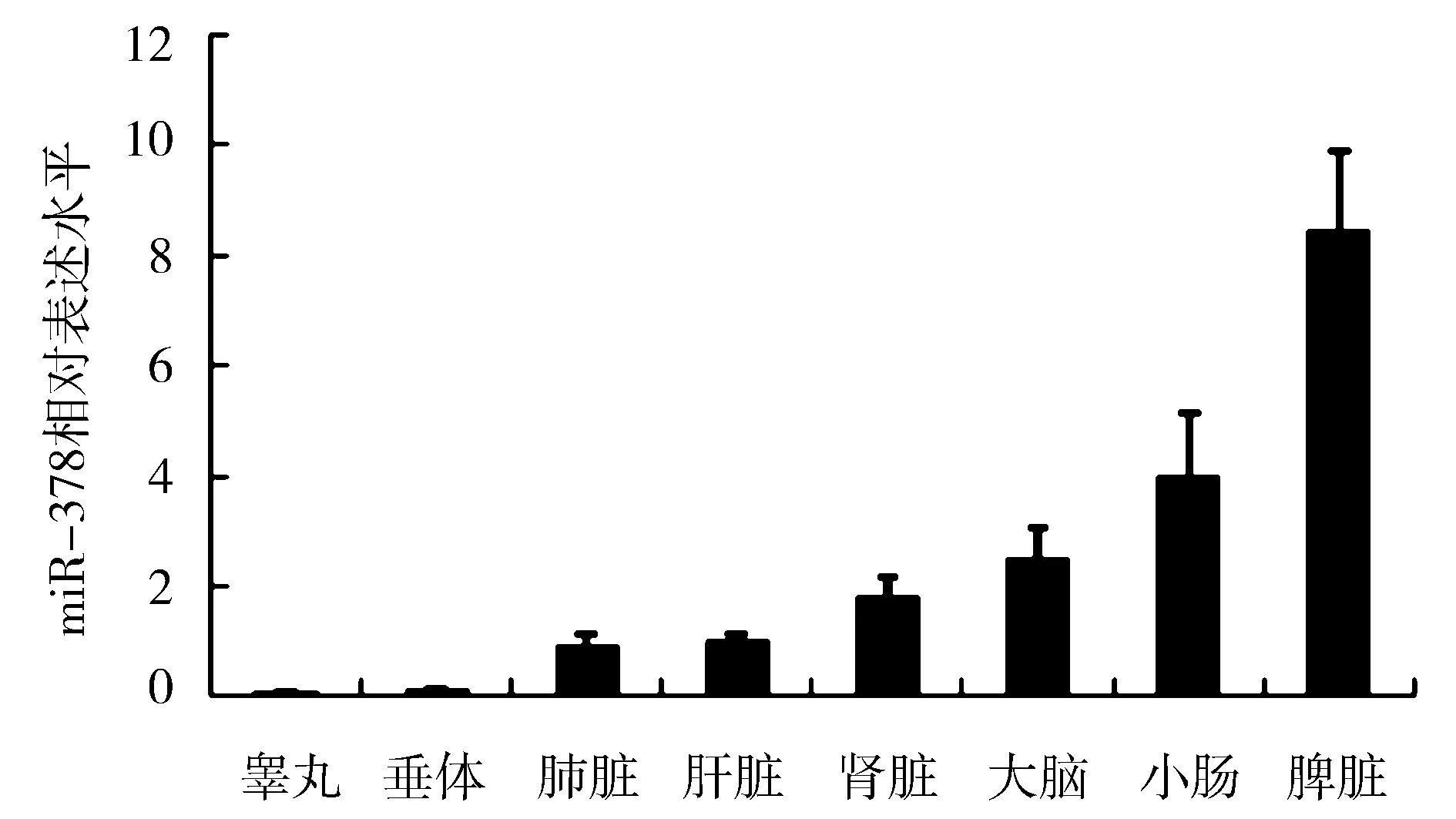
图2 牛各组织miR-378相对表达水平

表2 miR-378靶基因生物信息学分析
2.2 miR-378靶基因双荧光素酶报告分析
在预测miR-378候选靶基因的过程中,验证出SLC26A9基因,其3′UTR种子区上有与miR-378互补结合的成熟序列AGTCCAG。为了验证其是否为miR-378的靶基因,我们克隆了psi-CHECK-DDAH1重组质粒。已有发现miR-378靶基因MAPK1,在此作为阳性对照[9]。把SLC26A9重组质粒、空白质粒、阳性对照质粒分别与miR-378或miR-NC mimics 共同转染入NIH3T3细胞系中,48 h后进行双荧光素酶报告分析(见图3),可见miR-378下调SLC26A9的海肾荧光素酶与萤火虫荧光素酶的表达比例差异极显著(P<0.01)。与阳性对照对比,可以验证SLC26A9为miR-378靶基因。
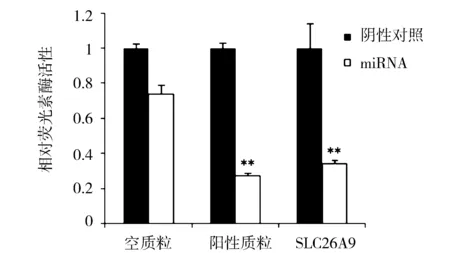
图3 靶基因体外双荧光素酶报告(p<0.01)
3 讨论
本研究主要通过实时荧光定量PCR检测miR-378在牛各内脏中的组织相对表达水平,并利用双荧光素酶报告验证牛miR-378靶基因SLC26A9,进一步探究牛miR-378的作用机制。
miRNA通过对基因转录后调控而介导了一个全新层次上的基因表达调控方式。已有研究证实,miRNA参与血管发生、细胞增殖及细胞凋亡等生命过程中的一系列重要进程,且与动物生长、繁殖、肿瘤疾病等密切相关,可见其在动物生长发育过程中的重要性。已有报道,miR-378与细胞生长、细胞分化、肿瘤细胞存活、血管发生等密切相关[6~8],对动物生长发育意义重大,但在牛上研究较其他物种相对较少。本研究分析了miR-378在牛各组织相对表达水平及靶作用基因,为其在牛上发挥作用机制提供理论依据。
在miR-378靶基因预测过程中分析出候选靶基因,其中SULF1、SOX7、IGF1同对肿瘤细胞发挥作用,SULF1通过抑制heparin-binding生长因子信号抑制食管鳞状癌细胞和肝癌细胞的增殖与入侵[10,11]。SOX7抑制Wnt/β-catenin信号通路活性,抑制肺癌细胞和子宫内膜癌细胞[12,13]。IGF1与细胞生长及增殖有关,通过miR-486靶向调控,抑制肺癌细胞[14,15]。一种miRNA可调控多个靶基因,一个基因也同时可以被多个miRNA调控,如果把miR-378与SULF1、SOX7、IGF1联系来,共同分析作用机理,可进一步研究对肿瘤发生与抑制的作用机理,并深化了对miR-378对各组织癌细胞作用机制的研究。
本实验分析了miR-378在牛各组织分布及其靶基因检测,为探究牛miR-378功能作用机制提供一定理论依据,具体miR-378在牛各组织功能作用机制需进一步探究。
[1] Jin W,Dodson M V,Moore S S,et al.Characterization of microRNA expression in bovine adipose tissues:a potential regulatory mechanism of subcutaneous adipose tissue development[J].BMC molecular biology,2010,11(1):29.
[2] Chartoumpekis D V,Zaravinos A,Ziros P G,et al.Differential expression of microRNAs in adipose tissue after long-term high-fat diet-induced obesity in mice[J].PloS one,2012,7(4):e34872.
[3] Xu S,Linher-Melville K,Yang B B,et al.Micro-RNA378(miR-378)regulates ovarian estradiol production by targeting aromatase[J].Endocrinology,2011,152(10):3941-3951.
[4] Ortega F J,Moreno-Navarrete J M,Pardo G,et al.MiRNA expression profile of human subcutaneous adipose and during adipocyte differentiation[J].PloS one,2010,5(2):e9022.
[5] Kim Y J,Bae S W,Yu S S,et al.miR‐196a regulates proliferation and osteogenic differentiation in mesenchymal stem cells derived from human adipose tissue[J].Journal of bone and mineral research,2009,24(5):816-825.
[6] Gagan J,Dey B K,Layer R,et al.MicroRNA-378 targets the myogenic repressor MyoR during myoblast differentiation[J].Journal of Biological Chemistry,2011,286(22):19431-19438.
[7] Kahai S,Lee S C,Lee D Y,et al.MicroRNA miR-378 regulates nephronectin expression modulating osteoblast differentiation by targeting GalNT-7[J].PLoS One,2009,4(10):e7535.
[8] Lee D Y,Deng Z,Wang C H,et al.MicroRNA-378 promotes cell survival,tumor growth,and angiogenesis by targeting SuFu and Fus-1 expression[J].Proceedings of the National Academy of Sciences,2007,104(51):20350-20355.
[9] Hou X,Tang Z,Liu H,et al.Discovery of microRNAs associated with myogenesis by deep sequencing of serial developmental skeletal muscles in pigs[J].PloS one,2012,7(12):e52123.
[10] Liu C T,Zhu S T,Li P,et al.SULF1 Inhibits Proliferation and Invasion of Esophageal Squamous Cell Carcinoma Cells by Decreasing Heparin-Binding Growth Factor Signaling[J].Digestive diseases and sciences,2012:1-8.
[11] Bao L,Yan Y,Xu C,et al.MicroRNA-21 suppresses PTEN and hSulf-1 expression and promotes hepatocellular carcinoma progression through AKT/ERK pathways[J].Cancer letters,2013.
[12] Li B,Ge Z,Song S,et al.Decreased expression of Sox7 is correlated with poor prognosis in lung adenocarcinoma patients[J].Pathology & Oncology Research,2012,18(4):1039-1045.
[13] Chan DW,Mak CS,Leung TH,et al.Down-regulation of Sox7 is associated with aberrant activation of Wnt/b-catenin signaling in endometrial cancer[J].Oncotarget,2012,3(12):1546-1556
[14] Hegde V L,Tomar S,Jackson A,et al.Distinct microRNA expression profile and targeted biological pathways in functional myeloid-derived suppressor cells induced by Δ9-Tetrahydrocannabinol in vivo:Regulation of CCAAT/enhancer binding protein alpha by microRNA-690[J].Journal of Biological Chemistry,2013:jbc.M113.503037.
[15] Peng Y,Dai Y,Hitchcock C,et al.Insulin growth factor signaling is regulated by microRNA-486,an underexpressed microRNA in lung cancer[J].Proceedings of the National Academy of Sciences,2013,110(37):15043-15048.

