杜泊绵羊超数排卵及胚胎移植影响因素分析
张 帆,李晓丽,王 俊,齐裕龙,张永根*
(1.东北农业大学 动物科学技术学院,黑龙江 哈尔滨 150030;2.辽宁省葫芦岛市连山区动物疫病预防控制中心 125001;3.浙江省天台县畜牧兽医局 317200;4.黑河市爱辉区畜牧兽医局 164300)
杜泊绵羊黑头白躯,体躯成桶形,肌肉发达,后躯丰满,耐粗饲且对低品质牧草利用率高[1],具有较大的经济效益。但群体规模始终较小,主要原因就在于自然繁殖生产较慢。本研究旨在优化杜泊绵羊超排方案,找到FSH合适剂量,提高杜泊羊群体扩繁速度,探讨重复超排及季节因素对超排效果的影响,为降低生产成本、提高杜泊羊繁殖效率提供依据。
胚胎移植是胚胎生物技术的重要组成部分,可充分发挥优秀母畜在家畜品种改良和群体扩繁中的潜力,使优秀种畜基因高效地保留和遗传下去[2,3]。有效缩短繁殖时间,快速扩大种群规模。澳大利亚等国家已普遍在育种工作中采用超数排卵和胚胎移植技术,并已取得了显著效果[3]。Robinson等[4]在1965年采用含有孕酮的海绵栓阴道埋植法进行同期发情取得成效,随后这一技术开始在生产上应用。国内,绵羊的同期发情研究始于20世纪70年代,张儒学于1980年用结合FSH和LH的甲孕酮阴道海绵栓进行了绵羊同期发情试验,同期发情率100%、受胎率78%。绵羊同期发情技术在20世纪90年代趋于成熟,埋植装置阴道孕酮释放法的出现更为这一技术的大面积推广与应用提供了平台[5,6]。目前,虽然绵羊超排的方法应用已较广泛,但由于绵羊妊娠涉及胚胎和母体子宫间妊娠信号的建立、附植的发生和胎盘的形成等一系列生理、生化过程[7],导致其可用胚数量少,每只供体平均只有4枚左右[8]。 杜泊绵羊的胚胎移植也存在超排效果不稳定、受精率低的制约。因而本研究旨在生产条件下,对杜泊绵羊按不同超排方案、不同FSH剂量、重复超排处理、比较不同季节及不同侧移植效果,为筛选出适合生产应用的超排技术提供依据。
1 材料和方法
1.1 试验动物及药械
1.1.1 试验用羊及饲养管理
选取体重在65~80 kg,健康、繁殖机能正常的经产母羊做供体;受体母羊年龄为1~4岁,膘情良好、健康,体重在50 kg以上。试验前期精细管理并进行补饲。采精公羊为养殖场纯种公羊,性欲良好,精液品质优良。试情公羊为性欲旺盛的成年公羊。
1.1.2 激素药品
促卵泡素(FSH)、促黄体素(LH)、孕马血清促性腺激素(PMSG):宁波三生药业有限公司产;阴道栓(CIDR):新西兰产EAZI-BREED-CIDR,20个/袋;Holding培养液:新西兰生产,50 mL/袋。
1.1.3 设备及器械
外科手术器械、手术保定架、体视显微镜、检卵针、冲卵管、移植枪、实体显微镜、恒温台等。
1.2 试验方法
1.2.1 供体羊超排处理和配种
CIDR+FSH+PMSG注射法:杜泊供体羊发情周期内任意一天阴道放入CIDR,此后第10天开始注射FSH,每隔12 h注射FSH且剂量递减,至第12天,取出CIDR后注射PMSG。超排羊在停止注射激素后24~48 h内发情,公羊试情,间隔6~12 h再试情1次,直至不接受交配为止,并在第2次试情后注射LH 110 IU/只。受体羊同步试情处理。
CIDR+FSH+PG注射法:杜泊供体羊发情周期内任意一天阴道放入CIDR,此后第10天开始注射FSH,每隔12 h一次,等剂量,在第12天时取出CIDR后注射PG。超排羊在停止注射激素后24~48 h内发情,公羊试情,间隔6~12 h再试情1次,直至不接受交配为止,并在第2次试情后注射LH 110 IU/只。受体羊同步试情处理。
采用开膣器输精+自然交配+开膣器输精方式,人工采集种公羊精液,镜检,活率达0.6以上方可用于人工输精。
1.2.2 胚胎质量鉴定
配种后第5天手术法从子宫角冲卵,在20~40倍体式显微镜下根据受精卵的形态、色泽、分裂球的大小和数量、均匀度、细胞的密度及变化情况确定受精卵发育期、未受精卵及胚胎发育阶段。
1.2.3 受体处理与腹腔内窥镜法胚胎移植
使用CIDR+PMSG法,与供体羊同步埋植CIDR,在供体羊撤栓前10 h撤除CIDR,注射280 IU PMSG。试情如前所述,详细记录发情时间。
采用腹部手术法处理受体羊,腹腔内窥镜观察,单侧卵巢1~3个黄体则移植1~2枚胚胎。
1.2.4 供受体羊术后处理
供受体羊术后在小圈内观察1~2 d,圈舍应保持清洁干燥,防止感染,保证术后恢复良好。
1.2.5 数据处理
使用spss18.0软件对超排供体黄体数、可用胚胎数分别进行χ2检验。
2 结果与分析
2.1 不同方案的超排效果
在表1中,采用不同搭配注射方式进行超排,结果显示,CIDR+ FSH + PMSG 的供体平均黄体数(11.80个/只)、平均冲卵数(9.20枚/只)、平均可用胚数(7.80/只)和移植妊娠率50.00%(P<0.05),超排效果比CIDR+FSH+PG要好。

表1 不同超排方案的效果比较
注:表中数字肩标字相同者,差异不显著,P>0.05;不同者,差异显著,P<0.05,大写字母表示差异极显著,下同。
2.2 不同剂量FSH的超排效果
按统一方案处理的45只杜泊供体绵羊中,在体重(60 kg以上)相近的情况下,按FSH的注射剂量范围分为三组,140~180 IU组、180~230 IU组、230~280 IU组(见表2)。结果表明,180~230 IU组的平均黄体数、平均冲卵数、平均可用胚胎数和移植妊娠率分别为:12.87个/只、10.88枚/只、9.28枚/只和75.00%,无论是平均黄体数、平均获卵数还是平均可用胚胎数、移植妊娠率都高于其他两个FSH剂量组(P<0.05)。
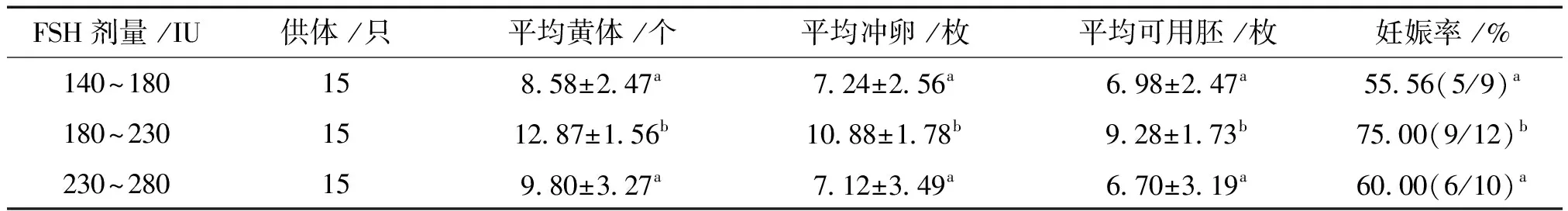
表2 不同FSH剂量对杜泊绵羊超排效果的影响
2.3 重复超排的超排效果
表3显示,2013年10月与2012年10月的结果比较差异不显著(P>0.05)。对上一年使用过的30只羊重复超排,结果表明只要手术时注意操作方法,尽量减少出血点、适当灌注含林可霉素的生理盐水就可以减少甚至有可能避免粘连现象的发生,以利于羊只的重复使用,从而提高经济效益。

表3 重复超排对杜泊绵羊超排效果的影响
2.4 不同季节的超排效果
2013年春季、秋季(间隔6个月)两次超排结果对比发现,秋季超排在平均黄体数、平均冲卵数、平均可用胚数上显著高于春季,秋季胚胎移植妊娠率59.14%极显著高于春季妊娠率38.16%(P<0.01)。

表4 不同季节对杜泊绵羊超排效果的影响
2.5 不同侧卵巢移植的超排效果
统计50只供体左、右侧卵巢平均黄体数、平均冲卵数、平均可用胚数差异不显著(P>0.05)(见表5),说明左、右侧卵巢对超排反应无差别。

表5 左右侧卵巢对杜泊绵羊超排效果的影响
3 讨论
3.1 不同超排方案的超排效果
超排方法对超排效果的影响包括超排药物剂量、激素的不同种类及激素生产厂家的不同等,此前有报道国内平均水平为5~7枚[9],阎振富等[8]报道超排处理绵羊可用胚为6枚左右。魏建英等[10]研究报道杜泊羊采胚只均获胚胎5.16枚。本研究的两个超排方案获胚数与此前国内报道一致,两种方法中,CIDR+FSH+PMSG法较为理想,CIDR中的孕酮被吸收进入血液后提高血液孕酮浓度,足以抑制来自垂体前叶LH和FSH的释放,撤掉CIDR后孕酮水平降低回归基础水平,刺激卵泡发育成熟排卵形成黄体,而此时注射PG的剂量和时间的掌握对黄体的发育有着极为重要的影响,刺激较大,而PMSG效果较为平缓,卵巢体积不会剧烈增大,处理后的卵巢容易恢复正常,排卵率高。
3.2 不同FSH剂量的超排效果
Renaville等[11]发现,超排效果与供体体况显著相关,超排时单一、营养水平较低的饲养方式会导致黄体早期退化,造成胚胎退化甚至检不到胚胎。即使配种前对供体催情补饲也不会提高排卵率,甚至使胚胎存活力降低。张金龙等[12]研究表明,营养水平较好(体重40~50 kg)的波尔山羊排卵效果最佳。PMSG由于其半衰期长,容易引起卵巢囊肿[13],对剂量的正确使用要求较高,因而国内外目前更倾向于使用FSH[14]。而FSH的使用剂量对绵羊超排效果有很大影响。有报道称,供体FSH注射剂量的过低或过高会导致超排黄体少或卵泡过多,影响超排效果,但相同来源的激素在一定剂量范围内,超排效果随剂量上升而有增大趋势。对杜泊羊,国内报道的FSH剂量区间126~ 150 IU,平均采集可用胚5.16枚[10]。过大的剂量会影响卵泡的发育和卵子的质量。在体重相近的情况下,将FSH剂量为140~180 IU组、180~230 IU组、230~280 IU组三组,结果180~230 IU组效果最好,说明FSH注射剂量有一个适宜剂量,过低过高都将影响超排效果。
3.3 重复超排的超排效果
羊的生理解剖特点决定了无法直肠检查,只能通过手术观察子宫,这既加大了工作量,又易增大粘连发生的几率。常用的腹腔镜技术虽然对母羊生殖器官损伤小、减少手术刺激及盲目性等优点,但对操作技术要求较高,且设备较昂贵。在实际生产上,优质种羊应得到高效重复使用,这可以有效降低成本、提高羊只利用率,但手术造成的生殖器官黏连,严重制约冲胚效果。本研究对30只间隔12个月的杜泊绵羊进行重复超排,其中有26只羊第2次超排采出胚胎,采胚成功率、平均黄体数、平均可用胚数与第1次比较无显著差异(P>0.05),且略有提高。分析可能原因,我们认为一是采取了手术时严格消毒和防止粘连的措施;二延长了超排处理的时间间隔,使卵巢有充足的恢复时间。
3.4 不同季节、左右侧移植的超排效果
本试验超排效果比较发现,在绵羊自然发情季节,秋季的效果明显好于春季。张果平等[15]对杜泊羊进行研究发现,秋冬两季的回收胚胎数显著高于春季,这与本次试验结果相一致。但桑润滋等[16]研究发现,波尔山羊在春、夏、秋三个季节的超排效果没有差异,以秋季较好,这可能与品种间差异有关。不同侧卵巢在激素处理后,结果表明,妊娠率无显著差异(P>0.05),说明移植效果与移植侧没有必然联系,只于黄体质量关系较大。
[1] 程小强,桑润滋,等.特克塞尔、杜泊及其杂交一代生长发育的研究[J].中国科技论文在线.2007,02(2):145-148.
[2] John F Hasler.The current status and future of commer-cial embryo transfer in cattle[J].Animal ReproductionScience,2003,79:245-264
[3] Walker S K,Smith D H,Frensham A,et al.The use of synthetic gonadotropin releasing hormone treatment in the collection of sheep embryos.Theriogenology,1989,31:741-752.
[4] 李俊,桑润滋,等.杜泊羊胚胎移植试验[J].畜牧与兽医.2005,37(2):26-27.
[5] 张居农,李正尚,等.肉用羊超数排卵技术方案的研究[J].中国草食动物 2001,专辑:125-126
[6] 张居农,王东军,等.绵羊同期发情技术研究[J].中国畜牧杂志.1995,31(5):27-30.
[7] Cross J C,Werb Z,Fisher S J.Implantation and the pla-centa key pieces of the development puzzle[J].Science,1994,266(5190):1508-1518.
[8] 阎振富,辛英霞,胡月超.影响羊胚胎移植效果因素[J].河北畜牧兽医,2004,20(2):40.
[9] 王金文,张果平,等.杜泊绵羊超数排卵与胚胎移植试验[J].中国草食动物.2006,1:14-15.
[10] 魏建英.杜泊绵羊胚胎移植技术试验[J].试验研究,2010,06(91):56-58.
[11] Renaville R,A Burny.Biotechnology in Animal Husbandry[M].The Netherlands Kluwer Academic Publishers,2000.
[12] 张金龙,张效生,等.影响供体羊超数排卵效果因素研究[J].黑龙江畜牧兽医,2013,47:14-15.
[13] 杜俊峰.羊超数排卵的方法及其效果比较[J].养殖技术顾问,2005(05):53-54.
[14] 李正尚,张洪福,等.肉用羊超数排卵技术方案的研究[J].中国草食动物,2001S(1):126-127.
[15] 张果平,王金文,等.影响杜泊羊超数排卵和胚胎移植效果因素的研究[J].家畜生态学报,2010,31(4):61-62.
[16] 桑润滋,田树军,等.影响波尔山羊超排效果的因素[J].中国兽医学报,2005,25(5):543-545.

