β-tubulinⅢ和Stathmin联合检测在评价多西他赛治疗晚期肺鳞癌疗效中的应用
王秀丽, 段惠洁, 张国庆, 刘春玲
(新疆医科大学附属肿瘤医院 肺内科, 新疆 乌鲁木齐, 830000)
肺癌是中国发病率和死亡率最高的恶性肿瘤[1]。肺腺癌、肺鳞癌是肺癌中最主要的两种病理类型。近年来,肺腺癌的诊断预测指标不断涌现,如表皮生长因子受体(EGFR),棘皮动物微管相关蛋白样4-间变性淋巴瘤激酶(EML4-ALK)融合基因等。而肺鳞癌的诊治却发展缓慢,疗效预测指标较少、治疗药物有限,因此迫切需要找到一些对肺鳞癌疗效预测准确性较高的指标,从而指导临床用药。多西他赛是治疗肺鳞癌的常用药,以微管为作用靶点。研究发现微管相关蛋白Stathmin和Ⅲ型β微管蛋白(β-tubulinⅢ)对微管类化疗药物有较好地疗效预测作用[2-5], 本研究拟以β-tubulinⅢ和Stathmin为候选指标,通过前瞻性研究的方法找出预测多西他赛治疗肺鳞癌疗效的优选标志物或标志物组合。
1 资料与方法
1.1 一般资料
选取2007年10月—2012年8月新疆医科大学附属肿瘤医院肿瘤内科收治的肺鳞癌的患者95例,入组标准: ① 经纤维支气管镜或穿刺活检或手术切除病理组织学明确诊断为肺鳞癌,且为初治者; ② 按国际TNM分期为ⅢB~Ⅳ期; ③ 至少有1个单径可测量的病灶; ④ 年龄18~75岁,身体状况ECOG评分0~1分,预计生存期≥3个月; ⑤ 无主要器官的功能障碍; ⑥ 入选患者均签署知情同意书。排除标准: ① 正在接受其他抗肿瘤治疗者; ② 妊娠、哺乳期或未育患者; ③ 原发性脑瘤或中枢神经转移瘤病情未控者; ④ 其他恶性肿瘤病史者; ⑤ 化脓性及慢性感染性伤口迁延不愈者; ⑥ 患有不易控制的精神病者; ⑦ 化疗禁忌证者。其中男69例,女26例;年龄36~77岁,中位年龄66岁。年龄<60岁28例,≥60岁67例;不吸烟或少吸烟34例,大量吸烟61例; ECOG评分0分43例, 1分52例; ⅢB期45例,Ⅳ期50例。
1.2 方法
1.2.1 治疗方案:收集入组患者的病理标本及临床资料,完善治疗前检查,明确分期,行多西他赛联合顺铂方案化疗:多西他赛75 mg/m2, 静脉滴注d1, 顺铂30 mg/m2, 静脉点滴d1~3,每21 d为1个化疗周期。化疗2个周期后进行疗效评价。对于疾病进展者依据NCCN指南更换治疗方案,并进入随访,对于有效者,可继续该方案治疗,最多可达6个周期,以最佳疗效作为最终疗效评价。化疗结束后定期复查、随访直至病变进展或死亡。
1.2.2 检测方法:免疫组化SP法检测β-tubulinⅢ与Stathmin蛋白表达,β-tubulinⅢ与Stathmin一抗均购自福州迈新生物技术有限公司,免疫组化试剂盒购自北京中杉金桥生物技术有限公司。收集入组患者的组织学标本,制备4~5 μm厚的切片,按免疫组化试剂盒说明书检测β-tubulinⅢ、Stathmin的表达。用已知Stathmin、β-tubulinⅢ蛋白表达阳性的切片作阳性对照,用PBS缓冲液代替一抗作阴性对照。
1.3 观察指标
根据实体瘤的评价标准(RECIST)进行总体最佳疗效评价[6], 包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。主要观察指标为客观有效率(ORR);次要观察指标是疾病进展时间(TTP)和总生存期(OS)。客观有效率(ORR):定义为CR+PR病例所占所有病例百分比。TTP: 指患者第一次给药至任何有记录的病变进展之日或任何原因引起的死亡之日的时间。OS: 患者开始治疗至患者死亡或末次随访时间。
1.4 染色结果判定
染色结果由病理科医生进行诊断和病理分级。每张切片在10×40倍镜下,随机选取5个视野,按肿瘤细胞着色强度和阳性细胞率分别进行计分。0分为阴性(-),1~2分为阳性(+),3~6分为中度阳性(2+),7~9分为强阳性(3+)。分析结果时, ≤2分为阴性即低表达, >2分为阳性,即高表达。
2 结 果
2.1 临床疗效
95例患者中CR 0例, PR 31例, SD 37例, PD 27例; ORR为32.6%(31/95)。
2.2 不同临床资料中Stathmin及β-tubulinⅢ蛋白的表达
β-tubulinⅢ和Stathmin均表达在肿瘤细胞的胞浆中,见图1。
β-tubulinⅢ高表达50例, β-tubulinⅢ低表达组45例; Stathmin高表达53例, Stathmin低表达42例。β-tubulinⅢ和Stathmin阳性表达在不同年龄、性别、吸烟情况中分布无显著差异(P>0.05), 但在不同TNM分期、ECOG评分中分布差异显著(P<0.05或P<0.01), 在ECOG评分欠佳、分期较晚的病例中阳性表达率较高。见表1。
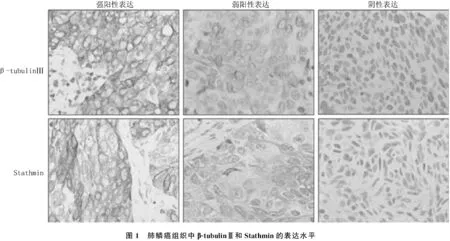
图1 肺鳞癌组织中β-tubulinⅢ和Stathmin的表达水平
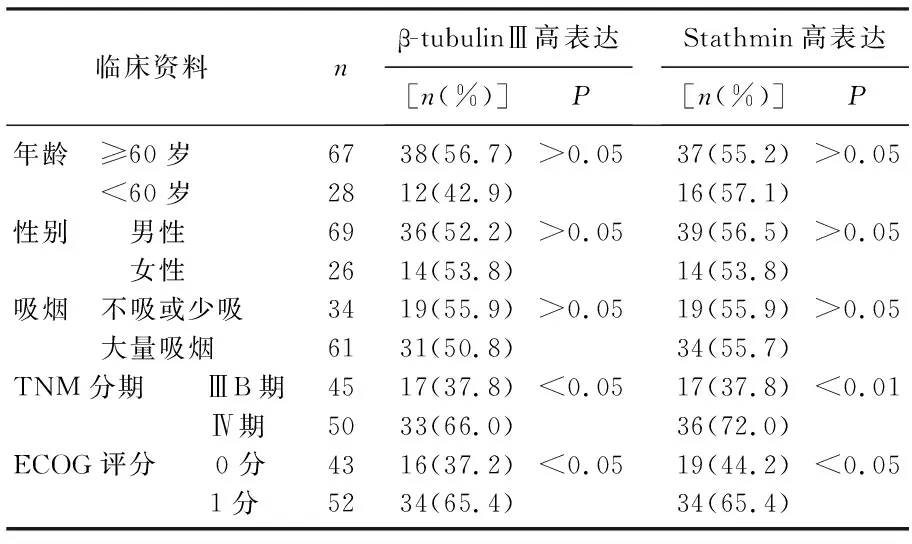
表1 Stathmin及β-tubulinⅢ蛋白的表达与临床资料的关系
2.3 β-tubulinⅢ、Stathmin表达与多西他赛化疗疗效的关系
β-tubulinⅢ及Stathmin各自高表达组ORR均显著低于各自低表达组(P<0.05)。β-tubulinⅢ、Stathmin均低表达组(双低组)ORR为61.9%, β-tubulinⅢ、Stathmin均高表达组(双高组)的ORR为20.7%, 双低组ORR显著高于双高组(P<0.01), 并高于β-tubulinⅢ高表达组和Stathmin高表达组(P<0.01), 见表2。
2.4 β-tubulinⅢ、Stathmin表达与TTP、OS之间的关系
β-tubulinⅢ低表达组TTP和OS均优于高表达组(P<0.01)。Stathmin低表达组TTP和OS也优于高表达组(P<0.01)。双低组患者的TTP和OS均显著优于β-tubulinⅢ低表达组、Stathmin低表达组和双高组(P<0.01)。见表3。
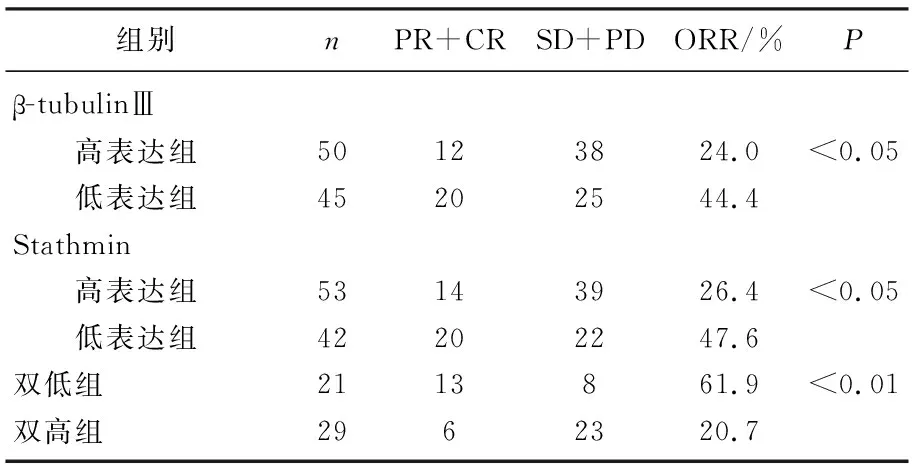
表2 β-tubulinⅢ及Stathmin表达与化疗疗效的关系
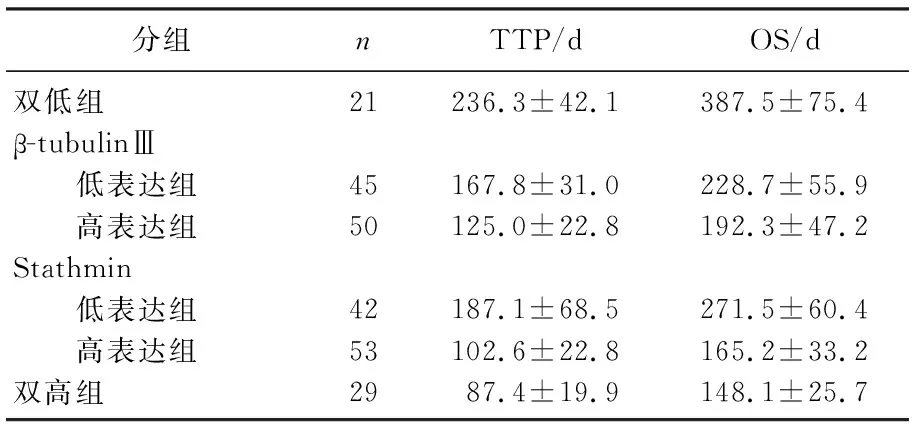
表3 β-tubulinⅢ及Stathmin不同表达组间TTP及OS比较
3 讨 论
肺鳞癌约占原发性肺癌的30%,没有较好的靶向治疗手段,细胞毒性药物化疗仍是晚期肺鳞癌的标准治疗。多西他赛是一种半合成的紫杉烷类广谱抗肿瘤药物,是肺鳞癌的主要治疗药物之一,通过促进微管聚合并抑制微管解聚从而使肿瘤细胞的有丝分裂终止并凋亡[7],从而达到抗肿瘤作用[8]。和其他化疗药物一样,多西他赛的耐药性是限制其临床应用的主要原因之一。在个体化治疗模式逐渐推广的今天,找到较好的疗效预测指标,避免无效化疗是改善肺鳞癌治疗效果的可行方法。Stathmin蛋白是近年来发现的一种微管不稳定蛋白,在细胞周期运行中调控微管的动态平衡。Stathmin在多种恶性肿瘤中呈现高表达[9]。研究[10]发现,Stathmin高表达会影响紫杉类药物和微管的结合,从而导致乳腺癌细胞对紫杉类药物的反应下降。微管蛋白β-tubulinⅢ是另一种与作用于微管的化疗药物敏感性关系最密切的标志物,在胃癌、乳腺癌、肺癌等恶性肿瘤中的研究中,均提示β-tubulinⅢ是预测微管类化疗药物疗效的潜在指标[4-5]。
本研究结果显示,β-tubulinⅢ与Stathmin表达在患者的性别、年龄、吸烟史等临床特征分布方面差异不明显,而在ECOG评分欠佳、分期较晚、疗效差的病例中阳性表达率较高,提示β-tubulinⅢ与Stathmin蛋白水平高表达是肺鳞癌治疗的不良预后因素。结果分析发现,β-tubulinⅢ和Stathmin作为单独预测指标来预测多西他赛的近期、远期疗效都有较好的预测价值,和文献报道相符[11-12]。而β-tubulinⅢ和Stathmin蛋白均低表达的病例在ORR和长期生存方面均显著优于二者均高表达组及单独低表达组,提示两个指标联合检测对疗效的预测更加准确和敏感。蒲骁麟等通过western-blot方法进行了β-tubulinⅢ和Stathmin检测,分析了二者对长春瑞滨疗效的预测作用[13-14],和本研究结果一致,进一步验证了β-tubulinⅢ和Stathmin联合检测在微管类药物疗效预测中的准确性[15]。
本研究证明了晚期肺鳞癌中β-tubulinⅢ与Stathmin蛋白表达水平对多西他赛的疗效及预后有较好的预测价值,能够为肺鳞癌的个体化治疗提供一定的参考价值,且免疫组化方法简便易行,适合临床常规检测。
[1] 陈万青, 张思维, 曾红梅, 等. 中国2010 年恶性肿瘤发病与死亡[J]. 中国肿瘤, 2014, 23(1): 1.
[2] Chen P W, Lin S J, Tsai S C, et al. Regulation of microtubule dynamics through phosphorylation on stathmin by Epstein- Barr virus kinase BGLF4 [J]. J Biol Chem, 2010, 285(13): 10053.
[3] Fang L, Min L, Lin Y, et al. Down regulation of stathmin expression is mediated directly by Egr1 and associated with p53 activity in lung cancer cell line A549[J]. Cell Signal, 2010, 22(1): 166.
[4] Hwang J E, Hong J Y, Kim K, et al. Class III β-tubulin is a predictive marker for taxane-based chemotherapy in recurrent and metastatic gastric cancer[J]. BMC Cancer, 2013, 13:431.
[5] Zhang H L, Ruan L, Zheng L M, et a1. Association between class Ⅲβ-tubulin expression and response to paclitaxel/vinorebine-based chemotherapy for non-small cell lung cancer:a meta-analysis[J]. Lung Cancer, 2012, 77(1): 9.
[6] Nishino M, Jackman D M, Hatabu H, et al. New response evaluation criteria in solid tumors (RECIST) guidelines for advanced non-small cell lung cancer: comparison with original RECIST and impact on assessment of tumor response to targeted therapy[J]. Am J Roentgenol, 2010, 195(3): 221.
[7] Kavallaris M. Microtubules and resistance to tubulin-binding angents[J]. Nat Rew Cancer, 2010, 10(4): 194.
[8] Faucz F R. Docetaxel treatment in castration-resistant prostate cancer: the triad gene-drug-disease[J]. J Clin Endocrinol Metab, 2011, 96(2): 351.
[9] Jeon T Y, Han M E, Lee Y W, et al. Over expression of stathmin1 in the diffuse type of gastric cancer and its roles in proliferation and migration of gastric cancer cells[J]. Br J Cancer, 2010, 102(4): 710.
[10] Alli E, Yang J M, Hait W N. Silencing of stathmin induces tumor-suppressor function in breast cancer cell lines harboring mutant p53[J]. Oncogene, 2007, 26(7): 1003.
[11] Meng X L, Su D, Wang L, et al. Low expression of stathmin in tumor predicts high response to neoadjuvant chemotherapy with docetaxel-containing regimens in locally advanced breast cancer[J]. Genet Test Mol Biomarkers, 2012, 16(7): 689.
[12] Jiang H, Yu X M, Zhou X M, et al. Correlation between microtubule-associated gene expression and chemosensitivity of patients with stage II non-small cell lung cancer[J]. Exp Ther Med, 2013, 5(5): 1506.
[13] 蒲骁麟, 王峻, 许林, 等. β-tubulin-Ⅲ和Stathmin与晚期非小细胞肺癌化疗敏感性的关系[J]. 中国肺癌杂志, 2009, 12(1): 49.
[14] 杨静翔,罗虎,周向东.紫杉醇脂质体对比吉西他滨联合顺铂一线治疗中晚期肺鳞癌的疗效评价[J].第三军医大学学报,2014,36(2):140.
[15] 韩冰,赵明静,马列,等.血清癌胚抗原细胞角蛋白19片断21-1和神经元特异性烯醇化酶联合检测对肺腺癌鳞癌化疗预后的价值研究[J].中国实用内科杂志,2012,32(6):449.
——水芹主要害虫识别与为害症状

