持续气道正压通气对严重阻塞性睡眠呼吸暂停综合征患者心血管疾病风险的影响
许 娟, 嵇友林, 姜永前
(江苏省盐城市第一人民医院 呼吸内科, 江苏 盐城, 224005)
阻塞性睡眠呼吸暂停综合征(OSAS)可引起全身多器官功能损伤,尤其是心脑血管损害。目前,OSAS已成为年龄、肥胖、吸烟之外引起高血压、冠心病、脑卒中等心脑血管疾病及代谢紊乱性疾病的独立危险因素。大量研究证实了系统炎症在OSAS所致血管病变中主要表现为致炎因子、趋化因子的升高和抗炎因子的减少。有研究发现OSAS患者血清TNF-α和SCD40L水平较对照组明显升高且二者升高的水平呈正相关。在心脑血管疾病中也发现这两种炎症因子的升高。持续气道正压通气(CPAP)是目前OSAS的首选治疗方法。本研究以AHI≥30 次/h的OSAS患者为研究对象,在同一人群中同时检测糖脂代谢、血压、肺功能、系统炎症以及心血管疾病风险预测因素,观察CPAP治疗前后上述指标的变化以及治疗依从性的影响。
1 资料与方法
1.1 一般资料
选取2011年7月—2012年9月就诊于本院呼吸科睡眠监测中心,经PSG监测诊断为OSAS中AHI≥30次/h且临床稳定的50例患者。排除标准: ① 除代谢综合征以外的内分泌或代谢紊乱; ② 有心肌梗死、心绞痛或脑卒中病史; ③ 近期内炎症性疾病或其他慢性疾病;④除阻塞性睡眠呼吸暂停综合征以外的睡眠呼吸紊乱以及呼吸系统其他疾病; ⑤ 神经系统功能障碍性疾病; ⑥ 长期使用镇静剂、各种抗生素及抗炎药物、口服抗凝药、饮酒等病史; ⑦ 近期内手术、创伤史; ⑧ 其他系统病变如:肝、肾、血液系统病变、恶性肿瘤等。所有符合条件的患者登记姓名、年龄、性别、是否吸烟、既往病史以及使用药物情况;按标准测量体重指数、颈围、腰围。填写Epworth嗜睡评价量表及睡眠调查表评估日间嗜睡情况。
CPAP治疗10周后返回中心进行随访研究、临床评估以及生化检查分析。根据CPAP治疗仪内置智能卡以及患者所记录CPAP治疗时间分为2组:依从性好组(≥4 h/晚)及依从性差组(<4 h/晚)。
1.2 方法
1.2.1 睡眠呼吸监测:所有受试者均用北京新兴生物研究发展中心SRM-9600多导睡眠监测仪行整夜多导睡眠图监测。检查当天禁服咖啡因、镇静剂、催眠药及饮酒。同步监测脑电图(C3A2、C4A1)、眼动图、颌肌电图、口鼻气流、鼾声、胸腹式呼吸、体位、手指脉搏血氧饱和度(SpO2)及心电图等,测清晨清醒时平卧位静息状态血压。
1.2.2 肺功能检查:受试者接受PSG监测前当天上午进行肺功能检查,记录肺活量(VC)、用力肺活量(FVC)以及一秒钟呼气容积(FEV1)值。检查前避免空腹和剧烈活动。
1.2.3 CPAP治疗:所有受试者在PSG监测随后的夜间在睡眠监测中心接受经鼻CPAP治疗,使用美国伟康公司CPAP治疗仪,使用加温湿化器,调整合适的压力及模式以获得最大的舒适度并调整面罩漏气。以能够消除各睡眠期以及各种体位时出现的鼾声、呼吸暂停、低通气,保持整夜睡眠中AHI<10/h[1],并能使患者感觉舒适的最低压力水平为理想压力。治疗期间坚持适度运动并适当控制饮食。治疗的依从性根据CPAP治疗仪内置的智能卡。
1.2.4 静脉血采集:采集受试者CPAP治疗前及治疗10周后清晨睡醒时空腹平卧位肘前静脉血标本2份。立即分离血清,一份当天测定血糖、血脂、血清胰岛素、纤维蛋白原水平,另一份于-70 ℃保存,待所有入选对象血标本收集完成后,酶联免疫吸附法检测血清TNF-α、SCD40L水平。
1.3 结果判断
1.3.1 OSAS定义及分级标准:根据中华医学会呼吸病学分会睡眠呼吸疾病学组2004年制定的《阻塞性睡眠呼吸暂停低通气综合征诊治指南》OSAS定义为:睡眠时口、鼻气流消失,但胸腹式呼吸运动仍然存在;每夜7 h睡眠中呼吸暂停及低通气反复发作30次以上,或AHI≥5次/h。据AHI和夜间SpO2可将OSAS分为轻、中、重度。其中以AHI作为主要判断标准,夜间血氧饱和度作为参考。重度OSA S指AHI>40次/h, 夜间最低血氧饱和度<80%。本研究所有入选对象符合AHI≥30次/h。
1.3.2 胰岛素抵抗(HOMA-IR)指数:稳态模型评估HOMA-IR=空腹胰岛素(m IU/L)×空腹血糖(mmol/L)/22.5[2]。
1.3.3 心血管病变风险评估:基于最新发表的性别特异的多变量的风险因素算法[3].性别特异的多变量危险函数由整体的性别、年龄、综合高密度脂蛋白胆固醇、收缩压、高血压治疗、抽烟以及糖尿病状态等衍生。使用COX相对危险回归法评估CVD事件的风险。用于估计总的CVD风险及个体CVD事件风险(冠心病,脑血管及外周动脉疾患和心力衰竭)。估计的绝对CVD事件率可以用于预测十年内发生心血管事件的风险和指导预防。
2 结 果
2.1 患者一般资料特征
所有患者以及按依从性分组后患者的一般资料,见表1。与使用CPAP≥4 h/晚的依从性好组患者比较,依从性差组患者BMI以及面罩漏气率较高。2组患者的年龄、性别、常规肺功能、既往病史、用药情况等特征比较,差异无统计学意义(P>0.05)。
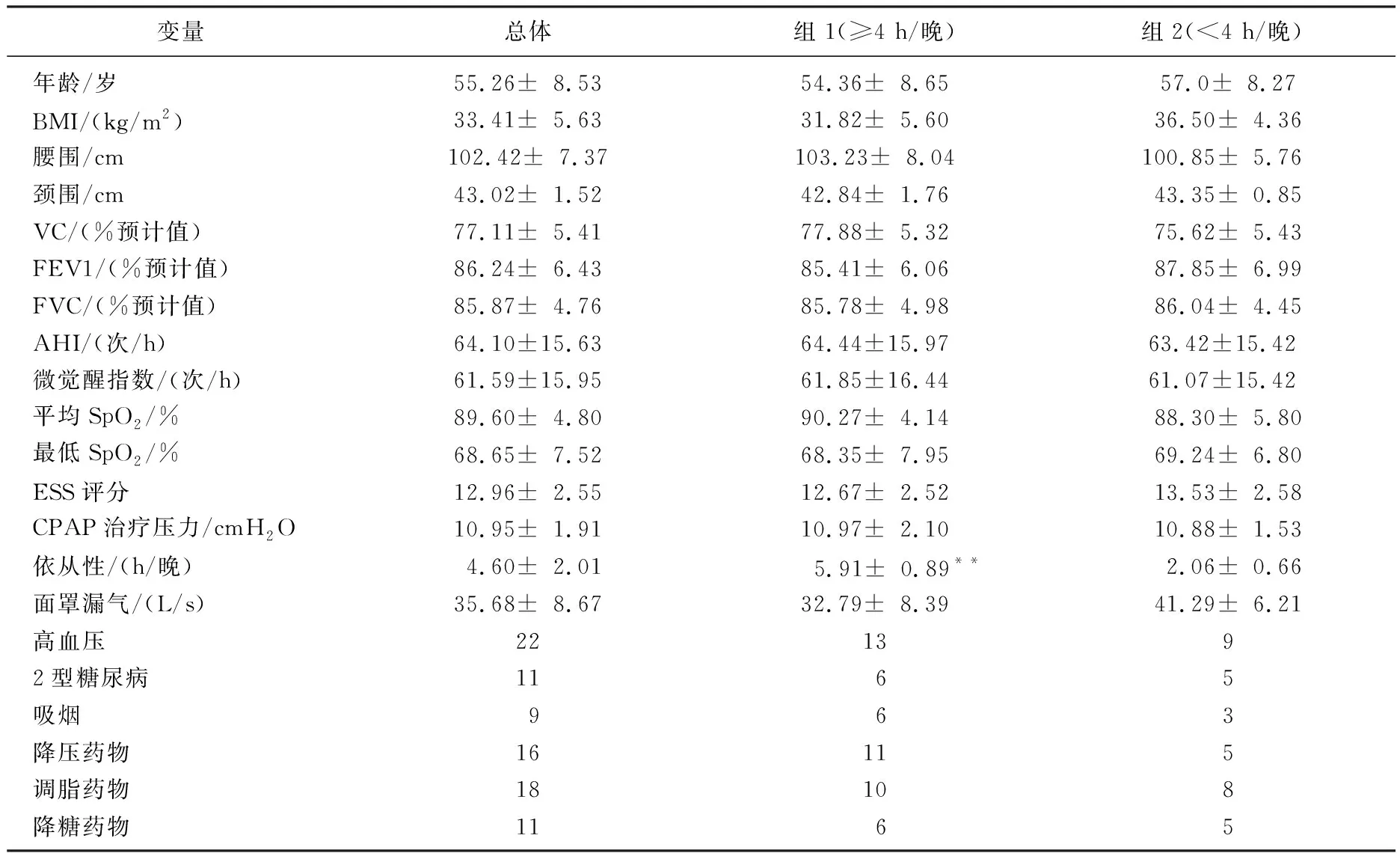
表1 所有严重OSAS患者及根据治疗依从性分组的一般特征
与组2比较,**P<0.01。
2.2 CPAP治疗前后心血管疾病风险以及炎症因子水平变化
治疗前2组的血压、血脂、血糖、炎症因子水平等指标差异无统计学意义。治疗后在CPAP治疗依从性好组观察到收缩压、舒张压、总胆固醇、甘油三酯、空腹血糖、空腹胰岛素、HOMA-IR、TNF-α、SCD40L较治疗前明显改善,而依从性差组无改善。2组患者治疗后的随访值比较,上述指标之间差异有统计学意义(P<0.05),见表2。CPAP治疗≥4 h/晚组,CVD风险系数下降,而在<4 h/晚组未有明显改变。总体的TNF-α与SCD40L的变化呈直线相关,见图1。
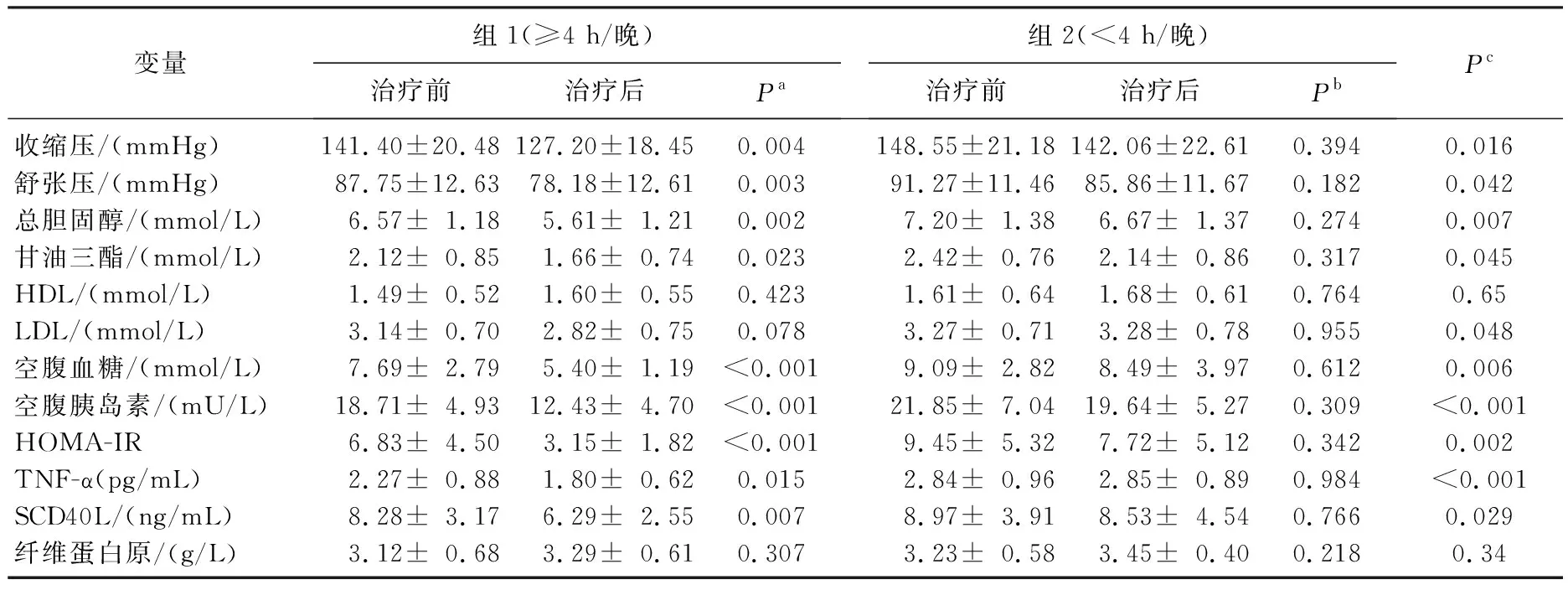
表2 按依从性分组后患者治疗前后CVD风险、炎症因子变化及比较
Pa、Pb: 分别表示2组患者治疗前后结果的差异比较;Pc: 表示10周后随访依从性好与依从性差组之间结果的差异比较。
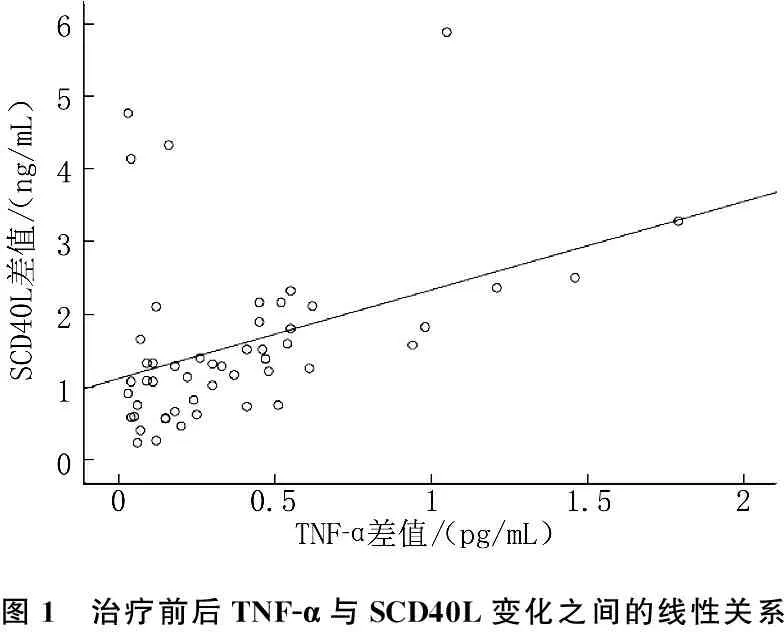
图1 治疗前后TNF-α与SCD40L变化之间的线性关系
2.3 CPAP治疗依从性对治疗效果的影响
总体的CPAP治疗依从性与治疗前后血压、血脂、炎症因子、心血管疾病风险相关因素绝对值变化之间的相关性分析,见表3。CPAP治疗的依从性是影响其降低心血管疾病风险及炎症因子水平作用的重要因素。

表3 总体CPAP治疗依从性与10周后心血管疾病风险相关因素以及炎症因子水平绝对值变化之间的线性关系
R: 表示相关系数。
2.4 CPAP治疗依从性相关因素分析
将患者按CPAP治疗依从性所分2组之间治疗前的BMI、面罩漏气存在显著差异。直线回归分析提示CPAP治疗依从性与年龄以及AHI无关,与BMI和面罩漏气之间存在相关性;以CPAP治疗依从性为因变量,年龄、AHI、BMI、面罩漏气为自变量作多元逐步回归分析提示仅面罩漏气及BMI对依从性有显著影响,可能是治疗依从性的重要预测因素。
3 讨 论
流行病学资料证实,OSAS患者心血管疾病的发病率增高,而心血管疾病患者也发现较高的OSAS患病率。国外资料表明,冠状动脉造影显示有冠状动脉狭窄的冠心病患者,经PSG监测有35%患者合并OSAS, 85.4%的缺血发作是在睡眠呼吸暂停伴有血氧饱和度下降>3%时。在未经治疗的OSAS患者中有23.8%合并有缺血性心脏病(OHD)。Wisconsin 睡眠队列研究发现24 h血压与AHI之间独立于其他混淆因素BMI等的线性关系[4-5]。睡眠心脏健康研究的大规模横断面研究证实睡眠呼吸紊乱与心力衰竭之间有着显著关联[6]。OSAS引起心血管疾病的机制尚未明确,可能机制包括交感神经兴奋、代谢紊乱、系统炎症、氧化应激、血管活性物质增高、内皮功能紊乱、胰岛素抵抗、心血管变异性、血液高凝等[7]。本研究对心血管疾病的风险预测基于近期出版的性别特异多变量的风险因素算法,考虑了性别、年龄、总胆固醇、高密度脂蛋白胆固醇、收缩压、吸烟、肥胖等多种因素,优于传统的Framingham风险函数。
国内外大量研究探讨OSAS患者系统炎症及其与心血管疾病的关系。其中研究较多的炎症因子包括hsCRP、TNF、IL-6、IL-10,IL-18、VCAM、ICAM、血清瘦素等,但近年来部分研究报道血清hsCRP、IL-6、瘦素水平在CPAP治疗前后无明显差异,并认为OSAS患者血清hsCRP、IL-6、瘦素水平的增高主要源于肥胖而并非OSAS[8-10]。SCD40L是早期预测和诊断急性冠状动脉综合征发病风险良好而可靠的生化标志物[11-12], 且与疾病的严重程度以及疗效有关。Kazuyuki Kobayashi等[13]的研究发现严重OSAS患者接受CPAP治疗的早期即可观察到SCD40L水平的下降并与临床症状及AHI的改善相平行。本实验证实经过有效的CPAP治疗后患者血清TNF-α及SCD40L水平明显下降,且与治疗依从性相关。二者水平的下降相平行并与心血管疾病风险的下降呈正相关。
CPAP是OSAS首选的治疗手段。有证据表明其可以降低OSAS患者发生心血管疾病的风险,延缓OSAS并发心血管疾病的进展,改善预后,尤其是患有严重OSAS患者。Marti等[14]的研究显示,重度OSAS患者接受CPAP治疗后的5年生存率为97%, 而未接受CPAP治疗的患者为80%。对伴有心、脑血管疾病的OSAS患者, CPAP治疗对于改善OSAS的症状和伴随疾病后遗症有肯定的作用。本实验结果表明,10周的CPAP治疗可以降低严重OSAS患者的总体心血管疾病风险。然而,这些有利影响仅在使用CPAP≥4 h/晚的患者组中发现。本研究在同一组研究对象中测定多个变量证实了CVD风险的降低。实验结果表明,仅在依从性好的治疗组中可以观察到CPAP治疗降低血压、血糖、血脂、胰岛素抵抗以及血清炎症因子水平的有益作用,而在依从性差的治疗组中未发现,这与目前国内外已有的研究结果一致。患者对治疗的依从性受多因素影响,治疗前的适当介绍以及教育、吸入气体的湿化、合适的面罩、压力以及加用压力斜坡都可以增加患者的依从性,双水平气道正压、持续自动调节装置也可以提高患者对治疗的认可度。患者对病情严重程度、危害性的认知程度等多种因素都可能影响治疗的依从性。Zuzana Dorkova等[15]的研究分析了年龄、性别、AHI、面罩漏气等多个因素与依从性的关系,认为面罩漏气是预测治疗依从性的独立因素。本实验所有入选对象均为AHI≥30次/h的严重OSAS患者,使用经鼻CPAP治疗仪,总体对治疗的认可度较高。治疗开始即对所有受试对象指导正确的方法并调整合适的压力、模式。结果发现依从性不同的2组之间性别、年龄、AHI、既往病史以及使用药物情况无明显差异,而依从性差组的BMI以及面罩漏气明显高于依从性好组。BMI及面罩漏气对治疗依从性均有显著影响,与之前的研究结果有所差异,可能与实验设计不同以及样本量不足有关。
[1] Oliver Z, Hoffstein V. Predicting effective continuous positive airway pressure[J]. Chest, 2000, 117: 1061.
[2] Matthews D R, Hosker J P, Rudenski A S, et al. Homeostasis model assessment: insulin resistance and β-cell function from fasting plasma glucose and insulin concentrations in man[J]. Diabetologia, 1985,28: 412.
[3] D′Agostino R B, Vasan R S, Pencina M J, et al. General cardiovascular risk profile for use in primary care: the Framingham heart study[J]. Circulation, 2008, 117: 743.
[4] Hla K M, Young T B, Bidwell T, et al. Sleep apnea and hypertension: a population-based study[J]. Ann Intern Med, 1994, 120: 382.
[5] Young T, Peppard P E, Palta M, et al. Population-based study of sleep-disordered breathing as a risk factor for hypertension[J]. Arch Intern Med, 1997, 157: 1746.
[6] Bixler E O, Vgontzas A N, Lin H M, et al. Prevalence of sleep-disordered breathing in women: effects of gender[J]. Am J Respir Crit Care Med, 2001, 163: 608.
[7] Virend K, Somers, David P, et al. Sleep apnea and cardiovascular disease[J]. Journal of the American college of Cardiology, 2008, 52: 691.
[8] Ryan S, Taylor C T, McNicholas W T. Predictors of elevated nuclear factor-B-dependent genes in obstructive sleep apnea syndrome[J]. Am J Respir Crit Care Med, 2006, 174: 824.
[9] Barcelo A, Barbe F, Llompart E, et al. Effects of obesity on C-reactive protein level and metabolic disturbances in male patients with obstructive sleep apnea[J]. Am J Med, 2004, 117: 118.
[10] Harsch I A, Konturek P C, Koebnick C, et al. Leptin and ghrelin levels in patients with obstructive sleep apnoea: effect of CPAP treatment[J]. Eur Respir J, 2003, 22: 251.
[11] Thubi E, Shoenfeld Y. The Role of CD40-CD154interactions in autoimmunity and the benefit of disrupting this pathway[J]. Autoimmunity, 2004, 37(6): 457.
[12] Schemthaner G H, Kopp H P, Krzyzanowska K, et al. Soluble CD40L in patients with morbid obesity: significant reduction after bariatric surgery[J]. Eur J Clin Invest, 2006, 36(6): 395.
[13] Kazuyuki Kobayashi, Yoshihiro Nishimura, Temiko Shimada, et al. Effect of Continuous Positive Airway Pressure on Soluble CD40 Ligand in patients with obstructive sleep apnea syndrome[J]. Chest, 2006, 129(3): 632.
[14] Marti S, Sampol G, Muloz X, et al. Mortality in severe sleep apnea-hypopnea syndrome patients: impact of treatment[J]. Eur Respir J, 2002, 20(6): 1511.
[15] Zuzana Dorkova, Darina Petrasova, Angela Molcanyiova, et al. Effects of Continuous positive airway pressure on cardiovascular risk profile in patients with severe obstructive sleep apnea and metabolic syndrome[J]. Chest, 2008, 134: 686.

