黄连醇提物对真菌几丁质合酶的抑制作用
,, , ,倩雯,
(浙江工业大学 生物与环境工程学院,浙江 杭州 310032)
近年来,真菌感染、特别是条件致死性真菌感染发病率在长期应用广谱抗生素、激素、免疫抑制剂和化疗后的病人中逐年增高,已成为近代医学对肿瘤、白血病、糖尿病、放射病和烧伤病人治疗中的疑难问题,越来越受到医学界的重视[1].另一方面,目前临床上使用的抗真菌药物种类有限,而且多数有副作用和抗药性问题,迫切需要开发新型高效广谱并具有选择性毒力的抗真菌药物[2].由于真菌细胞壁几丁质成分是真菌特有的,动植物均不含有几丁质,因此几丁质合成酶是抗真菌剂的理想靶标之一[3-4].黄连是中国的传统中草药,应用广泛,常用于治疗湿热内蒸、百日咳、痞满胀闷、泄泻痢疾、消渴、胆囊炎、痈疽肿毒、中耳炎、急性扁桃体炎、大叶性肺炎、烦躁呕逆、流行性脑脊髓膜炎等,且具有抗放射及促进细胞代谢的作用[5-6].本研究采用酵母细胞作为筛选模型对98种常用中草药的抗真菌活性进行了检测,发现黄连醇提液能挽救酵母在CFW(Calcofluor white)抑制浓度下的生长,黄连醇提液处理后的酵母细胞几丁质含量明显降低,表明黄连醇提液具有抑制酵母几丁质合成酶的活性.
1 材料与方法
1.1 材 料
1.1.1 实验菌株
酿酒酵母(S.cerevisiae)WHU2a由日本广岛大学宫川都吉教授惠赠;酿酒酵母CHT003和酿酒酵母CHT020由本实验室构建并保藏.
1.1.2 实验材料
黄连(CoptischinensisFranch)购自杭州华东大药房;两性霉素B购自上海生工;尼克霉素Z,5-氟胞嘧,灰黄霉素,Calcofluor white均购自Sigma.
1.2 方 法
1.2.1 黄连醇提物的制备
黄连粉碎后,称取80 g,加95%乙醇320 mL,浸泡48 h后用0.22 μm滤膜过滤,黄连醇提取液的浓度为250 mg/mL.
1.2.2 黄连醇提物对酵母在CFW抑制浓度下的生长挽救实验
制备含6 μg/mL CFW的YPD平板备用.挑取活化2 d的酵母WHU2a,接入5 mL YPD液体培养基中,30 ℃,180 r/ min,培养16 h.稀释菌悬液并与4 mL含CFW的上层YPD培养基混匀后倒入含6 μg/mL CFW的YPD平板制成双层平板,使上层含有5×104个/mL酵母细胞和6 μg/mL CFW.将黄连乙醇提取物40 μL滴加在干燥无菌的Whatman 3MM滤纸片(直径6 mm)上,待其乙醇挥发干燥后用无菌镊子夹取带药的滤纸片水平放入皿内上层培养基上,以乙醇40 μL滴加在滤纸片上待其挥发干燥后作为空白对照.另取尼可霉素6 μL(含量为30 μg),滴加在干燥无菌的滤纸片上作为正对照;取两性霉素B 6 μL(含量为6 μg),滴加在干燥无菌的滤纸片上作为负对照.28 ℃培养48 h后,观察药物对酵母生长的挽救现象.
1.2.3 几丁质合成酶缺陷型酵母对黄连醇提物的敏感性实验
1) 黄连醇提物对酵母的抑菌作用的测定
分别挑取活化2 d的酵母WHU2a,CHT020,CHT003,接入5 mL YPD液体培养基的试管中,30 ℃,180 r/min,16 h.稀释菌悬液并与4 mL上层YPD培养基混匀后倒入YPD平板制成双层平板,使上层含有5×104个/mL酵母细胞.取黄连乙醇提取物40 μL,滴加在干燥无菌的滤纸片(直径6 mm)上,待其乙醇挥发干燥后用无菌镊子夹取带药的滤纸片水平放入皿内双层培养基上,以乙醇40 μL滴加滤纸片上待其挥发干燥后作为空白对照.以两性霉素B5 μL(含量为5 μg);5-氟胞嘧啶10 μL(含量为40 μg);灰黄霉素10 μL(含量为100 μg)作为对照.28 ℃,培养48 h后用十字交叉法测量抑菌圈的直径并观察差异,即:抑菌圈直径(mm)=抑菌透明圈直径-6.
2) 黄连醇提物对酵母的最低抑制质量浓度(MIC)的测定
MIC值的测定参照汪倩雯等的微量稀释法[7],并作某些修改.分别挑取活化2 d的酵母WHU2a,CHT020,CHT003单菌落至无菌水中,制成3×103CFU/mL的菌悬液,备用.在96孔板每列8孔中每孔加入100 μL用95%乙醇倍量稀释的黄连醇提液,其质量浓度从高到低依次为250.00,125.00,62.50,31.25,15.63,7.80,3.90,1.95 mg/mL,待其乙醇挥发干燥后,加100 μL的无菌水将黄连溶解.然后,再加100 μL的YPD培养基和100 μL的菌悬液(终质量浓度为1×103CFU/mL).以100 μL的无菌水替代黄连溶液为阴性对照,以两性霉素B替代黄连溶液为阳性对照(终质量浓度依次为4,2,1,0.5,0.25 μg/mL).30 ℃,48 h培养后观察菌体的生长情况,未见菌生长的最低药物浓度即为药物对酵母的最低抑菌浓度(MIC).每个菌株做三个平行实验.
1.2.4 黄连醇提物对酵母细胞几丁质合成的影响
分别取对数生长期的WHU2a,CHT020和CHT003酵母细胞加入到100 mL含有黄连醇提物的YPD培养基,使初始细胞浓度为2×106个/mL,28 ℃,200 r/min,培养20 h.其中,加入的黄连醇提物浓度随菌株而异,对应于WHU2a,CHT020和CHT003分别为1.56 mL,1 mL,0.9 mL,以乙醇代替黄连醇提物作为对照.将培养20 h的酵母细胞3 000 r/min离心5 min,弃上清,加蒸馏水50 mL震荡20 s,待酵母细胞重新悬浮后再次离心.重复该步骤两次以除去培养基杂质.收集酵母细胞,60 ℃烘箱中置放4 h,待其水分充分除去后,加入液氮,充分研磨以使细胞破碎.酵母细胞壁几丁质含量的测定方法参考本研究室已发表的论文[8].
2 结果分析与讨论
2.1 黄连醇提物能缓解CFW对酵母的抑制作用
荧光增白剂(CFW)能与酵母细胞壁中新合成的几丁质结合并抑制其生长,Roncero等研究发现尼克霉素(Nikkomycin Z,NiZ)等几丁质合成酶抑制剂均能使酵母在CFW抑制浓度下的生长得到挽救[9].本实验中,尼克霉素的周围有明显的酵母生长圈,表明尼克霉素具有明显的挽救作用能够解除CFW对酵母的抑制(图1中C),而空白对照以及负对照两性霉素B均没有挽救作用,有趣的是黄连醇提物对酵母生长也有挽救现象(图1中B),由此可以推断黄连醇提物中存在几丁质合成酶抑制剂活性成分.

A—空白对照;B—黄连;C—尼克霉素;D—两性霉素B
2.2 几丁质合成酶缺陷型酵母对黄连醇提物的敏感性
为了进一步验证黄连醇提物具有抑制真菌几丁质合成酶的活性,实验测定和比较了黄连醇提物对于野生型酵母WHU2a,以及2种不同几丁质合成酶缺陷型酵母CHT020和CHT003菌株的抑菌作用,结果见表1.
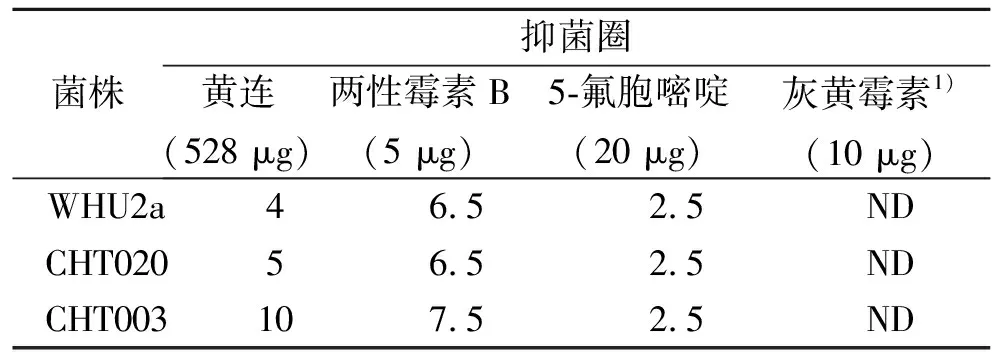
表1 黄连醇提物对三种酵母的抑菌圈
上述实验中,CHT003菌株是Chs1,Chs2基因敲除的酵母菌株,该酵母仅剩下一个Chs3基因,该菌株对几丁质合成酶Ⅲ(CS3)的特异性抑制剂敏感性增加;而CHT020菌株是Chs1,Chs3基因敲除的酵母菌株,该酵母仅剩下一个Chs2基因,该菌株对几丁质合成酶Ⅱ(CS2)的特异性抑制剂敏感性增加[10-11].与野生型菌株WHU2a比较,黄连醇提物对于CHT003有明显的抑制作用,CHT003的抑菌圈比WHU2a的抑菌圈大二倍以上;而CHT020的抑菌圈仅比WHU2a的抑菌圈略微大一些.实验同时比较了两性霉素B、5-氟胞嘧啶、灰黄霉素等具有不同作用机制的常用抗真菌剂对上述三种酵母的抑制作用,结果均无明显的特异性抑制作用,表明这些抗真菌剂的作用靶标不是几丁质合成酶.在本实验的浓度范围内,灰黄霉素对三种酵母均无抑菌作用.实验还进一步测定了黄连醇提物对于WHU2a,CHT020,CHT003的MIC值,实验结果见表2.
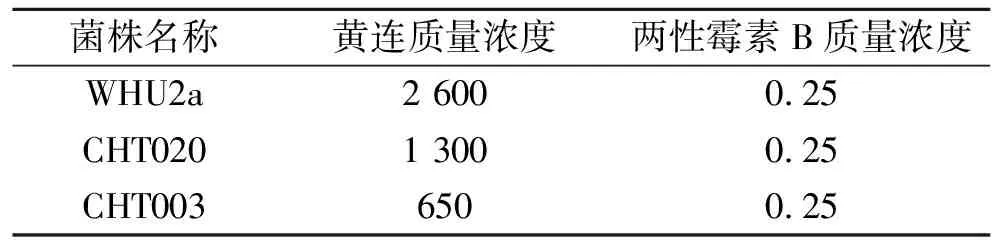
表2 黄连醇提物对三种酵母的MIC值
从表2中可以看出:几丁质合成酶缺陷型酵母(CHT003和CHT020)对黄连醇提物更加敏感,尤其CHT003的敏感性是野生酵母的4倍.表2实验结果不仅与正筛选结果(图1)一致,而且进一步揭示了黄连醇提物中明显存在几丁质合成酶Ⅲ(CS3)的特异性抑制活性成分.由于在酵母细胞中90%的几丁质是由几丁质合成酶Ⅲ(CS3)合成的,可以预期黄连醇提物处理后酵母细胞几丁质含量会明显下降.
2.3 黄连醇提物处理后酵母细胞几丁质含量的变化
由于几丁质是由β-(1,4)-2-乙酰氨基-2-脱氧-D-葡萄糖残基呈线形连接而成的生物大分子聚合物,因此,可通过测酵母细胞中N-乙酰-D-葡糖胺的量来确定细胞中的几丁质含量[8].实验得出标准曲线公式为x=(y-0.011 5)/0.004 5,酵母细胞中几丁质含量是三次实验结果的平均值如图2所示.
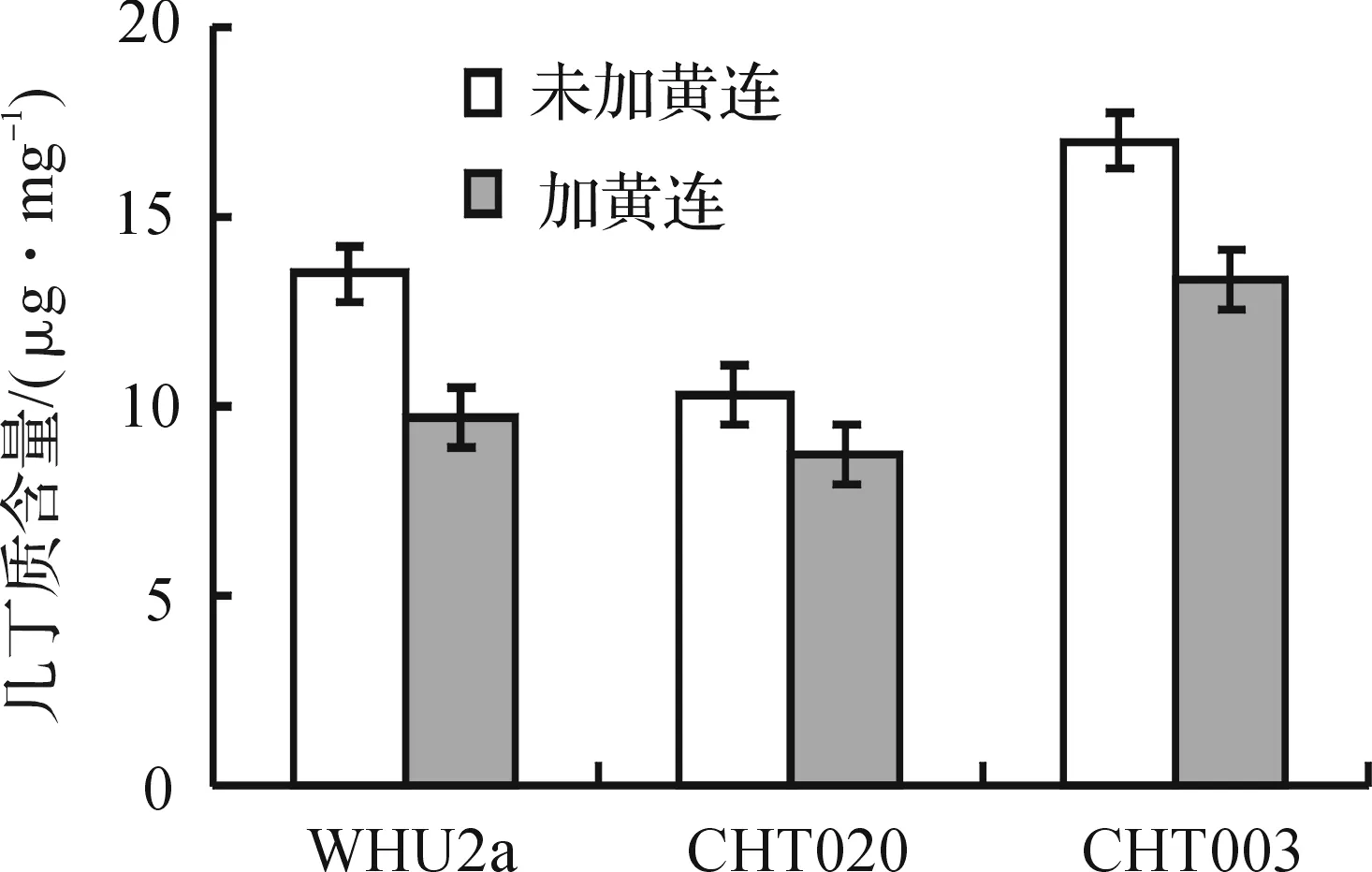
图2 酵母细胞中的几丁质含量
对未加黄连的实验结果进行比较后发现,菌株CHT003的几丁质含量达到17 μg/mg,比野生型WHU2a还高20%.Garcia-Rodriguez等发现敲除酿酒酵母中葡聚糖合成酶基因fks1后会引起CS3活性大幅提高[16].Lesage等也报道了酿酒酵母细胞壁几丁质合成中的互补现象,多数参与细胞壁合成的基因被敲除后都会引起CS3活性和几丁质含量的明显提高[17].CS3负责酵母中90%以上几丁质的合成.由此可以解释CHT003的几丁质含量比野生型更高是因为Chs1和Chs2基因敲除促进了Chs3基因表达的结果.加黄连后的实验结果与我们的预期相符,黄连醇提物处理后的酿酒酵母WHU2a细胞壁中几丁质含量降低了28%,CHT003细胞壁中几丁质含量降低22.6%,而黄连醇提物处理后的酿酒酵母CHT020几丁质含量降低较少.这些结果进一步证实了中药黄连醇提取物中含有抑制酵母细胞壁几丁质合成酶Ⅲ的活性物质.
2.4 讨 论
黄连是一种传统的中药,具有很高的药用价值.对其药理作用也有不少研究.Kobayashi等从黄连根茎中分离出2个原小檗碱生物碱(表小檗碱和groenlandicine),研究发现分别是拓扑异构酶Ⅰ和Ⅱ的抑制剂,对细胞DNA的复制、转录和重组等起重要作用[12].Hirano等从黄连中分离到落叶松脂素和反式阿魏酸对羟基苯乙酯,研究表明:二者为自由基清除剂,均显示SOD样作用,落叶松脂素作为超氧化物自由基清除剂比抗坏血酸更为有效[13].Kong等发现黄连中的小檗碱有降低胆固醇作用[6].黄连也具有抗真菌作用,但是其作用机理还不清楚[14].
Park等曾报道过黄连中的巴马亭在体外会抑制假丝酵母的几丁质合成酶活性,但没有提到是哪一种几丁质合成酶[15].本研究用酿酒酵母作为模型,通过检测98种常用中草药的醇提物对酵母在CFW抑制浓度下的生长挽救现象,发现黄连醇提物对酵母几丁质合成酶有抑制作用.酿酒酵母有3个几丁质合成酶结构基因Chs1,Chs2和Chs3,其中Chs2和Chs3具有重要的生物学功能[10].Chs2与有丝分裂末期的母细胞和子细胞之间合成初级隔膜有关;Chs3与细胞出芽位点处合成几丁质环有关,并与正常细胞中90%的几丁质合成有关.Chs1及Chs2基因敲除后的几丁质合成酶缺陷型酵母CHT003,以及Chs1及Chs3基因敲除后的几丁质合成酶缺陷型酵母CHT020都能正常生长;但CHT003对几丁质合成酶Ⅲ的抑制剂高度敏感而CHT020对几丁质合成酶Ⅱ的抑制剂高度敏感[11].本实验观测到黄连醇提物对野生型酵母,CHT020以及CHT003的MIC值分别为2 600,1 300,650 mg/L,表明黄连醇提物中主要含有抑制几丁质合成酶Ⅲ的活性成分;几丁质含量测定实验揭示,黄连醇提物处理后野生型酵母和CHT003几丁质含量均大幅降低,而CHT020几丁质含量降低较少,进一步验证了上述结果.黄连醇提物中具有抑制真菌几丁质合成酶Ⅲ的活性成分,可以作为特异性抑制真菌药物值得进一步研究.
3 结 论
本实验以酵母细胞为模型,研究了黄连醇提液对真菌细胞壁几丁质合酶的抑制作用,通过检测黄连醇提液对酵母在荧光增白剂(Calcofluor white,CFW)抑制浓度下的生长挽救现象,比较黄连醇提液对野生型和几丁质合酶缺陷型酵母菌株抑制作用的差异,以及测定黄连醇提物处理后酵母细胞壁几丁质含量的变化,结果显示黄连醇提液能挽救酵母在CFW抑制浓度下的生长,几丁质合酶缺陷型菌株CHT003对黄连醇提液的敏感性比野生型大4倍,黄连醇提液处理后野生型酵母和缺陷型菌株CHT003的几丁质含量明显降低.说明黄连醇提物具有明显的抑制酵母细胞壁几丁质合酶Ⅲ的活性成分.
参考文献:
[1]LAI C C, TAN C K, HUANG Y T, et al. Current challenges in the management of invasive fungal infections[J]. J Infect Chemother,2008,14:77-85.
[2]FRANCOIS I E, AERTS A M, CAMMUE B P, et al. Currently used antimycotics: spectrum, mode of action and resistance occurrence[J]. Curr Drug Targets,2005,6:895-907.
[3]BEHR J B. Chitin synthase as an antifungal target recent advances[J]. Current Medicinal Chemistry-Anti-Infective Agents,2003,2(2):173-189.
[4]LESAGE G, BUSSEY H. Cell wall assembly in Saccharomyces cerevisiae[J]. Microbiol Mol Biol Rev,2006,70(2):317-343.
[5]田智勇,李振国.黄连的研究新进展[J].时珍国医国药,2004,15(10):704-706.
[6]KONG W, WEI J, ABIDI P, et al. Berberine is a novel cholesterol-lowering drug working through a unique mechanism distinct from statins[J]. Nat Med,2004,10:1344-1351.
[7]汪倩雯,汪琨,杨霄,等.89种中草药醇提物体外抗菌活性的研究[J].浙江工业大学学报,2009,37(3):289-294.
[8]CUI Zhi-feng, DING Zhen-ke, YANG Xiao, et al. Gene disruption and characterization of a class V chitin synthase in Botrytis cinerea[J]. Can J Microbiol,2009,55(11):1267-1274.
[9]RONCERO C, VALDIVIESO M H, RIBAS J C, et al. Isolation and characterization of Saccharomyces cerevisiae mutants resistant to Calcofluor White[J]. J Bacteriol,1988,170:1950-1954.
[10]SHAW J A, MOL P C, BOWERS B. The function of chitin synthases 2 and 3 in the Saccharomyces cerevisiae cell cycle[J]. J Cell Biol,1991,114(1):111-123.
[11]HWANG E I, KWON B M, LEE S H, et al. Obovatols, new chitin synthase 2 inhibitors of Sacchromyces cerevisiae from Magnolia obovata[J]. J Antimicrob Chemoth,2002,49:95-101.
[12]KOBAYASHIY, YAMASHITA Y, FUJII N, et al. Inhibitors of DNA toposiomeraes and isolated from the Coptis Rhizomes[J]. Planta Med,1995,61(5):414-417.
[13]HIRANO H,TAKASHI T,TOSHIO Y , et a1. Isolation of free radical scavenger from Coptidis Rhizoma[J].Nat Med,1997,51(6):539-540.
[14]LEE S H, CHANG KS, S U M S, et al. Effects of some Chinese medicinal plant extracts on five different fungi[J]. Food Control,2007,18:1547-1554.
[15]PARK K S, KANG K C, KIM J H, et al. Differential inhibitory effects of protoberberines on sterol and chitin biosyntheses in Candida albicans[J]. J Antimicrob Chemoth,1999,43:667-674.
[16]GARCIA-RODRIGUEZ L J, TRILLA J A, CASTRO C, et al. Characterization of the chitin biosynthesis process as a compensatory mechanism in the fks1 mutant of Saccharomyces cerevisiae[J]. FEBS Letters,2000,478:84-88.
[17]LESAGE G, SHAPIRO J, SPECHT C A, et al. An interactional network of genes involved in chitin synthesis in Saccharomyces cerevisiae[J]. BMC Genet,2005,6:6-8.

