血清γ谷氨酰转肽酶与BMI的相关性研究
王晶莹 傅晓英
γ-谷氨酰转肽酶(GGT)是非酒精性脂肪肝患者的肝脏酶学指标,近年来研究发现GGT不仅参与γ-谷氨酰循环和谷胱甘肽的水解,而且与代谢综合征及肥胖密切相关[1]。BMI是临床上应用最为广泛的评价肥胖程度的指标之一,能较好地评估人体的肥胖程度。当今社会随着生活水平不断提高,人们饮食结构及生活方式发生了很大改变,能量摄入过剩普遍存在于广大人群之中,由于能量过剩所致的肥胖的发病率也呈逐年上升的趋势,特别是轻体力劳动者。本研究通过对某轻体力劳动单位职工进行体格检查及生化指标检测,探讨血清GGT与BMI水平间的关系,旨在为糖尿病、代谢综合征等疾病的早期防治提供参考数据。
对象与方法
一、研究对象
采用横断面研究法,纳入对象为2012年2月至3月在我院体检的广州市某轻体力劳动单位职工266名,对其进行标准化的问卷调查、体格检查、生化检测。本研究的排除标准如下:排除既往诊断为糖尿病、高血压、高脂血症、甲状腺疾病、急慢性肾脏疾病、恶性肿瘤者;排除患有脂肪肝、自身免疫性肝炎、肝囊肿、肝脓肿、肝脏血管瘤、肝脏局部病变、肝内胆管结石等可能引起肝功能异常的疾病;排除4周内使用β受体阻滞剂、调脂药、激素类药物等影响糖脂代谢药物者以及接受胰岛素注射治疗者。按上述标准排除52名职工,资料不完整的42名亦被排除,最终纳入研究对象共172名,其中男98名、女74名,年龄23~78岁、中位年龄45岁。
二、研究方法
1.体格检查
测定受试者的身高、体质量、腹围、静息状态下血压。使用全自动档光电体检机SK-TJ2通过接触式测量身高,精密传感器测量体质量,身高测量精确到0.5 cm,体质量测量精确到0.5 kg;腹围测定方法为:受检者双手下垂直立,双脚分开与肩同宽,平静呼吸,测量部位平脐用皮尺绕1周,以cm为单位,精确到0.1 cm;血压的测量使用OMRON HEM-906血压计,待研究对象静坐5 min后,取其非优势臂测量3次,每次间隔至少1 min,取2次均值纳入分析。
2.生化检测
受试者晨起空腹(>8 h)抽取肘静脉血测定空腹血糖、HDL-C、LDL-C、甘油三酯、肝功能4项[AST、ALT、碱性磷酸酶(ALP)、GGT]、血肌酐。所有生化指标采用美国雅培AREOSET型全自动生化分析仪检测,甘油三酯采用酶偶联比色法测量,HDL-C、LDL-C采用直接法检测,空腹血糖采用葡萄酶氧化法检测。
3.影像学测定
由具有5年以上工作经验的B超医生完成肝脏B超检查。采用PHILIPS HD7 B型超声诊断仪,探头型号C5-2,频率为7.5 MHz。所有受试者测量肝右斜径。
4.判定标准与分组情况
BMI=体质量(kg)/身高2(m2),依据中国疾病预防控制中心《慢性病综合干预医生工作指南》中提出判断中国成年人超重和肥胖程度的界限值分4组:BMI<18.5定义为体质量过低;BMI 18.5~23.9定义为正常体质量,BMI 24~27.9定义为超重,BMI≥28定义为肥胖[2]。
将所有研究对向分为男女两组,依据男性组和女性组各自的GGT四分位数分别分为4组,从GGT第1四分位至第4四分位对各变量进行分析。
三、统计学处理
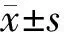
结 果
一、不同性别组一般资料比较
男性组与女性组的BMI、腹围、血压、肝右斜径、ALT、GGT、血肌酐、HDL-C、LDL-C、甘油三酯及空腹血糖比较差异均有统计学意义,见表1。
二、体质量过低组、正常体质量组、超体质量组、肥胖组一般资料比较
根据BMI水平的不同,随着BMI水平的增加,4组间年龄、腹围、收缩压、舒张压、肝右斜径、ALT、AST、GGT、ALP、血肌酐、甘油三酯、空腹血糖各指标比较差异有统计学意义(P<0.05),而心率、HDL-C、LDL-C比较差异无统计学意义(P>0.05)。见表2。
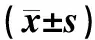
表1 男性组与女性组的资料比较
三、血清GGT与各代谢指标之间的关系
男性组GGT四分位切点分别为≤20 U/L、21~35 U/L、36~47 U/L、≥48 U/L,女性组分别为<12 U/L、12~15 U/L、16~25 U/L、≥26 U/L。随着GGT水平上升,男性组与女性组的BMI值均逐步升高。在男性组的4个四分位切点组间,BMI、腹围、心率、舒张压、ALT、AST、ALP比较差异有统计学意义(P<0.05),见表3。在女性组4个四分位切点组间,ALT、AST、ALP、HDL-C、甘油三酯比较差异有统计学意义(P<0.05),见表4。
四、Pearson相关分析结果
Pearson相关分析显示,男性组GGT水平与BMI、腹围、心率、肝右斜径、ALT、AST、ALP呈正相关,女性组GGT水平与BMI、腹围、收缩压、舒张压、ALT、AST、ALP、血肌酐、甘油三酯呈正相关,与HDL-C呈负相关,见表5。
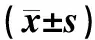
表2 体质量过低组、正常体质量组、超重组、肥胖组各组的资料比较
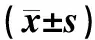
表3 男性组的4个GGT四分位切点组的资料比较
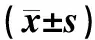
表4 女性组的4个GGT四分位切点组的资料比较

表5 血清GGT与各代谢指标之间的相关性
五、多元逐步回归分析结果
以GGT为自变量,分别以BMI、腹围为因变量,GGT每增加1 U/L,BMI增加0.063 kg/m2,(P<0.001)、腹围增加0.169 cm(P<0.001),表明随着GGT水平的增加,BMI、腹围均呈上升的趋势。
分别以BMI、腹围为因变量,以性别、年龄、GGT为自变量进行分析,结果提示GGT可以显著影响BMI(R2=0.314,β=0.059,P<0.001)及腹围(R2=0.400,β=0.113,P<0.001);分别以BMI、腹围为因变量,以性别、年龄、GGT、肝右斜径、ALT、AST、ALP、血肌酐、HDL-C、LDL-C、甘油三酯、空腹血糖为自变量进行分析,结果提示GGT未独立影响腹围(R2=0.776,β=-0.001,P=0.978),却是BMI独立的影响因素(R2=0.750,β=0.025,P=0.018)。
讨 论
临床已证实GGT与代谢综合征的发生密切相关[3]。肥胖与代谢综合征两者之间也存在着紧密的联系,肥胖是遗传-环境-代谢等多种因素所致的临床病理综合征,肥胖与高血压、冠状动脉粥样硬化性心脏病、糖尿病、脑卒中等多种临床疾病密切相关[3-4]。BMI是WHO公布的用于评价成人肥胖的指标,在我国已建立了适合中国健康人群的BMI参考值范围[2]。肥胖患者体内的脂肪组织增多,脂肪组织可以产生多种脂肪细胞因子、炎症物质,这些均与胰岛素抵抗及代谢综合征的发生密切相关,研究发现GGT可以通过影响瘦素、脂联素等脂肪源性的细胞因子的活性使抑制胰岛素分泌的作用减弱,正常反馈轴被破坏,从而导致高胰岛素血症和胰岛素抵抗的发生,其在代谢综合征的发生发展中也起到了重要的作用[5]。许梅花[6]的研究结果表明随着GGT水平的升高朝鲜族及汉族男性BMI、腰围平均水平均呈增高的趋势,差异具有统计学意义。Lim等[7]在美国第3次的健康与营养调查中显示了GGT与BMI和2型糖尿病之间的关系,其中论述了GGT处于正常高值或升高水平时,BMI与2型糖尿病两者间有明显的正相关性,且与胰岛素抵抗指数相关。这些均提示GGT与肥胖之间可能通过胰岛素抵抗、炎症因子、氧化应激等因素有着密切的联系。
本研究发现:在此研究人群中,超重组与肥胖组人数较多,提示轻体力劳动者中肥胖与超重的现象也值得重视与关注。GGT值在体质量过低组、正常体质量组、超体质量组、肥胖组中逐渐升高(P<0.05),表明随着BMI的升高,GGT的值也呈上升的趋势。采用Pearson相关分析显示,不论男女,GGT水平均与体质量、BMI、腹围、ALT、AST、ALP呈正相关(P<0.05),这与Framingham等于1997年的研究有相似之处。但由于本研究人群均为轻体力劳动者,GGT与血压及血脂的相关性仅在女性组有统计学意义,而男性组未显示有统计学意义,这可能与研究样本量较少,样本人群的工作性质较为特殊有关,本研究为横断面研究,尚缺乏胆红素、尿酸、血清蛋白等其他肝功能指标数据,可能未能完全排除肝脏代谢异常的人群。多元逐步回归分析提示GGT每增加1 U/L,BMI增加0.063 kg/m2,腹围增加0.169 cm,表明随着GGT水平的增加,BMI、腹围均增加,在调整了年龄、性别等影响因素后,GGT可显著影响BMI及腹围,而在调整了性别、年龄、GGT、肝右斜径、ALT、AST、ALP、血肌酐、HDL、LDL、甘油三酯、空腹血糖等因素后,GGT与BMI独立相关,考虑GGT可能与其他的协同因素(胆红素、尿酸、血清蛋白)共同影响腹围,GGT与腹围的相关性仍有待研究。
根据对该研究人群的研究结果我们建议:此样本人群为轻体力劳动人群,其工作压力及工作强度较高,发生代谢综合征及糖脂代谢紊乱疾病的风险较高,为了更好地预防肥胖、高血压、脂肪肝等糖脂代谢紊乱相关性的疾病,应积极鼓励人们改变生活方式,增加体力活动、矫正引起过度进食或活动不足的行为和习惯,尽量将BMI控制在正常范围内。有研究报道,通过改善生活方式可使患者的GGT水平降低,GGT水平的降低可使心血管获益。因此,血清GGT可能可作为肥胖等疾病的早期诊断及危险分级的指标,并可能作为减肥及治疗脂肪肝过程中的观察指标,但其临床应用尚需进一步的研究。
[1] Gautier A, Balkau B, Lange C, et al. Risk factors for incident type 2 diabetes in individuals with a BMI of<27kg /m2: the role of gamma-glutamyltransferase. Data from an epidemiological study on the insulin resistance syndrome(DESIR). Diabetologia, 2010, 53: 247-253.
[2] 中国疾病预防控制中心.慢性病综合干预医生工作指南. 北京:人民出版社,2010:21-24.
[3] Banderas DZ, Escobedo J, Gonzalez E, et al. γ Glutamyltransferase: a marker of nonalcoholic fatty liver disease in patients with the metabolic syndrome. Eur J Gastroenterol Hepatol,2012,24,805-810.
[4] Zindah M, Belbeisi A,Walke H,et al. Obesity and diabetes in Jordan: findings from the behavioral risk factor surveillance system 2004. Prev Chronic Dis, 2008, 5: A17.
[5] Wozniak SE, Gee LL, Wachtel MS, et al. Adipose tissue: the new endocrine organ? A review article. Diq Dis Sci, 2009, 54: 1847-1856.
[6] 许梅花,朴鲜女,方今女,等. 延边地区朝鲜族和汉族男性血清γ-谷氨酰转肽酶分布特征与多种代谢指标的相关性. 延边大学医学学报,2012,35:189-192.
[7] Lim JS, Lee DH, Park JY, et al. A strong interaction between serum gamma- glutamyltransferase and obesity on the risk of prevalent type 2 diabetes: results from the Third National Health and Nutrition Examination Survey. Clin Chem, 2007, 53: 1092-1098.

